
- •Технологія водопідготовки лабораторний практикум
- •«Хімічна технологія»
- •Передмова
- •Назва лабораторних робіт, їх зміст, об'єм і модулі, до яких вони належать та назви модулів
- •Система критеріїв оцінювання знань з лабораторних робіт
- •Модуль № 1
- •Модуль № 2
- •Яка призначається для питних і виробничих потреб»
- •Модуль № 3
- •Принцип компановки технологічних схем»
- •Модуль № 4
- •Модуль № 5
- •Модуль № 6
- •Модуль № 7
- •Правила оформлення лабораторних робіт
- •Техніка безпеки в хімічній лабораторії
- •Визначення фізичних показників якості води поверхневого джерела
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •Для отримання шкали кольоровості
- •Очікуваного вмісту зависі
- •3 Вимоги до звіту
- •4 Контрольні запитання
- •5 Література
- •Визначення ступеня мінералізації дніпрової води
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •Прожареного залишку
- •3 Вимоги до звіту
- •4 Контрольні запитання
- •5 Література
- •Пом’якшення і допом’якшення природної води реагентними методами
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •І допом’якшення води фосфатним методом
- •5 Контрольні запитання
- •6 Література
- •Визначення хлорпоглинаємості і показника, який відображає як хлорується вода
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •Як хлорується вода
- •5 Контрольні запитання
- •6 Література
- •Побудова градуювального графіка
- •1 Метод вимірювання
- •2 Порядок виконання роботи
- •3 Вимоги до звіту
- •4 Контрольні запитання
- •5 Література
- •Визначення оптимальної дози коагулянту
- •1 Фізико – хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •5 Контрольні запитання
- •6 Література
- •Вивчення впливу вапнування на процес коагуляційної очистки води
- •1 Фізико-хімічні основи процесу
- •2 Порядок виконання роботи
- •3 Методи контролю
- •4 Вимоги до звіту
- •5 Контрольні запитання
- •6 Література
- •Визначення динамічної обмінної ємності
- •1 Фізико-хімічні основи процесу
- •3 Приготування розчинів
- •4 Порядок виконання роботи
- •До проскакування у фільтрат іонів кальцію
- •5 Методи контролю
- •6 Вимоги до звіту
- •7 Контрольні запитання
- •8 Література
- •Вивчення процесів опріснення і знесолення води
- •1 Фізико-хімічні основи процесу
- •3 Приготування розчинів
- •4 Опис лабораторної установки
- •5 Порядок виконання роботи
- •6 Методи контролю
- •7 Вимоги до звіту
- •Шляхом перегонки
- •8 Контрольні запитання
- •9 Література
- •Список рекомендованої літератури
- •Додаток а Приклад оформлення титульного аркушу лабораторної роботи
- •Додаток б Приклад оформлення титульного аркушу звіту з лабораторних робіт
5 Контрольні запитання
Що призводить до сповільнення процесу гідролізу коагулянту зліва направо?
Назвіть необхідну умову для швидкого і найбільш повного проходження процесу гідролізу коагулянту.
Що забезпечує воді деякий лужний резерв?
Які іони зв’язують іони водню, що утворилися під час коагулювання? Напишіть рівняння реакції.
За рахунок чого утворюється буферна система води; яким чином вона впливає на гідроліз коагулянту?
В якому випадку підлужують воду? Чим підлужують воду?
Чим пояснюється ефект підлужування води?
На підставі якого рівняння можна підрахувати кількість гідрокарбонат-іонів, необхідних для нейтралізації кислоти, яка утворюється при гідролізі коагулянту?
За якою формулою розраховується кількість (доза) лугу, що необхідна для гідролізу коагулянту?
Як вапнування впливає на процес коагуляційної очистки води?
При якій температурі води проводять процес коагулювання з вапнуванням?
Поясніть порядок виконання лабораторної роботи.
Поясніть, що означає від’ємне значення дози лугу.
Як визначається прозорість води?
Як визначається загальна лужність води?
Як визначається залишковий алюміній в очищеній воді?
Як визначається оптимальна доза коагулянту?
6 Література
Кульський Л.А., Накорчевская В.Ф. Химия воды. Физико-химические процессы обработки природных и сточных вод. – К.: Вища школа. Головне вид-во, 1983. – 240 с.
Кульский Л.А., Строкач П.П. Технология очистки природных вод. – К.: Вища школа. Головне вид-во, 1986. – 352 с.
Кульский Л.А. Теоретические основы и технология кондиционирования воды. – К.: Наукова думка, 1971. – 499 с.
Кожинов В.Ф. Очистка питьевой и технологической воды. Примеры и расчеты. – М.: Издательство литературы по строительству, 1971. – 303 с.
Лифшиц О.В. Справочник по водоподготовке котельных установок. – М.: Энергия, 1976. – 288 с.
Набиванець Б.Й., Сухан В.В., Калабіна Л.В. Аналітична хімія природного середовища. – К.: Либідь, 1996. – 304 с.
Сегеда А.С. Аналітична хімія. Кількісний аналіз. – К.: Фітосоціоцентр. 2006. – 544 с.
Хімія води і водних розчинів / Б.Т. Камінський, Д.Б. Камінський, Б.М. Федишин. – Житомир: ЖІТІ, 2000. – 419 с.
лабораторна робота № 8
Визначення динамічної обмінної ємності
катіоніту КУ-2 до проскакування у фільтрат іонів Са2+
Мета роботи. Визначити динамічну обмінну ємність катіоніту КУ-2 до проскакування у фільтрат іонів Са2+ за схемою Nа–катіонування водного розчину СаСl2. Провести регенерацію катіоніту натрій хлоридом і відмивку його дистильованою водою.
1 Фізико-хімічні основи процесу
Сутність іонного обміну засновано на здатності іонообмінних матеріалів, або іонітів, поглинати з розчину електроліту катіони (аніони) в обмін на еквівалентну кількість іонів іоніту.
Умовно іоніт можна розділити на три складові частини:
матриця (каркас);
фіксовані іони, що закріплені на матриці, які не здатні перейти фази іоніту у зовнішній розчин;
протиіони (обмінні іони) іоніту, кількість яких еквівалентна кількості фіксованих іонів, які протилежні їм за знаком.
Ці іони здатні перейти у зовнішній розчин в обмін на точно еквівалентну кількість інших іонів того самого знака, які надходять в іоніт із зовнішнього розчину (одмінних іонів розчину).
За природою матриці іоніти поділяють на неорганічні (мінеральні) і органічні, які в свою чергу бувають природними і штучними (синтетичними) (див. рисунок 1).
За зовнішнім виглядом і ступенем дисперсності іоніти поділяють на порошкоподібні, зернисті, гранульовані, формовані, волокнисті, рідкі.
За ступенем пористості іоніти бувають гелеві, ізопористі і макропористі (мезопористі).
За типом і знаком протиіонів іоніти поділяють на такі:
катіоніти, здатні до обміну катіонів;
аніоніти, здатні до обміну аніонів;
амфоліти, здатні залежно від умов середовища до обміну як катіонів, так і аніонів.
Катіони можуть перебувати у водневій (Н-формі), сольовій (натрієвій, кальцієвій тощо) і змішаній формах.
Аніоніти можуть бути в гідроксидній (ОН-формі), сольовій (хлоридній, сульфатній тощо) і змішаних формах.
Амфоліти бувають у воднево-гідроксильній, воднево-сольовій, гідроксильно-сольовій і сольовій формах.
Залежно від сили іоніту у водних розчинах розрізняють сильно-, середньо-, слабко- і дуже слабко іонізовані іоніти. Катіоніти поділяються на сильнокислотні (КУ-2, КУ-2-8, КУ-1 тощо), середньокислотні (КФ-1, КФ-2), слабкокислотні (КБ-1, КБ-4 тощо) і дуже слабкокислотні.
Аніоніти поділяються на сильноосновні (АВ-17 тощо), середньоосновні (ЕДЕ-10П, АВ-16), слабкоосновні (АН-22, АН-2Ф тощо) і дуже слабкоосновні.
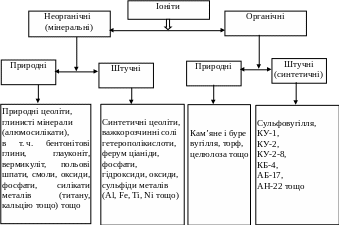
Рисунок 1 – Класифікація іонітів за природою матриці
Іонообмінні процеси використовують здебільшого для пом’якшення, знесолення та опріснення природних або стічних вод.
Процес обробки води методом іонного обміну, в результаті якого відбувається обмін катіонів, називається, катіонуванням. Існують такі види катіонування:
Nа – катіонування (одноступеневе і двоступеневе);
Н-Nа – катіонування (паралельне, послідовне і сумісне).
Натрій-катіонітовий (Nа-катіонітовий) метод використовують для пом’якшення підземних і поверхневих вод із вмістом завислих речовин не більше за 5-8 мг/дм3 і кольоровістю до 30 град. Твердість води може бути знижена при одноступеневому Nа-катіонуванні до 0,03 – 0,05 мг∙екв/дм3, при двоступеневому – до 0,01 мг∙екв/дм3.
При фільтруванні води через шар Nа-катіоніту відбуваються реакції обміну
2Na[кат] + Ca(HCO3)2 Ca[кат]2+ 2NaHCO3;
2Na[кат] + Mg(HCO3)2 Mg[кат]2 + 2NaHCO3;
2Na[кат] + CaSO4 Ca[кат]2 + Na2SO4;
2Na[кат] + MgSO4 Mg[кат]2 + Na2SO4.
Швидкість іонного обміну залежить від валентності іонів, їх заряду, ступеня гідратації тощо. Чим більше заряд катіонів, тим більше їх енергія входження в катіоніт. Ця закономірність змінюється при збільшенні концентрації катіонів (наприклад, при пропусканні через катіоніт концентрованого розчину натрій хлориду).
Для катіонів однакової валентності енергія входження в катіоніт залежить від ступеня їх гідратації: енергія входження Н+ у 17 разів більша, ніж у Nа+, і в 4 рази більша, ніж у Са2+.
Основною характеристикою іонів є обмінна ємність – кількість функціональних активних груп в одиниці маси або об’єму іоніту, які можуть обмінюватися протягом циклу фільтрування. Обмінну ємність іоніту виражають в мг∙екв/дм3, мг–екв/г тощо.
Обмінна ємність буває статичною (СОЄ) і динамічною (ДОЄ).
Статистична обмінна ємність – це кількість іонів , яка поглинається одиницею маси або об’єму іоніту в статичних умовах до встановлення рівноваги.
Кількість іонів, яка поглинається одиницею маси або об’єму іоніту в динамічних умовах, тобто при фільтруванні розчину крізь шар іоніту до проскакування у фільтрат іонів, які вилучаються, складає динамічну обмінну ємність до проскакування (ДОЄ пр). ДОЄ пр. є деякою частиною статичної ємності іоніту.
Після проскакування іонів у розчин концентрація їх у фільтраті поступово підвищується і, нарешті, практично досягає вихідної концентрації цих іонів у розчині. Тоді ємність іоніту досягає так званої повної динамічної обмінної ємності (ПДОЄ), яка також не дорівнює статичній ємності.
Після виснаження робочої обмінної ємності катіоніт регенерують. Для регенерації Н-катіонітових фільтрів використовують 1 – 1,5 % розчин сульфатної кислоти. Більшу концентрацію Н2SО4 приймати не рекомендується , оскільки при цьому на зернах катіоніту і у щілинах дренажу можливо осадження гіпсу. Швидкість перепускання регенераційного розчину Н2SО4 через шар Н-катіоніту становить 5 м/год.
Регенерацію Nа-катіонітових фільтрів проводять розчином натрію хлористого з масовою часткою 5 – 8 % у відповідності зі СНиПом. Швидкість фільтрування розчину NаСl через катіоніт приймають такий ,що дорівнює 3 – 4 м/год.
В процесі регенерації відбуваються реакції :
Са[кат]2 + 2NaCl 2Na[кат] + CaCl2
Mg[кат]2 + 2NaCl 2Na[кат] + MgCl2
Натрій хлористий використовується для регенерації через те, що він доступний, а також внаслідок того, що утворюються добре розчинні солі СаСl2 і МgСl2, які легко видаляються з регенераційним розчином і відмивочною водою.
обладнання
Бюретки ємкістю 25 см3
Колби конічні широкогорлі ємкістю 250 см3
Колби конічні ємкістю 250 см3
Секундомір
Склянки ємкістю 1,2 дм3
Скляний фільтр з пористою скляною пластиною, засипаний катіонітом КУ-2 в Nа-формі
Піпетки ємкістю 1, 2, 5 см3
Піпетки Мора ємкістю 100 см3
Фільтрувальний папір
Циліндри ємкістю 5, 50, 500 см3
Розчини
Вода дистильована
Натрій хлорид (NаСl), розчин з масовою часткою 8 %
Кальцій хлорид (СаСl2), розчин з концентрацією 0,0035 н (N)
Розчин індикатора метилоранжу
Розчин індикатора фенолфталеїну
Натрій гідроксид (NаОН), розчин з масовою часткою 4 %
Натрій гідроксид (NаОН), розчин з концентраціями 1; 2 моль/дм3
Трилон Б (комплексон ІІІ – динатрій етилендіамін тетраацетат), розчин з концентрацією 0,02 моль/дм3
Індикатор мурексид (суміш із сіллю NаCl)
Сульфатна кислота, H2SO4 розчин з концентрацією 0,5 моль/дм3
Калій хромат(VI) (К2СrО4), розчин з концентрацією 1 моль/дм3
Аргентум нітрат (V) (АgNО3), розчини з концентраціями 0,1; 0,05 і 0,02 моль/дм3
