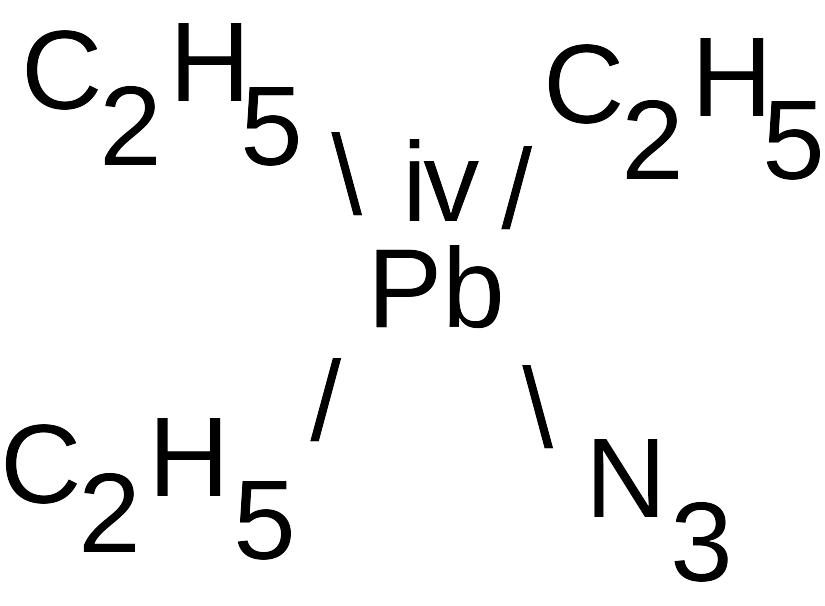- •Введение
- •Глава 1. Общая характеристика инициирующих взрывчатых веществ.
- •1.1. Классификация взрывчатых веществ.
- •1.2. Важнейшие представители ивв
- •1.3. Зависимость инициирующей способности ивв от различных факторов
- •1.4. Основные требования, предъявляемые к ивв
- •Глава 2. Соли гремучей кислоты (фульминаты)
- •2.1. Гремучая кислота и ее соли
- •2.2. Свойства гремучей ртути
- •2.3. Взрывчатые свойства гремучей ртути
- •2.4. Производство гремучей ртути
- •2.4.1. Производство гремучей ртути в стеклянной аппаратуре
- •В) Получение гремучей ртути.
- •2.4.2. Получение гремучей ртути в металлической аппаратуре
- •Глава 3.
- •3.1. Открытие азотистоводородной кислоты
- •Полученный азид бензойной кислоты обрабатывали едким натром.
- •3.2. Методы получения hn3 и ее солей
- •3.3. Строение азотистоводородной кислоты
- •3.4. Свойства азотистоводородной кислоты.
- •3.5. Азиды щелочных и щелочноземельных металлов
- •3.6. Промышленные способы получения азида натрия.
- •3.6.1. Производство азида натрия из семиоксида (закиси) азота и амида натрия.
- •3.6.1.1. Производство семиоксида (закиси) азота
- •3.6.1.2. Свойства и технология получения амида натрия
- •3.6.1.3. Получение азида натрия по методу Вислиценуса.
- •3.6.2. Получение азида натрия из гидразина и этилнитрита
- •3.6.2.1. Получение и свойства гидразина
- •3.6.2.2. Технология производства азида натрия
- •3.7. Азид свинца и его физико-химические свойства
- •3.8. Химические свойства азида свинца
- •3.9. Производство азида свинца
- •3.9.1. Декстриновый азид свинца
- •3.9.2. Получение кристаллического азида свинца
- •3.9.3. Карбоксиметилцеллюлозный азид свинца.
- •3.9.4. Поливинилспиртовый азид свинца.
- •3.9.5. Английский служебный азид свинца.
- •3.9.6. Достоинства и недостатки различных видов промышленного азида свинца.
- •3.10. Другие неорганические азиды.
- •3.11. Органические азиды
- •Глава 4. Стифниновая кислота и стифнаты
- •4.1. Получение стифниновой кислоты
- •4.2. Свойства тринитрорезорцината свинца
- •4.3. Технология получения тнрСа.
- •Глава 5.
- •5.1. Соли диазония
- •5.2. Оксидиазосоединения
- •5.3. Тетразен и тетразолы.
- •5.4. Органические пероксиды
- •5.5. Ацетилениды
- •Промышленные взрывчатые вещества Часть1. Инициирующие взрывчатые вещества
Глава 3.
НЕОРГАНИЧЕСКИЕ И ОРГАНИЧЕСКИЕ АЗИДЫ
К азидам относят соли азотистоводородной кислоты (HN3) и ковалентные соединения, содержащие азидный фрагмент -N3. В зависимости от состава, строения и взрывчатых свойств неорганические азиды делятся на классы.
Нормальные азиды представляют собой простые соли металлов и ковалентные соединения, в которых все имеющиеся валентности связаны с азидо-группами. Их взрывчатые свойства зависят от ионности связи элемента с азидогруппой. Нормальными азидами являются, например, азиды натрия, свинца, аммония.
NaN3 |
Pb(N3)2 |
NH4(N3) |
(OH)NiN3 |
ClPbN3 |
Азид натрия |
Азид свинца |
Азид аммония |
Основной азид никеля |
Азид-хлорид свинца |
Основные азиды и азидогалогениды относятся к смешанным азидам. Они часто имеют полимерное строение, как, например, основной азид никеля или азид-хлорид свинца. Среди смешанных азидов есть как взрывчатые, так и невзрывчатые вещества.
Hal-N3
|
|
[Co(NH3)5N3]Сl2 |
Галогеназиды (Hal = F, Cl, Br, I) |
Фосфазентриcазид |
Пентаамминазидо- кобальт (III) хлорид |
Галогеназиды (азиды галогенов) Hal-N3 (Hal = F, Cl, Br, I) относятся к нормальным азидам. Это чрезвычайно опасные, сильно токсичные взрывчатые вещества, медленно разлагающиеся, а также часто спонтанно взрывающиеся при обычных условиях. В соответствии с расчетом (MP2/6-31G**) энергия связи Hal-N3 убывает в ряду F > Cl > Br > I.
Азид фтора (FN3), мол. масса 61,02 - зеленовато - желтый газ с Ткип. = - 82 0С, зеленовато - желтое твердое вещество с Тпл. = - 154 0С имеет расчетную энтальпию образования (MP2/6-31G**) Hfo 82,2 Ккал/моль = 344,1 кДж/моль. Из всех известных азидов (включая HN3) азид фтора наиболее чувствителен к механическому и тепловому удару. Испарение FN3 обычно вызывает взрыв. При разложении азида фтора происходит разрыв связи FN-N2:
2 FN3 2 FN + 2 N2 FN = FN + 2 N2 |
Получают FN3 по реакции :
4 HN3 + 2 F2 3 FN3 + N2 + NH4F |
проводимой в газовой фазе в токе азота.
Азид хлора (ClN3), мол. масса 77,48 - бесцветный газ с Ткип. = - 15 0С, Тпл = - 45 0С (по другим данным - 100 0С). Жидкий ClN3 имеет желто-оранжевый цвет, твердый - желтый. Расчетная энтальпия образования (MP2/6-31G**) газообразного азида хлора Hfo 92,8 Ккал/моль = 388,5 кДж/моль. Смеси с инертными газами более устойчивы, чем свободный ClN3 в любом агрегатном состоянии, но тоже могут взрываться. Азид хлора плохо растворяется в воде и хорошо в бутане, пентане, бензоле, метиловом и этиловом спирте, диэтиловом эфире, ацетоне, хлороформе, четыреххлористом углероде и сероуглероде. Растворы азида хлора в органических растворителях в темноте устойчивы в течение нескольких суток. Получают ClN3 в воде по реакции:
NaN3 + Cl2 ClN3 + NaCl |
или без растворителя по схеме:
3 (CH3)3SiN3 + 3 ClNO2 2 ClN3 + (CH3)3SiCl + (CH3)3SiOSi(CH3)3 +2 N2O + N2O3 |
Газообразный азид хлора энергично взаимодействует с металлическим натрием, магнием и цинком. В водной среде, особенно при наличии ОН- - ионов, галогеназиды Hal-N3 (Hal = Cl, Br, I) гидролизуются:
Hal-N3 + 2 OH- N3- + HalO- + H2O |
Азид брома (BrN3), мол. масса 121,94 - едкая с тошнотворным запахом оранжевая жидкость с Тпл = - 45 0С, чрезвычайно чувствительная к тепловому и механическому воздействию. BrN3 взрывается при dP > 0,05 Торр (0,05 мм рт. ст.) Азид брома в любых соотношениях смешивается с диэтиловым эфиром, меньше растворяется в бензоле и лигроине. В темноте растворы BrN3 в органических растворителях устойчивы в течение нескольких часов. Концентрированные растворы способны взрываться при взбалтывании. Азид брома (жидкий) имеет энтальпию образования Hfo 102 Ккал/моль = 427 кДж/моль, теплоту взрыва 805 Ккал/кг =
3369,7 кДж/кг, объем газообразных продуктов взрыва 367 л/кг, фугасность 230 см3/10 г. BrN3 взрывается при смешении с фосфором, мышьяком, натрием и серебром. Получают азид брома по реакции:
NaN3 + Br2 BrN3 + NaBr |
Азид йода (IN3), мол. масса 168,93 - желтоватое твердое вещество c удушливым запахом, легко взрывается от малейшего воздействия. Азид йода растворяется в воде, бензоле, хлороформе, спирте, труднее в лигроине. При температуре выше 0 0С растворы разлагаются. Твердый IN3 имеет энтальпию образования Hfo 104 Ккал/моль = 435,3 кДж/моль, теплоту взрыва 571 Ккал/кг = 2390,2 кДж/кг, объем газообразных продуктов взрыва 265 л/кг, фугасность 140 см3/10 г. Получают азид йода по реакции:
AgN3 + I2 IN3 + AgI |
Практического применения как ВВ галогеназиды не имеют.
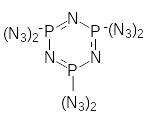
В гетероазидах азидная группа ковалентно связана с группировкой, состоящей по крайней мере из двух элементов. Такие соединения чувствительны к простым начальным импульсам. Они гидролитически неустойчивы. Примером служит 1,3,5-триаза-2,4,6-трифосфазен-2,2,4,4,6,6-гексаазид (фосфазентриcазид).
Азидные комплексы - координационные соединения, в которых азидные ионы присутствуют в качестве лигандов во внутренней сфере. Например, пентаамминазидокобальт (III) хлорид. В зависимости от состава они могут быть инициирующими, бризантными ВВ или не обладать этими свойствами.
В металлоорганических азидах сочетаются связи металла с углеродом и ионом азида. Это, например, триэтилазид свинца.
|
Триэтилазид свинца |
Большинство из металлоорганических азидов невзрывчаты.
Внимание исследователей к азидам было обусловлено необходимостью поиска нового ИВВ для замены гремучей ртути, что было очевидно уже в первый период ее использования.
Во-первых, относительно невысокая температура вспышки гремучей ртути (около 190 оС) ограничивает область ее применения.
Во-вторых, гремучая ртуть флегматизируется водой, что ведет к отказам в работе средств инициирования.
В-третьих, гремучая ртуть обладает относительно небольшой инициирующей способностью, что не позволяет снижать габариты капсюлей-детонаторов.
В-четвертых, недостатком гремучей ртути является токсичность и высокая реакционная способность по отношению к металлам, что ограничивает выбор материалов оболочек средств инициирования.
В 1890 году известный немецкий химик Курциус впервые получил азотистоводородную кислоту (азоимид, азидную кислоту, HN3) и синтезировал некоторые ее соли. Как оказалось, ряд солей азотистоводородной кислоты с тяжелыми металлами обладают свойствами ИВВ. Из них наибольшее распространение в XX веке получил азид свинца Pb(N3)2, который является сейчас штатным и наиболее распространенным ИВВ.
Внедрение азидов в практику происходило достаточно драматично. В 1893 году в Германии были испытаны капсюли-детонаторы, снаряженные солью азотистоводородной кислоты. Однако здесь свою роль сыграла инерционность мышления, в результате чего была предпринята неудачная попытка использовать в качестве ИВВ по аналогии с гремучей ртутью азид ртути (Hg(N3)2). Во время испытаний произошел несанкционированный взрыв и погибли люди. Причиной взрыва, как оказалось, была примесь азида закисной ртути (Hg2(N3)2) – вещества, чрезвычайно чувствительного к механическим воздействиям. В 1897 году немецкий исследователь Веллер взял патент на применение азида свинца Pb(N3)2 в качестве ИВВ, но только через 15 лет, в 1912 году, было освоено промышленное изготовление капсюлей-детонаторов, снаряженных азидом свинца в медные оболочки, что также явилось результатом традиционности мышления и незнанием химии солей азотистоводородной кислоты. В настоящее время азидом свинца снаряжать медные гильзы категорически запрещается, так как образующийся со временем азид меди существенно более чувствителен к механическим воздействиям, чем азид свинца.
Во время первой мировой войны западные воюющие страны применяли капсюля-детонаторы, снаряженные Pb(N3)2. В России же азид свинца в качестве ИВВ до революции применяла только морская артиллерия благодаря усилиям профессора С.П. Вуколова, который, работая в Морской научно-технической лаборатории, разработал отечественный метод получения азида свинца.
После первой мировой войны в России в годы разрухи азид свинца не производили до 1929 года, когда на основе постановления Правительства в Ленинграде на Ржевке на Охтинском химическом комбинате началось производство Pb(N3)2. К началу Великой Отечественной Войны в СССР азид свинца занял лидирующее положение при снаряжении капсюлей-детонаторов, на его основе были разработаны и внедрены в производство неоржавляющие воспламенительные составы для артиллерийских систем и стрелкового оружия. До настоящего времени азид свинца как в нашей стране, так и во всем мире - основное штатное ИВВ.

 0oC,
H2O
0oC,
H2O -200C
-200C 20
0C/0
0C
20
0C/0
0C
 CFCl3,
0 0C
CFCl3,
0 0C