
- •1. Контрольная задача № 1
- •2. Контрольная задача № 2
- •2.1. Исходные данные
- •Исходные данные для расчета процессов 1-2 и 2-3
- •2.2. Объем задания
- •2.1. Адиабатный процесс
- •2.2. Изобарный процесс
- •2.3. Изохорный процесс
- •2.4. Изотермический процесс
- •3. Контрольная задача № 3
- •2.4. Контрольная задача № 4
- •Для теоретического курса
- •Для практических занятий
2.4. Изотермический процесс
Исходные данные: рассчитать изотермический процесс идеального воздуха, идущего от Р1=10 бар и v1=0,03 м3/кг до Р2=5 бар.
Решение:
первоначально определяется температура процесса по уравнению состояния идеального газа
![]() К = 772 °С.
К = 772 °С.
По табл. 2 определяются энергетические параметры при данной температуре
по t1=772 °C находим:
h1=1097,65 кДж/кг, u1=797,70 кДж/кг so1=8,0183 кДж/(кг·К);
для конечной точки изотермического процесса h1=h2=1097,65 кДж/кг, u1=u2=797,70 кДж/кг, so1=so2=8,0183 кДж/(кг·К);
абсолютные значения энтропий в начале и конце процесса при Ро=1 бар определяются как
s1 = so1 - R·ln(Р1/Ро) = 8,0183 – 0,287·ln(10/1) = 7,3574 [кДж/(кг·К)],
s2 = so1 - R·ln(Р2/Ро) = 8,0183 – 0,287·ln(5/1) = 7,5564 [кДж/(кг·К)],
разница энтропий изотермического процесса может рассчитываться как
s2 - s1 = 7,5564 - 7,3574 = so2-so1-R·ln(Р2/Р1) = R·ln(Р1/Р2) =
= 0,287·ln(10/5) = 0,199 [кДж/(кг·К)].
Теплота изотермического процесса равна его работе изменения объема и определяется выражением
q = l = T(s2 - s1) = TR·ln(Р1/Р2) =
= 1045·0,287·ln(10/5) = 207,9 [кДж/(кг·К)].
Рассмотренные примеры расчета изобарного, изохорного и изотермического процессов показывают, что для них справедливы многие выражения, используемые при расчете процессов идеальных газов, подчиняющихся молекулярно-кинетической теории. Эти выражения не содержат изобарных и изохорных теплоемкостей или величин производных от них (таких как коэффициент Пуассона).
3. Контрольная задача № 3
Провести расчет двух, последовательно протекающих, процессов для 1 кг воды и водяного пара.
Исходные данные: давление Р, температура t или степень сухости пара х в начале и конце каждого процесса; характер процессов и для некоторых процессов задано количество теплоты.
Варианты задания приведены в табл. 2.9.
Объем задания:
1. Определить начальные и конечные параметры (Р, v, t, h, s, u) для каждого процесса и результаты свести в табл. 2.10.
2. Определить количество теплоты q, работу изменения объема l, изменение внутренней энергии Du, энтальпии Dh и энтропии Ds для каждого процесса 1-2, 2-3 и 1-2-3 и результаты расчетов свести в табл. 2.11.
3. Изобразить последовательно в Р,v–, Т,s– и h,s– диаграммах процессы 1-2 и 2-3 (без соблюдения масштаба, но в соответствии с фазовыми состояниями воды и пара и качественным соотношением параметров).
Таблица 2.9
Исходные данные к задаче № 3
№ |
Р1, МПа |
t1, оС |
х1 |
Процесс 1–2 |
q1-2, кДж/кг |
Р2, МПа |
t2, оС |
Процесс 2–3 |
q2-3, кДж/кг |
Р3, МПа |
x3 |
1 |
|
310 |
1 |
dq = 0 |
|
1,5 |
|
Р = const |
800 |
|
|
2 |
4,0 |
|
0,8 |
Т = const |
|
1,0 |
|
Р = const |
–1000 |
|
|
3 |
1,0 |
100 |
|
Р = const |
2100 |
|
|
dq = 0 |
|
0,1 |
|
4 |
|
200 |
0 |
Т = const |
|
0,7 |
|
v = const |
|
0,2 |
|
5 |
10 |
|
0,3 |
Р = const |
|
|
400 |
dq = 0 |
|
0,5 |
|
6 |
0,2 |
210 |
|
Т = const |
–950 |
|
|
v = const |
|
|
1 |
7 |
0,05 |
|
0,8 |
dq = 0 |
|
0,5 |
|
Р = const |
600 |
|
|
8 |
5,0 |
350 |
|
v = const |
|
2,0 |
|
Т = const |
|
0,3 |
|
9 |
0,03 |
|
0,85 |
dq = 0 |
|
1,0 |
|
Т = const |
–1300 |
|
|
10 |
5,0 |
|
0 |
p = const |
|
|
400 |
v = const |
|
1,0 |
|
11 |
1,0 |
|
1 |
dq = 0 |
|
6,0 |
|
Р = const |
|
|
0,5 |
12 |
9,0 |
|
0,6 |
Т = const |
|
5,0 |
|
Р = const |
–200 |
|
|
13 |
8,0 |
400 |
|
dq = 0 |
|
0,6 |
|
Р = const |
–1200 |
|
|
14 |
2,0 |
|
0,45 |
Р = const |
1600 |
|
|
v = const |
|
1,5 |
|
15 |
3,0 |
150 |
|
Р = const |
2500 |
|
|
dq = 0 |
|
0,01 |
|
16 |
0,5 |
|
0,6 |
v = const |
|
1,5 |
|
Р = const |
|
|
1 |
17 |
1,0 |
50 |
|
Р = const |
|
|
250 |
Т = const |
–1500 |
|
|
18 |
1,0 |
|
0,5 |
v = const |
|
2,5 |
|
Т = const |
|
0,1 |
|
Таблица 2.10
Параметры точек начала и конца процессов 1-2 и 2-3
Точка |
Р, МПа |
v, м3/кг |
t, oC |
h, кДж/кг |
s, кДж/(кг×К) |
u, кДж/кг |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
Таблица 2.11
Энергетические характеристики процессов 1-2, 2-3 и 1-2-3
Точки |
Процесс (название) |
q, кДж/кг |
l, кДж/кг |
Du, кДж/кг |
Dh, кДж/кг |
Ds, кДж/(кг×К) |
1-2 |
|
|
|
|
|
|
2-3 |
|
|
|
|
|
|
1-2-3 |
суммарно |
|
|
|
|
|
Теоретические основы к задаче № 3
Фазовые состояния воды
На рис. 2.3, 2.4, 2.5 приведены фазовые диаграммы Р,v, T,s и h,s для воды и водяного пара. На диаграммах изображены нижняя пограничная кривая х = 0 (жидкость на линии насыщения или кипящая жидкость) и верхняя пограничная кривая х = 1 (сухой насыщенный пар), где х – степень сухости пара. Пограничные кривые разделяют на диаграммах область жидкости (левее х = 0), влажного насыщенного пара (между х = 0 и х = 1) и перегретого пара (правее х = 1). Нижняя и верхняя пограничные кривые сливаются в точке К, которая называется критической точкой. Выше критической точки не существует видимой границы фазового перехода жидкости в пар.
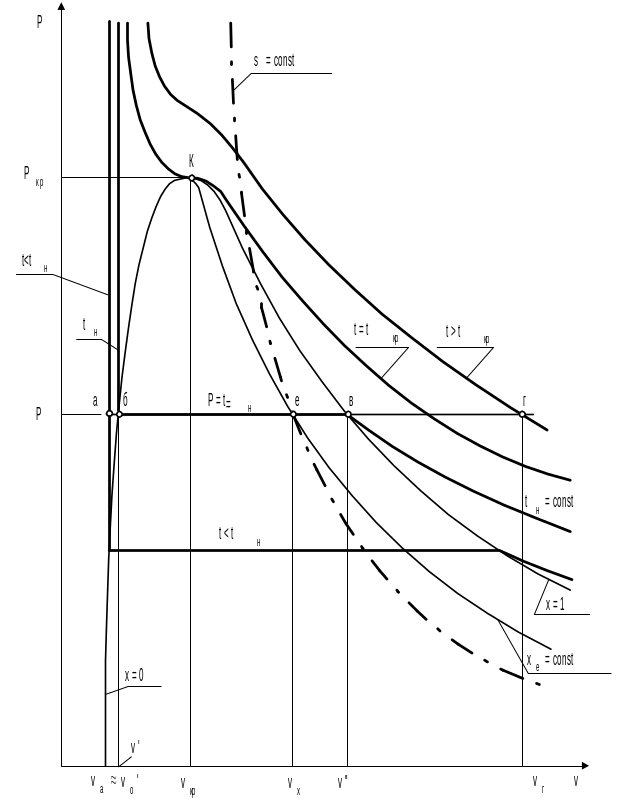
Рис. 2.3. Фазовая Р,v – диаграмма воды и водяного пара
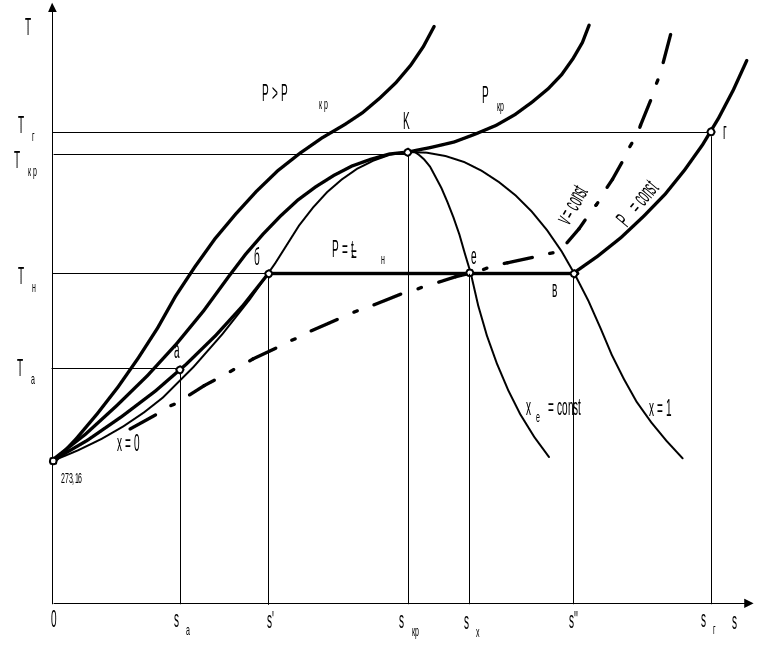
Рис. 2.4. Фазовая T,s – диаграмма воды и водяного пара

Рис. 2.5. Фазовая h,s – диаграмма воды и водяного пара
Для воды параметры критической точки:
критическое давление Ркр = 22,115 МПа;
критическая температура tкр = 374,12 оС;
критический объем vкр = 0,003147 м3/кг;
критическая энтальпия hкр = 2095,2 кДж/кг;
критическая энтропия sкр = 4,4237 кДж/(кг×К).
На диаграммах нанесены изобары (Р = const) при Р < Ркр, Р = Ркр и Р > Ркр, изохора (v = const), изотермы (t = const) при t < t кр, t = t кр и t > t кр, адиабата (s = const) и линия постоянной степени сухости (х = const). Следует обратить внимание на то, что в области влажного насыщенного пара изобара совпадает с изотермой насыщения (Р t н), а изобара при Р > Ркр и изотерма при t > t кр не пересекают пограничных кривых.
На изобаре произвольного давления Р < Ркр нанесены точки, соответствующие различным фазовым состояниям воды (рис. 2.3, 2.4, 2.5):
а — состояние жидкости при температуре ниже температуры насыщения (кипения) (t < tн);
б — жидкость в состоянии насыщения (кипения) при заданном давлении (t = tн);
е — влажный насыщенный пар при температуре насыщения (t = tн);
в — сухой насыщенный пар при температуре насыщения t = tн;
г — перегретый пар при t > tн при заданном давлении.
Таблицы термодинамических свойств воды и водяного пара
Для определения параметров состояния воды и водяного пара служат таблицы термодинамических (теплофизических) свойств воды и водяного пара [9]. Современные таблицы составлены с использованием Международной системы единиц СИ. В таблицах приняты следующие обозначения физических величин и их размерности:
Р – давление, Па:
1 МПа = 103 кПа = 106 Па = 10 бар;
Т – температура, К: Т = t + 273,15;
t – температура, оС;
v – удельный объем, м3/кг;
h – удельная энтальпия, кДж/кг;
s – удельная энтропия, кДж/(кг×К).
В табл. 1 и табл. 2 [9] даны параметры воды и пара в состоянии насыщения, причем в табл. 1 в качестве определяющего параметра выступает температура, а в табл. 2 — давление.
В термодинамических расчетах принято параметры (кроме Р и t) обозначать для жидкости при температуре насыщения (кипения) индексом "штрих" (v', h', s'), а для сухого насыщенного пара индексом "два штриха" (v'', h'', s''). В табл. 1 и табл. 2 [9] приведены также значения удельной теплоты парообразования r = h'' – h' и разности энтальпий в состоянии насыщения s'' – s'.
Для влажного насыщенного пара (степень сухости 0< x < 1) параметры пара рассчитываются по формулам:
vx = v' + x (v'' – v');
hx = h' + x (h'' – h') = h' + x×r;
sx = s' + x (s'' – s').
Причем, v' < vx < v''; h' < hx < h''; s' < sx < s''.
Для жидкости при t < tн и для перегретого пара при t > tн параметры воды и пара находятся по табл. 3 [9].
При Р £ Ркр = 22,115 МПа табл. 3 поделена горизонтальной линией на две части: верхняя — для области жидкости; нижняя — для перегретого пара. Граница раздела этих областей проходит при t = tн.
При Р > Ркр нет видимого фазового перехода воды в пар и вещество остается однородным (жидкость или пар). Условная граница между жидкостью и паром в этом случае может приниматься по критической изотерме.
Внутренняя энергия для воды и водяного пара в таблицах не приводится, она определяется по формуле:
u = h – Р×v.
Если u и h имеют размерность кДж/кг, то давление должно быть выражено в кПа, а удельный объем в м3/кг.
Диаграмма h,s водяного пара
Диаграмма h,s (энтальпия – энтропия) находит широкое применение при расчетах паровых процессов и циклов теплоэнергетических установок.
Для практических целей диаграмма h,s выполняется не для всех фазовых областей воды (как это показано на рис. 2.5), а только для ограниченной области водяного пара (рис. 2.6).
На рабочей диаграмме h,s (рис. 2.6) наносится густая сетка изобар, изохор, изотерм и линий постоянной степени сухости х. Как уже отмечалось, в области влажного насыщенного пара изотерма совпадает с изобарой, причем геометрически это прямые линии. Чем выше давление, тем изобара круче и ближе к оси ординат.
Расчет процессов водяного пара
Расчету на практике подлежат четыре основных термодинамических процесса изменения состояния воды и водяного пара: изобарный (Р = const), изохорный (v = const), изотермический (Т = const), адиабатный (dq = 0).
Изображение указанных процессов в диаграммах Р,v, T,s и h,s показано на рис. 2.3, 2.4, 2.5.
Определение параметров воды и водяного пара проводится по таблицам термодинамических свойств воды и водяного пара или по h,s – диаграмме [9].
В табл. 2.12 приведены расчетные формулы для определения количества теплоты, работы изменения объема и изменения внутренней энергии для основных термодинамических процессов.
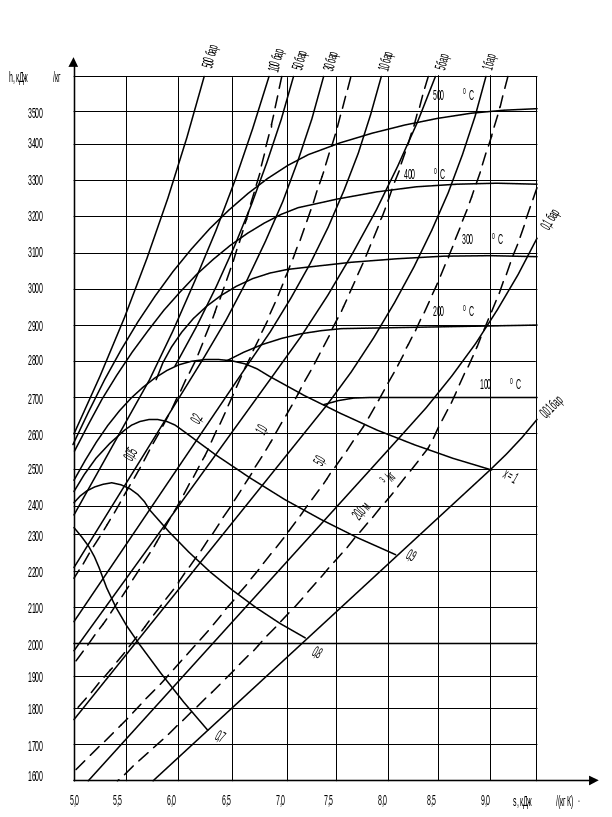
Рис. 2.6. Рабочая диаграмма h,s- для водяного пара
Таблица 2.12
Расчетные формулы основных термодинамических процессов
водяного пара
-
Процесс
q,
кДж/кг
l,
кДж/кг
Du,
кДж/кг
Р = const
h2 – h1
P (v2 – v1)
h2 – h1 – P (v2 – v1)
v = const
u2 – u1
0
h2 – h1 – v (P2 – P1)
Т = const
T (s2 – s1)
q – Du
h2 – h1 – (P2 v2 – P1 v1)
dq = 0
0
u1 – u2
h2 – h1 – (P2 v2 – P1 v1)
