
- •Введение....................................................................................................................5
- •1. Классификация неорганических веществ
- •1.1. Оксиды
- •1.1.1. Классификация и номенклатура оксидов
- •1.1.2. Способы получения оксидов
- •1.1.3. Свойства оксидов
- •1.2. Кислоты
- •1.2.1. Классификация кислот
- •1.2.2. Номенклатура кислот и кислотных остатков
- •Номенклатура кислот и кислотных остатков
- •Номенклатура оксокислот
- •1.2.3. Способы получения кислот
- •1.2.4. Общие свойства кислот
- •1.2.5. Химические свойства кислот и особенности их транспортировки
- •1.3. Основания
- •1.3.1. Классификация и номенклатура оснований
- •1.3.2. Способы получения оснований
- •1.3.3. Свойства оснований
- •1.3.4. Особенности транспортировки оснований
- •1.4.1. Классификация и номенклатура солей
- •1.4.2. Способы получения солей
- •1.4.3. Реакция нейтрализации
- •1.4.4. Свойства солей
- •1.4.5. Электролитическая диссоциация и гидролиз солей
- •Классификация электролитов
- •1.4.6. Кристаллогидраты
- •1.4.7. Особенности транспортировки солей
- •2. Контрольные вопросы
- •3. Тест для самоконтроля
- •Железнодорожным транспортом
- •Лицензия ид № 01094 от 28.02.2000.
- •644046, Г. Омск, пр. Маркса, 35
1.4.2. Способы получения солей
Основные способы получения солей:
1) реакции нейтрализации:
KOH + HNO3 KNO3 + H2O; (61)
2) взаимодействие кислот с основными оксидами:
H2SO4 + CuO CuSO4 + H2O; (62)
3) взаимодействие кислот с солями:
H2S + CuCl2 CuS + 2HCl; (63)
4) взаимодействие двух различных солей:
Na2SO4 + BaCl2 BaSO4 + 2NaCl; (64)
5) взаимодействие оснований с кислотными оксидами:
Ca(OH)2 + CO2 CaCO3 + H2O; (65)
17
6) взаимодействие металлов с неметаллами:
2K + Cl2 2KCl; (66)
7) взаимодействие металлов с кислотами:
Zn + 2HCl ZnCl2 + H2; (67)
Cu + 4HNO3 Cu(NO3)2 + 2NO2 + 2H2O. (68)
1.4.3. Реакция нейтрализации
В реакции нейтрализации исчезают кислота и основание, и раствор становится нейтральным:
H+ + OH = H2O. (69)
Но нейтральным раствор может стать и при условии удаления из раствора кислоты и основания, например:
2HCl + Na2CO3 = 2NaCl + CO2 + H2O; (70)
2H+ + CO32 = CO2 + H2O
или
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4; (71)
2OH + Cu2+ = Cu(OH)2.
Поэтому такие реакции (особенно с участием соды) также называют реакциями нейтрализации.
1.4.4. Свойства солей
Химические свойства солей определяются свойствами их катионов и анионов, так что их все невозможно перечислить. Основные свойства солей обусловлены их отношением к металлам, щелочам и солям. Перечислим некоторые общие для всех солей свойства:
1) в ряду стандартных электродных потенциалов каждый предыдущий металл вытесняет последующие из растворов их солей:
Zn + Hg(NO3)2 Zn(NO3)2 + Hg; (72)
2) соли взаимодействуют с кислотами:
CuSO4 + H2S CuS + H2SO4; (73)
3) соли взаимодействуют со щелочами:
FeSO4 + 2NaOH Fe(OH)2 + Na2SO4; (74)
18
4) соли взаимодействуют между собой:
CaCl2 + Na2CO3 CaCO3 + 2NaCl; (75)
5) соли взаимодействуют с водой (гидролиз).
1.4.5. Электролитическая диссоциация и гидролиз солей
Электролитической диссоциацией называется процесс полного или частичного разъединения нейтральных молекул растворенного вещества на ионы под действием полярных молекул растворителя.
Вещества, диссоциирующие в растворах на ионы, называются электро-литами, их растворы проводят электрический ток. Хорошая электропровод-ность растворов сильных кислот, щелочей и солей объясняется тем, что значи-тельная часть молекул этих веществ при растворении в воде диссоциирует на катионы (положительные ионы) и анионы (отрицательные ионы). Ионы, окру-женные в растворе оболочкой из молекул растворителя, называют гидратиро-ванными, если растворителем является вода, и сольватированными – в случае какого-либо другого растворителя:
HCl = H+ + Cl; (76)
NaOH = Na+ + OH; (77)
KNO3 = K+ + NO3. (78)
Диссоциация молекул, состоящих из большого числа ионов, проходит обычно в несколько стадий, причем на первой ступени диссоциация больше, чем на последующих:
H2SO4 = H+ + HSO4, K1 = 30; (79)
HSO4 = H+ + SO2, K2 = 1102.
Электролитическая диссоциация является обратимым процессом: в растворе ионы растворенного вещества могут взаимодействовать между собой, образуя нейтральные, недиссоциированные молекулы. Поэтому в растворах электролитов имеет место равновесие между ионами и недиссоциированными молекулами.
Не все вещества, растворы которых проводят электрический ток, пол-ностью диссоциируют на ионы. Шведский физикохимик Аррениус ввел поня-тие степени диссоциации. Степень диссоциации (a) – это отношение числа мо-лекул, распавшихся на ионы (n), к общему числу растворенных молекул (no):
=
![]() .
(80)
.
(80)
19
Степень диссоциации выражается в долях единицы или в процентах. Если > 30 %, то электролит называется сильным, если < 3 % это слабый электролит, а если = 3–30 % электролит средней силы. Степень диссоци-ации увеличивается при разбавлении растворов.
Сильные электролиты диссоциируют полностью:
Na2SO4 2Na+ + SO42. (81)
Диссоциация слабых электролитов протекает обратимо:
CH3COOH ⇄ CH3COO + H+. (82)
Многоосновные кислоты и слабые основания с валентностью катиона больше единицы диссоциируют ступенчато:
H3PO4 ⇄ H+ + H2PO4 ⇄ 2H+ + HPO42 ⇄ 3H+ + PO43;
Mg(OH)2 ⇄ MgOH+ + OH ⇄ Mg2+ + 2OH. (83)
Гидроксиды, которые в кислой среде диссоциируют как основания, а в щелочной как кислоты, называются амфотерными:
в кислой среде – Zn(OH)2 ⇄ Zn2+ + 2OH;
в щелочной среде – Zn(OH)2 ⇄ H2ZnO2 ⇄ 2H+ + ZnO22. (84)
Поскольку процесс диссоциации протекает одновременно с ассоциацией, то в растворе устанавливается динамическое равновесие процесса, и, применив к нему закон действия масс, можно получить константу равновесия, или для данного случая – константу диссоциации, которая также характеризует этот процесс количественно. Например, для H3PO4 при диссоциации по первой ступени:
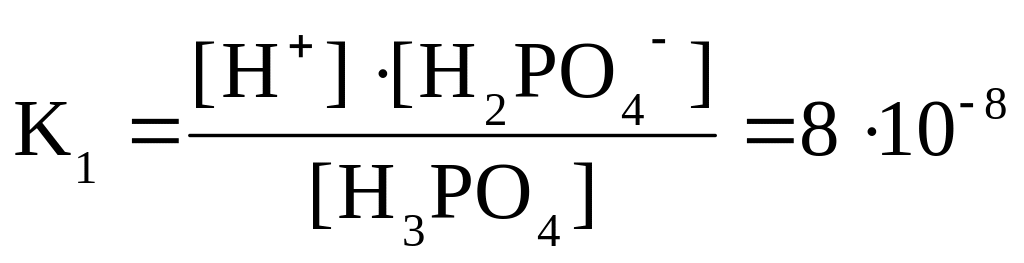 .
(85)
.
(85)
Общая константа диссоциации будет выглядеть так:
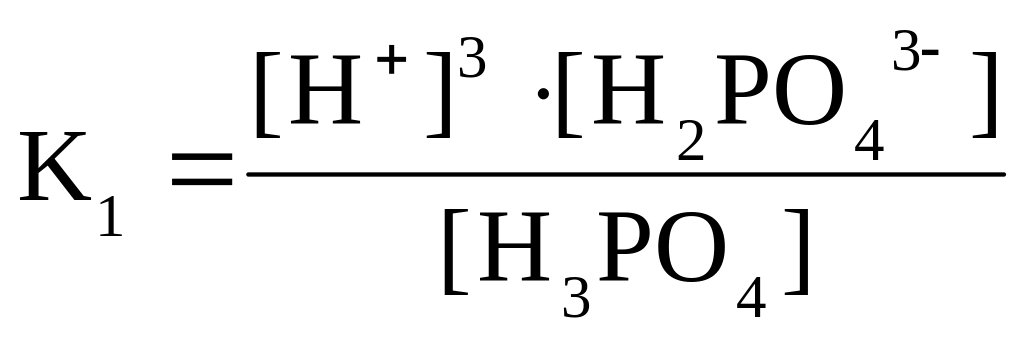 ,
(86)
,
(86)
где [H+] и [PO43] – молярные концентрации ионов.
Для слабых электролитов константа диссоциации не меняется с изменением концентрации и дает более общую характеристику электролита, чем степень диссоциации.
20
Т а б л и ц а 1.3
