
- •2) Уменьшается (так как радиус атома элемента в группе увеличивается с ростом периода)
- •1) Открытой
- •Закон Гесса
- •Следствия из закона Гесса:
- •Помним, что стандартная теплота образования простых веществ равна нулю!!!!
- •Стандартная теплота сгорания оксидов также равна нулю!!!!
- •Первый закон термодинамики позволяет рассчитать энергетический баланс химического процесса.
- •Катионы электролита- золь заряжен отрицательно, т.К. Потенциалопределяющие ионы - со32- ( они в избытке и входят в состав ядра, значит коагуляцию будут вызывать катионы!
- •Пример:
- •Коагуляция смесью электролитов
- •Еще раз о скорости химических реакций
- •Идет реакция или нет?
- •В продуктах необходимо присутствие
- •1.Осадка
- •2. Газообразного вещества
- •3. Слабого электролита Пример
- •А сильные электролиты нужно запомнить!!!!!
- •Буферные системы Поддерживают постоянство рН в растворах.
- •Пример:
- •Пример:
- •До встречи на Выпускном вечере!!!!!!!!!!!
Добрый день (ночь), миссис (мистер) Х!
Спасибо, что решил(а) вспомнить химию!
ВСЕ материалы для успешного прохождения
тестирования находятся на сайте кафедры в папке 2 курс: http://medchem.narod.ru
А теперь – к делу!
Химическая связь
Шкала электроотрицательности Полинга

Полярность - характеризует смещение электронной плотности к более электроотрицательному атому.
Относительная электроотрицательностъ атома зависит от валентности, проявляемой атомом и от того, с атомами каких других элементов соединен данный атом.
Ее значения можно использовать для оценки направления смещения электронов при образовании молекул.
Помним, что!!!!!!!!
А) Для молекул, состоящих из двух одинаковых атомов, связь НЕПОЛЯРНА!
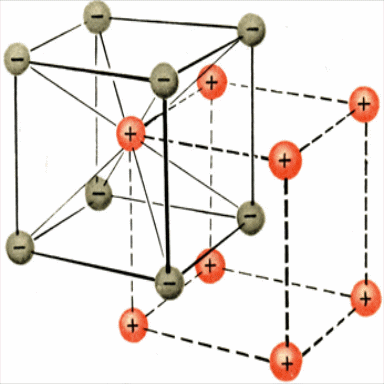
Б) В кристаллах солей связь – ИОННАЯ!
Водородная связь - связь между атомом водорода и сильно электроотрицательным элементом.

Пример:
Вещества, содержащие только ковалентные полярные химические связи, приведены в ряду…
1) PF5, Cl2O7, NH4Cl
2) F2, H2SO4, CH3COOH
3) H3PO4, BF3, CH3COONH4
4) NO2, SOCl2, P2O5
5) NаCl, P2O3, Cl2
В ответах 1,3,5 присутствуют соли, в которых связи – ионные, в ответе 2 молекула F2 неполярна, следовательно правильный ответ 4!
Пример:
Как меняется прочность ковалентной связи Н-Э в ряду
H2O→ H2S→ H2Sе→ H2Те
1) прочность связи возрастает
2) Уменьшается (так как радиус атома элемента в группе увеличивается с ростом периода)
3) не изменяется
4) растет, затем уменьшается
5) уменьшается, затем растет
Химическая кинетика
Закон Вант-Гоффа
При повышении температуры на 10° скорость химической реакции
возрастает в два-четыре раза. Как правило, γ-3.
![]()
Если повысить температуру на 40°, то скорость реакции увеличится в 108 раз:
![]()
Если повысить температуру на 30°, то скорость реакции увеличится в 27 раз:
![]()
Растворы
Процентная – масса вещества в 100 г раствора
![]()
m (чистого в-ва в граммах) = m р-ра ·ω%·0.01 = V·ρ· ω%·0.01
mмг=Vмл· ω%·10
Процентная концентрация выражается числом, граммов растворенного вещества, содержащимся в 100 граммах раствора,например:
95 г Н2О + 5 г NaCl = 100 г
Получим 5 %-ный раствор NaCl
Пример:
Определить w% , полученного смешением 200г 8% и 600г 3% растворов
Решение:
![]()
Молярная концентрация – число моль вещества в 1 л раствора
![]()
![]()
Если ρ=1
Нормальная концентрация – число моль-экв вещества в 1 л раствора
![]()
4. Моляльность m - число моль вещества в 1000 г растворителя
![]() (не
зависит от температуры, поэтому часто
применяется в клинической практике!)
(не
зависит от температуры, поэтому часто
применяется в клинической практике!)
Титр раствора Т – число грамм вещества в 1 мл раствора (г/мл).
Ш кала
рН
кала
рН
рН = – lg[H+] рН<7 – кислая среда
рОН = – lg[OH–] рН>7 – щелочная среда
Термодинамика
Благородный Дон (Донна) не забыл(а), что:
- эндотермические реакции идут с поглощением тепла (-Q, +∆Н)
- экзотермические реакции идут с выделением тепла (+Q, -∆Н)
Открытая система - обменивается с окружающей средой и веществом, и энергией
Закрытая система - обменивается с окружающей средой энергией, но не
обменивается веществом
Изолированная система - не обменивается с окружающей средой ни веществом, ни энергией
Пример:
К какому типу термодинамических систем принадлежит живая клетка?
1) Открытой
2) закрытой
3) изолированной
Закон Гесса
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ, а не от числа стадий процесса.
Следствия из закона Гесса:
1![]() .
Тепловой эффект реакции при стандартных
условиях равен разности между суммой
теплот
образования
продуктов реакции и суммой теплот
образования исходных веществ, умноженных
на соответствующие коэффициенты в
реакции
.
Тепловой эффект реакции при стандартных
условиях равен разности между суммой
теплот
образования
продуктов реакции и суммой теплот
образования исходных веществ, умноженных
на соответствующие коэффициенты в
реакции
Подавляющее большинство органических соединений нельзя синтезировать непосредственно из простых веществ и одновременно определить теплоту образования этих соединений. Поэтому за основу для расчета берут экспериментально легко определяемые теплоты (энтальпии) сгорания.
Тепловой эффект реакции при стандартных условиях равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты:
![]()
