
- •Ізомеризація алканів:
- •Електроліз по Кольбе:
- •Циклоалкани
- •Механізм реакції електрофільного приєднання
- •Зсув подвійного зв’язку:
- •Алкадієни
- •Піроліз нафтопродуктів або горючих газів:
- •Взаємодія дигалогенопохідних алканів зі спиртовим розчином лугу.
- •Взаємодія солей ароматичних кислот і натронного вапна:
- •Багатоядерні арени
- •Правила заміщення в бензеновому ядрі
- •Галогенопохідні вуглеводнів
- •Заміщення Гідрогену вуглеводнів галогеном:
- •Приєднання галогенів і галогенводню до ненасичених вуглеводнів:
- •Заміщення гідроксильної групи спирту атомом галогену:
- •Окремі представники галогенпохідних вуглеводнів
Механізм реакції електрофільного приєднання

π-зв’язок під дією окислювачів руйнується легше, ніж σ-зв'язок, тому для алкенів характерна участь у ролі відновників в окислювально-відновних реакціях.
І. Реакції приєднання
приєднання водню (гідрування) при нагріванні до температури 150 – 3000С і у присутності каталізаторів (Pt, Pd, Ni), утворюються алкани:

приєднання галогенів (галогенування), утворюються дигалогенопохідні алканів.
![]()
Приєднання брому є якісною реакцією на подвійний зв'язок: знебарвлення бромної води.
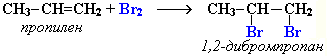
приєднання галогенводнів, утворюються моногалогенопохідні алканів.

Для гомологів етилену реакція відбувається згідно правила Марковнікова: під дією галогенводню іон Гідрогену приєднується до найбільш гідрогенізованого атома Карбону (з негативним зарядом), а атом галогену ‑ до найменш гідрогенізованого атома Карбону (з позитивним зарядом) при подвійному зв’язку.
![]()
Пояснюється правило Марковнікова індуктивним ефектом характерним для всіх алкільних радикалів. В результаті цього ефекту один атом Карбону біля подвійного зв’язку набуває частково позитивного заряду, а другий – частково негативного заряду внаслідок відштовхування електронної густини від –СН3 групи.
приєднання води (гідратація), відбувається у присутності каталізаторів (Н2SO4), утворюються одноатомні спирти. У випадку етилену – етанол (первинний спирт):


Для гомологів етилену приєднання води відбувається згідно правила Марковнікова: атом Гідрогену приєднується до найбільш гідрогенізованого атома Карбону, а Гідроксильна група – до найменш гідрогенізованого атома Карбону. Тому утворюються тільки вторинні спирти. У випадку пропену – пропанол-2 (ізопропіловий спирт):
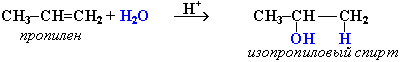
ІІ. Реакції заміщення
реакція радикального заміщення (атом Гідрогену заміщується на атом Галогену при сусідньому до подвійного зв’язку атому Карбону), відбувається при t=5000.
![]()
ІІІ. Реакції окислення
Алкени легко окислюються. Залежно від сили окислювача реакції можуть відбуватися як з розривом π-зв’язку, так і повним розривом подвійного зв’язку.
м’яке окислення. Спостерігається при дії перманганату калію КМnО4 в нейтральному або слабко лужному середовищах. Реакція відбувається із розімкненням π-зв’язку. Утворюються гліколі (двохатомні спирти). У випадку етилену – етиленгліколь (етандіол-1,2).
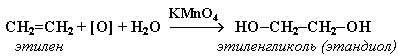
![]()
Аналітичний ефект реакції: знебарвлення рожево-фіолетового розчину КМnО4. Реакцію використовують для якісного визначення алкенів (подвійного зв’язку).
жорстке окислення. Відбувається при використання хромової суміші (К2Сr2О7 у присутності концентрованої Н2SO4). Внаслідок окислення утворюються різні карбонові кислоти:
СН3 – СН2 – СН2 – СН = СН2 +4 [О] → СН3 – СН2 – СН2 – СООН + НСООН
1-пентен бутанова кислота метанова кислота
високотемпературне окислення (горіння алкенів), утворюються вуглекислий газ і вода:
С2Н4 + 3О2 → 2СО2 + 2Н2О
ІV. Реакції полімеризації
Полімеризація – процес сполучення однакових молекул (мономерів) в одну складну молекулу (полімер).
Кількість мономерів, яка утворює полімер – ступінь полімеризації (n).
Існує два типи полімеризації – ступінчаста і ланцюгова.
Ступінчаста полімеризація – послідовне сполучення двох або декількох мономерів в одну молекулу. Відкрита і вивчена О.М.Бутлеровим (1877). Використовується в промисловості для полімеризації алкенів. Використовують каталізатори – хлориди амонію, або цинку, їх броміди, флуориди. Змінюючи умови реакції, можна одержати полімери з різною молекулярною масою і фізичними властивостями. Прикладом такої реакції є димеризація 2-метилпропену (каталізатор Н2SО4):
![]()


ланцюгова, або лінійна полімеризація. З багатьох мономерів утворюються довгі ланцюги за рахунок розриву подвійних зв’язків у молекулах алканів (етилену і пропілену).
Процес полімеризації складається з стадій:
Ініціація перетворення невеликої кількості мономерів в активні центри полімеризації.
Зростання полімерного ланцюга – приєднання мономерів до активного центра.
Обрив полімерного ланцюга – припинення процесу при досягненні молекулою полімеру певних розмірів.
Передача ланцюга – перехід активних центрів до синтезу наступних молекул полімеру залежно від кількості і видів мономерів.

Методи одержання алкенів
Дегідратація спиртів (відщеплення води) при нагріванні з надлишком кислоти:

Дегідрування алканів (відщеплення водню) при наявності каталізаторів (Nі):
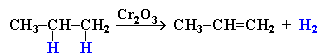
Дія спиртового розчину лугу на моногалогенопохідні алканів при нагріванні:

Дегалогенування дигалогенопохідних алканів (дія цинкового пилу у спиртовому розчині або магнієвої стружки):
![]()
Крекінг алканів – основний промисловий спосіб одержання алкенів. Для одержання низькомолекулярних алкенів застосовують піроліз (при 700 – 8000С) газоподібних алканів природних і попутних газів.
![]()
![]()
