
- •1. Геохимия как наука. Объект ее изучения. Разделы геохимии, связь с другими науками.
- •2.Строение атома. Закон Заварицкого.
- •3. Типы химической связи.
- •4.Геохимические классификации химических элементов.
- •5. Распространенность химических элементов.
- •6.Кларки химических элементов.
- •7. Закономерности распространенности химических элементов в атмосфере и гидросфере.
- •8.Закономерности распространенности химических элементов в литосфере. Полулогарифмический график Ферсмана, выводы из графика.
- •9. Химический состав метеоритов.
- •10. Формы нахождения химических элементов в земной коре. Самостоятельные минеральные виды.
- •11. Неструктурные примеси.
- •12.Стрктурные примеси и смеси. Определение изоморфизма. Типы изоморфизма на основе изоморфной смесимости, на основе валентности ионов.
- •13. Типы изоморфизма по механизму вхождения ионов в кристаллическую решетку. Блоковый изоморфизм.
- •14.Полярный изоморфизм. Цепочечный изоморфизм. Диадохия.
- •15. Внутренние факторы изоморфизма
- •16.Внешние факторы изоморфизма.
- •17. Распад смешанных кристаллов в эндогенных процессах.
- •18.Распад смешанных кристаллов в экзогенных кристаллах.
- •19. Применение изоморфных смесей для решения геологических задач.
- •20.Элементы-примеси в минералах и горных породах и их применение для решения геологических задач.
- •21. Миграция химических элементов.
- •22.Источники энергии геологических процессов.
- •23. Внутренние факторы миграции.
- •24.Внешние факторы миграции. Температура, давление, концентрация вещества.
- •25. Внешние факторы миграции - ph среды.
- •26.Окислительно-восстановительный потенциал.
- •27. Фильтрационный эффект.
- •28.Сорбционные свойства коллоидных систем.
- •29. Формы переноса вещества. Комплексные соединения, их роль.
- •30.Причины отложения вещества. Геохимические барьеры. Физические барьеры.
- •31. Физико-химические барьеры.
- •32.Термодинамическая направленность геологических процессов. Принцип Ле-Шателье.
- •33. Геохимия магматического процесса.
- •34.Геохимия магматического процесса. Схема Боуэна. Закономерности формирования магматических горных пород.
- •35. Геохимия пегматитового процесса
- •36.Геохимия гидротермального процесса. Источники воды гидротермальных растворов. Источники вещества гидротермальных растворов.
- •37. Группы гидротермалитов по минеральному составу гидротермальных образований.
- •38.Геохимия контактового процесса. Контактовый метаморфизм.
- •39.Контактовый метасоматоз. Две стадии метасоматоза.
- •40.Типы циркуляции скарнирующих растворов. Связь рудной минерализации со скарнами.
- •41. Геохимия регионального метаморфизма.
- •42.Геохимия гипергенных процессов. Процессы, протекающие в зоне гипергенеза. Факторы гипергенеза.
- •43. Форма нахождения химических элементов в зоне гипергенеза.
- •44. Кора выветривания.
- •45. Геохимия зоны окисления сульфидных месторождений.
- •46.Геохимия почв
1. Геохимия как наука. Объект ее изучения. Разделы геохимии, связь с другими науками.
Геохимия – наука, изучающая историю атомов химических элементов и их поведение в различных природных физико-химических процессах. Объект изучения – атом химического элемента. Геохимия изучает историю атомов химических элементов в земной коре, в глубоких частях нашей планеты, в космическом пространстве и космических телах. Земля отдает в пространство легкие элементы (водород, гелий и др.) и получает более тяжелые элементы в виде космической пыли, метеоритов и т.д.
По содержанию геохимия делится на следующие части:
Общая (теоретическая) геохимия – решает две проблемы:
закономерности распределения атомов химических элементов в природных объектах, космических телах (космохимия);
закономерности поведения атомов химических элементов в природных процессах.
Прикладная геохимия – изучает следующие вопросы:
распределение атомов химических элементов в небольших объектах;
геохимия отдельных элементов;
поисковая геохимия.
Геохимия исследует химические элементы на глубине до 20 км. Геохимия связана со многими науками (минералогия, кристаллография, петрография, учение о МПИ, математикой, физикой, химией, астрономией, биолого-почвенными дисциплинами).
2.Строение атома. Закон Заварицкого.
Общий закон геохимии (А.Н. Заварицкий): «Распространенность атомов химических элементов в природе зависит от их строения и определяется устойчивостью их ядер, а движение атомов химических элементов определяется особенностями строения электронных оболочек».
В строении атома
принимают участие около 40 элементарных
частиц, из которых три являются основными:
протон, нейтрон, электрон. Электроны
находятся на орбитах вокруг атомного
ядра. Радиус атомов около
 м. Радиус атомного ядра –
м. Радиус атомного ядра –
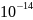 м.
м.
Атом – электрически нейтральная частица. Но он может отдавать или принимать электроны на своих орбитах. При этом атом становится заряженным – ионом. Ион, который отдает свои электроны, становится положительно заряженным и называется катионом; ион, получивший электрон, несет отрицательный заряд и называется анионом.
Ядро атома состоит
из ядерных частиц – нуклонов. Это протоны
 и нейтроны
и нейтроны
 .
Массовое число атома A
равно сумме протонов и нейтронов:
.
Массовое число атома A
равно сумме протонов и нейтронов:

Выделяют следующие нуклиды:
Изотопы – ядра, у
которых одинаковое число
и разные числа
и
 .
Изотопы находятся в одной клетке таблицы
Менделеева и обладают одинаковыми
химическими свойствами.
.
Изотопы находятся в одной клетке таблицы
Менделеева и обладают одинаковыми
химическими свойствами.
Изобары – ядра, у которых одинаково число и разны числа и . Изобары находятся в разных клетках таблицы Менделеева и имеют разные химические свойства.
Изотоны – ядра, у
которых одинаковое число
и разные числа
и
 Изотоны находятся в разных клетках
таблицы Менделеева и обладают разными
химическими свойствами.
Изотоны находятся в разных клетках
таблицы Менделеева и обладают разными
химическими свойствами.
3. Типы химической связи.
Атомы химических элементов взаимодействуют друг с другом и образуют различные типы химической связи: 1. ионная (электроны с внешней орбиты одного атома переходят на внешнюю орбиту другого атома), 2. ковалентная полярная (взаимодействуют атомы разных химических элементов с образование общего электронного ассиметричного облака) и неполярная (взаимодействуют атомы одного химического элемента, образуется общая внешняя электронное облако), 3. молекулярная (взаимодействие молекул – слабая связь (например, лед),
4. металлическая.
В природе распространены промежуточные типы связи: ионно-ковалентная (например, донорно-акцепторная связь – электроны попеременно вращаются то у одного, то у другого ядра).
Для определения типа химической связи используется электроотрицательность химических элементов, т.е. энергия, с которой атом притягивает валентные электроны другого атома. Чем больше разница электроотрицательности элементов, тем более характерен ионный тип связи; чем меньше – тем более характерен ковалентный тип связи. В природе ионный тип связи характерен для галоидов; существенно ковалентная – для сульфидов; ионно-ковалентный тип связи характерен для окислов и силикатов.
