
- •Міністерство охорони здоров'я України
- •Модуль 1 Хімічна термодинаміка. Фазові рівноваги. Колігативні властивості розбавлених розчинів. Електрохімія. Хімічна кінетика
- •Заняття 1
- •Застосування першого закону термодинаміки до хімічних процесів. Перший закон термодинаміки. Термохімія. Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми: “Перший закон термодинаміки. Термохімія”
- •Джерела інформації
- •Орієнтовна основа дії Алгоритм рішення задач з фізичної хімії:
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
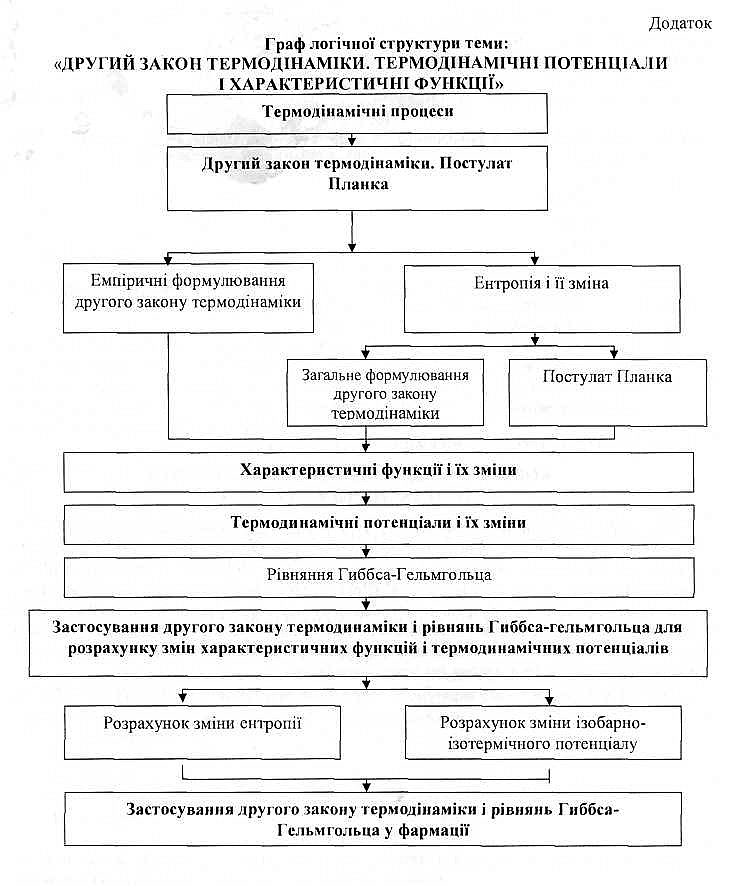
- •Граф логічної структури теми: “Другий закон термодинаміки. Термодинамічні потенціали і характеристичні функції”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання Перелік теоретичних питань
- •Граф логічної структури: “Термодинаміка хімічної рівноваги. Рівняння ізотерми, ізобари, ізохори реакцій”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури: “Термодинаміка фазової рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Фазові рівноваги”
- •Джерела інформації
- •Орієнтовна основа дії
- •Орієнтовна основа дії
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 8
- •Колігативні властивості розбавлених розчинів. Ідеальні розчини Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів”
- •Джерела інформації
- •Орієнтовна основа дії
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Колігативні властивості розбавлених розчинів” Джерела інформації
- •Орієнтовна основа дії Алгоритм виконання досліду „Визначення температури замерзання речовини"
- •Алгоритм виконання досліду “Визначення молярної маси неелектроліту”
- •Алгоритм виконання досліду “Визначення ізотонічного коефіцієнта, ступеня електролітичної дисоціації і осмотичного тиску електроліту у водному розчині”
- •Набір завдань для перевірки досягнення конкретних цілей навчання
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Властивості розчинів електролітів. Електрична провідність”
- •Джерела інформації
- •Орієнтовна основа дії
- •Короткі методичні вказівки до роботи на практичному занятті
- •Заняття 11
- •Електродні потенціали та електрорушійні сили. Класифікація електродів. Потенціометрія Актуальність теми
- •Цілі навчання
- •Зміст навчання
- •Граф логічної структури теми “Потенціометрія”
- •Джерела інформації
- •Орієнтовна основа дії
- •Джерела інформації
- •Граф логічної структури теми
- •Цілі навчання
- •Зміст навчання
- •Джерела інформації
- •Граф логічної структури теми
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
- •Джерела інформації
- •Короткі методичні вказівки до роботи на практичному занятті
Цілі навчання
Загальна мета:
УМІТИ: інтерпретувати фізичну суть другого закону термодинаміки для подальшого використання таких знань — умінь у фармації.
Конкретні цілі:
УМІТИ:
1. Інтерпретувати типи термодинамічних процесів.
2. Інтерпретувати характеристичні функції і їх зміни.
3. Інтерпретувати термодинамічні потенціали і їх зміни.
4. Розраховувати зміну ентропії і ізобарно-ізотермічні потенціали в різних хімічних і фізіко-хімічних процесах і оцінювати отримані результати.
Зміст навчання
Перелік теоретичних питань:
1. Визначення термодинамічних процесів: самодовільних, несамодовільних, рівноважних, оборотних, необоротних.
2. Другий закон термодінаміки. Постулат Планка.
3. Характеристичні функції і їх зміна.
4. Термодинамічні потенціали і їх зміна.
5. Рівняння Гіббса-Гельмгольца.
6. Застосування другого закону термодінаміки і рівнянь Гиббса-Гельмгольца для розрахунку змін характеристичних функцій і термодінамічних потенціалів.
7. Разрахунок зміни ентропії.
8. Розрахунок зміни ізобарно-ізотермічного потенціалу (енергії Гіббса). Застосування другого закону термодінаміки і рівнянь Гіббса-Гельмгольца у фармації.
Граф логічної структури теми: “Другий закон термодинаміки. Термодинамічні потенціали і характеристичні функції”
Джерела інформації
Основна література:
1. Фізична і колоїдна хімія/ В.І Кабачний, Л.К. Осіпенко, Л.Д. Грицан та ін.; За заг. ред. В.І. Кабачного.- Харків.: Вид-во УкрФА «Прапор», 1999. -С. 28-38.
2. Фізична та колоїдна хімія. Збірник задач / В.І. Кабачний, Л.К. Осипенко, Л.Д. Грицан та ін.; Під ред. В.І.Кабачного. - Харьків: Вид-во НФАУ „Золоті сторінки", 2001. -С. 18-19.
3. Лекція з теми.
Додаткова література:
1. Физическая и коллоидная химия/ В.И. Кабачный, Л.К. Осипенко, Л.Д. Грицан и др..: Под об.ред. В.И. Кабачного.-Харьков.: Издательство УкрФА «Прапор», 2005.- С. 1-29.
Орієнтовна основа дії
Алгоритм рішення задач — див. заняття 1.
Набір завдань для перевірки досягнення конкретних цілей навчання
Тест 1
Термохимічні розрахунки дозволяють прогнозувати теплові ефекти тих або інших реакцій, які лежать в основі синтезу лікарських препаратів. Для розрахунку теплового ефекту реакції при підвищеній температури слід використовувати рівняння:
А. Кірхгофа
В. Больцмана
С. Ізобари
D. Ізотерми
Е. Ізохори
Тест 2
У ізольованій системі для визначення можливості і напряму протікання самодовільних процесів використовують зміну термодинамічній функції:
А. Ентальпії
В. Ентропії
С. Енергії Гиббса
D. Енергії Гельмгольца
Е. Внутрішньої енергії
Тест 3
Ентропія - міра неупорядоченності системи. В ході хімічних і біохімічних реакцій величина ентропії може змінюватися. Вкажіть, не проводячи розрахунків, в якому з приведених процесів ентропія зростає.
А. СН4 (г) + С12 (г) = СНзСІ (г) +НС1
В. 4А1(т) + 3С (т) = АlС3 (т)
С. С (графіт) +СО2 (т) = 2СО (г)
D. Н2 (г) + С12 (г) = 2 НС1 (г)
Е. 4 НС1 (г) +О2 (г) = 2Сl2 (г) + 2Н2О
Тест 4
Ентропія - міра невпорядкованості системи. Ентропія системи зменшується в процесі:
А. Дисоціації
В. Сублімації
С. Випаровування
D. Полімеризації
Е. Плавлення
Тест 5
Йодоформ при зберіганні мимоволі розкладається з утворенням йоду. Яка з термодінамічних функцій може служити критерієм спрямування цього процесу при постійних V і Т?
А. Внутрішньої енергії
В. Енергії Гіббса
С. Ентальпія
D. Ентропія
Е. Енергія Гельмгольца
Тест 6
Розрахуйте зміни ентропії при перетворенні 0,1 кг води, узятої при 0°С, в пар при 120°С. Питома теплота випаровування води при 100°С дорівнюється 2,255 кДж/г; питома теплоємність рідкої води складає 4,184 Дж/(г-К); питома теплоємність пари при постійному тиску рівна 19,958 Дж/(г-К).
А. 839,654 Дж/К
В. 800 Дж/К
С. 300 Дж/К
D.139,654 Дж/К
E. 339,654 Дж/К
Еталони відповідей до рішення цільових навчальних завдань:
тест 1-А, тест 5-Е, тест 6 - А
Короткі методичні вказівки до роботи на практичному занятті
На початку заняття перевіряється підготовленність студентів до заняття шляхом усного опитування, або тестування. Далі студенти студенти працюють самостійно у відповідності до ООД, викладених у методичних вказівках. Рішення ситуаційних задач оформлюється в робочому журналі. Далі проводиться поточний контроль за темою (набори тестів). Потім розглядаються результати самостійної роботи, аналізуються помилки, підводяться підсумки заняття.
Заняття 3
Термодинаміка хімічної рівноваги. Константи рівноваги. Рівняння ізотерми хімічної реакції. Залежність константи рівноваги від температури
Актуальність теми
Положення хімічної рівноваги характеризує та межа, до якої в даних умовах реакція може протікати без витрати енергії ззовні. Для кожної реакції існують співвідношення між концентраціями речовин при рівновазі, яка при постійній температурі є незмінною. Це співвідношення визначається константою рівноваги. Реакції найчастіше здійснюються при постійній температурі і постійному тиску. У таких випадках умовою хімічної рівноваги є мінімальне значення ізобарно-ізотермічного потенціалу. Константа рівноваги пов'язана із стандартною зміною цього потенціалу (рівняння ізотерми реакцій). Вивчення хімічної рівноваги з використанням рівнянь ізотерми, ізобари і ізохори реакцій відіграє велику роль як при теоретичних дослідженнях, так і при вирішенні практичних завдань.
