
2 курс / Гистология / ВОЗМОЖНОСТИ_ЖИДКОЙ_БИОПСИИ_В_СОВЕРШЕНСТВОВАНИИ_ПРОГНОЗА_ТЕЧЕНИЯ
.pdf91
При анализе по Спирмену показателей экспрессии генов в ЦОК и уровней lncRNA в сыворотке мы обнаружили следующие корреляции: PVT1 до ХТ и
ERCC1 в виментин+ ЦОК до ХТ (r=0,738, p=0,036); PVT1 до ХТ и VEGFA в
кадгерин+ ЦОК до ХТ (r=0,714, p=0,046; между этими показателями также присутствовала регрессионная взаимосвязь, р=0,037); MALAT1 до ХТ и ERCC1 в
виментин+ ЦОК во время ХТ (r=-0,578, p=0,009); HOTAIR до ХТ и VEGFA в
кадгерин+ ЦОК во время ХТ (r=-0,656, p=0,002); PVT1 до ХТ и CXCL2 в
кадгерин+ ЦОК во время ХТ (r=-0,964, p=0,0004); MALAT1 до ХТ и CXCL2 в
кадгерин+ ЦОК во время ХТ (r=0,519, р=0,022).
3.6. Цитокины сыворотки крови
Анализ крови на содержание IL-17Aи IL-18 до и во время ХТ выполнялся 72
пациенткам, характеристики которых представлены в таблице26.
Таблица 26. – Клинические характеристики пациенток, которым выполнялся анализ на цитокины крови
Клиническая характеристика |
|
Число пациенток (абс. (%) |
|
1. Возраст – медиана (IQRQ1-Q3), лет – 64 (55-68) |
|
|
|
2. Уровень СА-125 при поступлении – медиана (IQR), Ед/мл – 355 (144-724) |
|||
3. Стадия FIGO |
|
|
|
- I |
|
7 |
(9,7%) |
- II |
|
1 |
(1,4%) |
- III |
|
43 |
(59,7%) |
- IV |
|
21 |
(29,2%) |
4. Наличие асцита при первичной диагностике |
|
||
Да |
|
51 |
(75,0%) |
Нет |
|
21 |
(25,0%) |
5. Гистологический подтип |
|
|
|
Серозный |
|
37 |
(51,4%) |
Муцинозный |
|
2 |
(2,7%) |
Эндометриоидный |
|
1 |
(1,4%) |
Светлоклеточный |
|
2 |
(2,7%) |
Недифференцированный |
|
5 |
(6,9%) |
Не определялся из-за CRS 3 |
|
2 |
(2,7%) |
Не получен гистоанализ (цитологическая |
|
23 |
(31,9%) |
верификация) |
|
|
|
6. Режим химиотерапии |
|
|
|
Неоадъювантная |
|
51 |
(75,0%) |
Адъювантная |
|
21 |
(25,0%) |
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
92
Клиническая характеристика |
|
|
Число пациенток (абс. (%) |
|
7. Циторедуктивная операция |
|
|||
Проводилась |
|
|
40 (58,8%) |
|
Не проводилась |
|
|
32 (41,2%) |
|
8. Поддерживающая терапия |
|
|||
Получали |
|
9 (12,5%) |
|
|
Не получали |
|
63 (87,5%) |
|
|
Изначальные уровни IL-17Aи IL-18 |
в крови пациенток значимо не |
|||
отличались от контрольных (р=0,116 и р=0,331 соответственно). Содержание IL-
17Aв крови пациенток с РЯ до лечения было ниже, чем у пациенток с доброкачественными опухолями яичников (р=0,012), а при доброкачественных
опухолях экспрессия IL-17А была повышена в сравнении с контролем (р=0,042)
(таблица 27).
Таблица 27. – Содержание IL-17Aи IL-18 в крови женщин контрольной группы, группы сравнения, пациенток с РЯ до лечения и пациенток с РЯ на фоне ХТ
|
|
IL-17А |
|
|
IL-18 |
|
||
|
|
|
|
|
|
|
|
|
|
в кон- |
в группе |
при РЯ |
при РЯ на |
в конт- |
в группе |
при РЯ |
при РЯ |
|
троле |
сравнения |
до ХТ |
фоне ХТ |
роле |
сравнения |
до ХТ |
на фоне ХТ |
Медиана, |
41,48 |
63,54 |
38,36 |
43,67 |
299,90 |
255,77 |
348,77 |
299,40 |
пг/мл |
|
|
|
|
|
|
|
|
Q1, пг/мл |
39,58 |
51,23 |
29,53 |
32,39 |
161,69 |
214,24 |
192,27 |
210,92 |
Q3, пг/мл |
47,13 |
70,13 |
54,69 |
62,87 |
376,77 |
319,03 |
451,08 |
389,52 |
В ходе лечения уровни IL-17А и IL-18 не изменились в сравнении с изначальными (р=0,134 и р=0,760 соответственно) в группе в целом,
носодержаниеIL-18 снижалосьсредиплатинорефрактерных пациенток (р=0,011). У
пациенток, получавшихадъювантную ХТ, в динамике повышался уровень IL-17А (р=0,017).
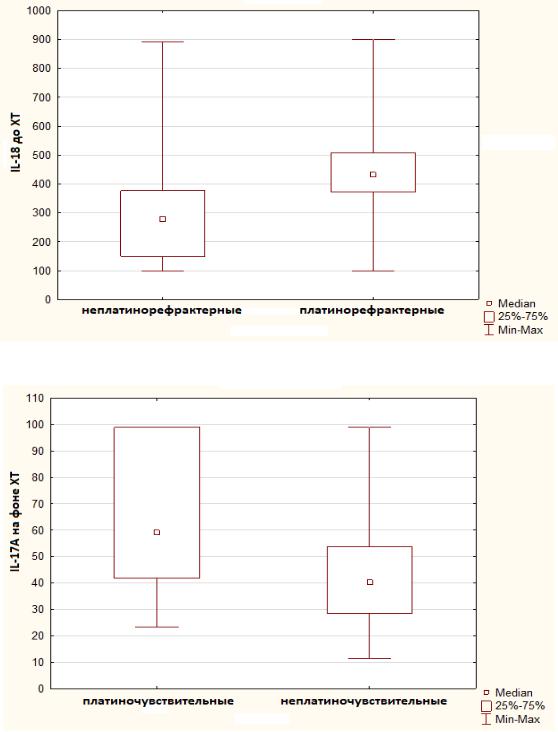
Уровни IL-17 и IL-18 до и во время лечения не отличались в зависимости от гистологического типа опухоли и стадии заболевания; содержание IL-18 до лечения у рефрактерных пациенток было выше, чем у остальных (р<0,001) (рис.17).
Присутствовала тенденция к повышению уровняIL-17 в ходе лечения среди пациенток с платиночувствительной опухолью по сравнению с нечувствительной
(р=0,054) (рис.18).
93
Рисунок 17. – Содержание IL-18в крови пациенток с клинически платинорефрактерным и не платинорефрактернымраком яичников
Рисунок 18. - Содержание IL-17Aв крови пациенток с клинически платиночувствительным и не платиночувствительнымраком яичников
Уровни IL-17, IL-18 в крови до ХТ не отличались в зависимости от наличия асцита при первичной диагностике (р=0,967, р=0,695). Содержание IL-17, IL-18 в
процессе ХТ в зависимости от наличия асцита (р=0,129 и р=0,877,
соответственно) и режима химиотерапии (НАХТ vsАХТ, p=0,341 и p=0,479,
соответственно) также не отличалось.
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
94
Среди пациенток, которым в ходе первой линии лечения была выполнена циторедуктивная операция, уровни IL-18 были ниже, чем у неоперированных пациенток, как до лечения (р=0,016), так и в процессе (р=0,052). Показатели IL-17
до и в ходе лечения в этих группах не различались.
Также обращало на себя внимание повышенное количество лейкоцитов в крови до лечения у пациенток с неплатиночувствительным заболеванием в сравнении с чувствительным (р=0,002), а также с наличием асцита в сравнении с его отсутствием (р=0,004). При этом между числом лейкоцитов и уровнем IL-18 в
крови до лечения присутствовала регрессионная взаимосвязь (R2=0,247, р<0,001).
Связь с СА-125, возрастом, числом тромбоцитов, ИМТ, СОЭ отсутствовала.
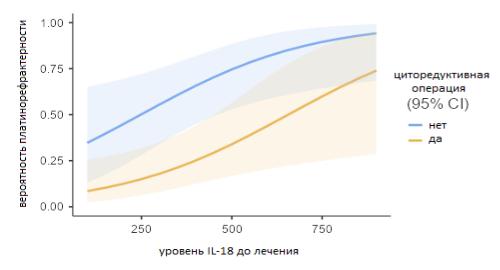
При построении модели биномиальной логистической регрессии для предсказания наличия рефрактерного заболевания из изученных показателей уровень IL-18 до лечения вносил малый, но значимый вклад (р=0,014, OR 1,004,
95% ДИ 1,001-1,008), снижая AICмодели, в уравнение в сочетании с фактором выполнения циторедуктивной операции (р=0,005, OR0,175, 95% ДИ 0,005-0,583;
характеристики модели: хи-квадрат 19,5, R20,233, специфичность 0,703,
чувствительность 0,720, точность 0,710, р<0,001) (рис.19).
Рисунок 19. – Вероятность платинорефрактерности РЯ в зависимости от выполнения циторедуктивной операции в первой линии лечения и уровня IL-18 в крови до начала терапии.
Как видно из таблицы 28, высокий уровень IL-18 до ХТ являлся неблагоприятным предиктором ВБП в однофакторном, но не многофакторном

95
анализе. При анализе ОВ наблюдался аналогичный результат: в однофакторном
анализе предиктивный потенциал присутствовал для IL-18 до ХТ (ОР 1,00, 95 %
ДИ 1,00-1,01, p=0,006) и во время ХТ (ОР 1,00, 95 % ДИ 1,00-1,01, p=0,008), но в
многофакторном анализе значимость терялась (p=0,183 и p=0,039
соответственно).
Таблица 28. – Результаты однофакторного и многофакторного регрессионного анализа для выживаемости без прогрессированияс учетом экспрессии IL-17A, IL18
Параметр |
Анализ, ОР (95 % ДИ) |
|
||
|
Однофакторный |
|
Многофакторный |
|
|
FIGO стадия |
|
|
|
1-2 |
- |
|
- |
|
3-4 |
2,96 (0,92-9,54, p=0,069) |
|
- |
|
|
FIGO M |
|
|
|
0 |
- |
|
- |
|
1 |
6,45 (1,48-28,03, p=0,013) |
|
|
|
|
Асцит |
|
|
|
Нет |
- |
|
- |
|
Да |
2,28 (1,14-4,57, p=0,020) |
|
2,05 (0,99-4,28, p=0,055) |
|
|
Хирургическая операция |
|
|
|
Да |
0,22 (0,12-0,39, p<0,001) |
|
0,18 (0,09-0,38, p<0,001) |
|
Нет |
- |
|
- |
|
|
Гистотип |
|
|
|
Серозный |
0,79 (0,34-1,86, p=0,588) |
|
- |
|
Несерозный |
- |
|
- |
|
|
Химиотерапия |
|
|
|
Адъювантная |
- |
|
- |
|
Неоадъювантная |
2,51 (1,26-4,99, p=0,009) |
|
1,03 (0,42-2,51, p=0,951) |
|
|
Поддерживающая терапия |
|
|
|
Да |
0,20 (0,06-0,66, p=0,008) |
|
0,09 (0,02-0,38, p=0,001) |
|
Нет |
- |
|
- |
|
Возраст |
1,01 (0,98-1,04, p=0,580) |
|
- |
|
Уровень СА-125 до |
1,00 (1,00-1,00, p=0,839) |
|
- |
|
лечения |
|
|
||
|
|
|
|
|
IL-17A до ХТ |
1,00 (0,99-1,01, p=0,826) |
|
- |
|
IL-18 до ХТ |
1,00 (1,00-1,01, p=0,009) |
|
1,00 (1,00-1,00, p=0,390) |
|
IL-17A во время ХТ |
1,00 (0,99-1,01, p=0,561) |
|
- |
|
IL-18 во время ХТ |
1,00 (1,00-1,00, p=0,377) |
|
- |
|
В кластерном анализе методом k-средних |
выделялись два кластера |
|||
пациентокна основании показателей IL-18 и числа лейкоцитов в крови до ХТ:
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

96
кластер 1 (IL-18 = 576,72пг/мл, количество лейкоцитов = 8,08*109/л) и кластер 2
(IL-18 = 274,17пг/мл, количество лейкоцитов = 6,72*109/л) (F=77,2, р<0,001 и
F=5.54, p=0,021 соответственно). При сравнении клинических характеристик между кластерами достоверно не различались доля выполнения операций,
неоадъювантной либо адъювантной ХТ, наличия асцита при первичной диагностике, распределение по стадиям, в то же время ВБП и ОВ в кластере 1 (с
высоким содержанием IL-18 и числом лейкоцитов) были ниже (логранговый критерий, р=0,012 и р=0,030 соответственно) (рис.20).
а
б
Рисунок 20. – Безрецидивная (а) и общая (б) выживаемостьв кластерах пациенток с высоким (1) и с низким (2) содержанием IL-18 и числом лейкоцитов в крови до лечения
97
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Механизмы развития и прогрессирования рака яичников во многом остаются неизученными, в связи с чем смертность от данного заболевания остается стабильно высокой в течение последних двух десятилетий. Применение таргетных препаратов позволяет существенно продлить выживаемость при РЯ, но таргетная терапия показана и доступна не всем пациенткам. Использование прогностических и предиктивных биомаркеров РЯ в реальной клинической практике ограничено определением уровня СА-125 и HE-4 в крови, а также мутационного статуса генов BRCA. Выявление новых биомаркеров РЯ может быть полезным как в клиническом, так и в фундаментальном смысле. Результаты трансляционных исследований биомаркеров помогают связать биологию канцерогенеза и прикладные вопросы уточнения прогноза болезни,
предоставляют потенциальные мишени для доклинических исследований,
выделяют группу пациенток, требующих наиболее пристального внимания в плане риска прогрессирования.
Среди методов исследования потенциальных биомаркеров рака яичников жидкая биопсия представлялась нам наиболее актуальной. Несмотря на бурное развитие области жидкой биопсии в онкологии в целом, литературные данные по РЯ крайне ограниченны. В то же время жидкая биопсия практически безболезненна и несет минимальные риски для здоровья пациентки, а изученные нами методы не относятся к таким высоко затратным, как, например,
высокопроизводительное секвенирование и многие другие методы, используемые
внастоящее время в рамках фундаментальных исследований.
Вданной работе мы ставили целью исследовать ряд маркеров, определение которых может быть транслировано в рутинную практику. Среди них количественные и качественные параметры циркулирующих опухолевых клеток,
свободно циркулирующие в крови длинные некодирующие РНК и цитокины.
Характеристики когорты пациенток в данном исследовании соответствовали характеристикам, наблюдаемым при раке яичников в целом и
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
98
описанным в литературе: средний возраст пациенток составил 57 (50,5-67,25) лет;
большинство женщин имели III и IV стадии заболевания (55,3 и 32,5%
соответственно); асцит при первичной диагностике присутствовал у 76,6%
участниц; абсолютному большинству участниц среди тех, кому выполняли патоморфологическое исследование, был выставлен диагноз high-grade серозной аденокарциномы (80,2 % без учета четырех пациенток с полным CRS и
невозможностью определить подтип); наследственный анамнез отмечали 13 %
пациенток. В данную работу не были включены данные о BRCA-статусе пациенток. Безусловно, отсутствие наследственного анамнеза не исключает наличие синдрома наследственного рака молочной железы и яичников.
Отсутствие данных о BRCA-статусе является ограничением данного исследования, но стоит отметить, что результат стандартного ПЦР-анализа распространенных мутаций далеко не всегда точен, а секвенирование генов BRCA
обладало низкой доступностью на момент проведения исследования; кроме того,
участницы получали одинаковую схему химиотерапии и не получали таргетные препараты, назначение которых определяется BRCA-статусом.
Среди клинических признаков в нашей когорте предикторами длительности ВБП были возраст и факт выполнения циторедуктивной операции, что согласуется с данными литературы, свидетельствующими о крайней важности циторедуктивного вмешательства для пациенток с раком яичников. Важная роль выполнения операции сохранялась во всех подгруппах и также была статистически значима в отношении длительности ОВ. Кроме того, предиктором общей выживаемости была клиническая платиночувствительность первого рецидива, что также согласуется с современными представлениями, поскольку неплатиновые цитостатики гораздо менее эффективны при данном заболевании.
Следует отметить, что в многофакторном анализе с участием только прооперированных пациенток (73 пациентки, 63,7% от общей когорты)
адъювантная химиотерапия была связана с выигрышем в ОВ в сравнении с неоадъювантной. Сравнительная эффективность НАХТ и АХТ при раке яичников остается предметом споров среди врачей-исследователей. Во многом это связано
99
с отсутствием общепринятых показаний к НАХТ, сложностью оценки распространенности перитонеальногоканцероматоза до операции [231].
В двух из четырех подгрупп пациенток регрессионная связь между применением бевацизумаба и длительностью ВБП ожидаемо достигала статистической значимости, однако в целом доля участниц, получавших поддерживающую терапию бевацизумабом, была невелика (12,3%), что, скорее всего, является причиной отсутствия аналогичного результата в общей когорте.
Исследования показали, что при всех использованных нами методиках показатели биомаркеров в крови до лечения и во время лечения значимо не изменялись: это касается и числа различных ЦОК, и экспрессии маркеров в ЦОК,
и циркулирующих длинных некодирующих РНК (lncRNA), и цитокинов.
Единственным исключением было снижение содержания IL-18 в крови платинорефрактерных пациенток (р=0,011). На основании этого можно предполагать, что либо однократный забор крови достаточно информативен, либо для анализа в динамике следует использовать другую временную точку,
например, по завершении всех курсов первой линии лечения.
Ни один из изученных маркеров не коррелировал с уровнем СА-125:
очевидно, данные маркеры не имеют связи с распространенностью заболевания,
каковая наблюдается для СА-125. Это подтверждается и отсутствием связей с клинической стадией болезни, за исключением повышенного содержания
HOTAIR до ХТ при наличии отдаленных метастазов в сравнении с их отсутствием
(р=0,022).
Несмотря на статистически схожие численные значения всех изучаемых показателей, результаты корреляционного и факторного анализов до и во время лечения были различными. В первой подгруппе исследования оценивались численность ЦОК, определяемых согласно маркерам клеточной поверхности как эпителиальные, мезенхимальные, бифенотипичные и различные варианты стволовых. До лечения количества клеток эпителиального и мезенхимального фенотипов коррелировали между собой (EpCAM+CK+ и EpCAM-vim+ (r=0,427, p=0,021), EpCAM+CK+ и vim+ (r=0,436, p=0,018)), а содержание мезенхимальных
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/

100
клеток коррелировало с содержанием некоторых из стволовых фенотипов (CKvim+ и CD133+ALDHhigh (r=0,505, p=0,027) и EpCAM-vim+ и ALDHhigh (r=0,597, p=0,004)). Во время лечения все эти корреляции не наблюдались. Более того, до лечения число клеток, экспрессирующих все три стволовых маркера
(CD44+CD133+ALDHhigh), возрастало с ростом числа эпителиальных ЦОК
(EpCAM+CK+, R2=0,315, p=0,002), а во время лечения между показателями
EpCAM+CK+ и CD44+CD133+ наблюдалась отрицательная корреляция (r=−0,584, p=0,011). Наглядно различия во взаимоотношениях переменных можно увидеть на рис. 21, демонстрирующем результаты анализа главных компонент с указанными показателями.
Рисунок 21. – Результаты анализа методом главных компонент с учетом показателей числа ЦОК эпителиального, мезенхимального, стволового фенотипа в образцах до ХТ (слева) и во время ХТ (справа)
В одном из исследований [227] авторы использовали комплексный подход для выявления EpCAM-положительных ЦОК рака яичников, который включал параллельный анализ с помощью ПЦР и иммунофлуоресцентного (ИФ)
окрашивания в образцах крови, полученных до и после первичного лечения (через
6 месяцев после окончанияадъювантной терапии). Количество ЦОК до и после лечения не отличалось, однако в образцах до лечения присутствовала конкордантность результатов, полученных двумя методами, а после лечения
