
6 курс / Кардиология / Кардиология_Национальное_руководство_Е_В_Шляхто_
.pdf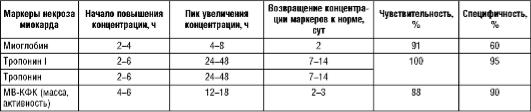
тропонины и активность МВ-КФК обладают низкой чувствительностью в ранние сроки ИМ (первые 4-6 ч). Однако тропонины дают возможность отсроченной диагностики ИМ (до 1-2 нед от начала заболевания), тогда как исследование активности/массы МВ-КФК или содержания миоглобина целесообразно только в течение 1-2 сут.
Сочетание повышения тропонинов Т или I и ангинозного приступа считают достаточным основанием для постановки диагноза ИМ без подъема сегмента ST.
Таблица 4.7. Изменение содержания миоглобина, тропонинов и активности МФ-КФК при остром инфаркте миокарда [6]
Сердечные тропонины также служат важным показателем для стратификации риска и определения тактики лечения. У больных с повышенным уровнем сердечных тропонинов значительно увеличивается риск коронарных осложнений.
ИССЛЕДОВАНИЕ КОАГУЛЯЦИОННОГО ГЕМОСТАЗА
Наибольшее клиническое значение при ССЗ имеет определение:
•активированного частичного тромбопластинового времени (АЧТВ);
•протромбинового времени (протромбиновый индекс);
•международного нормализованного отношения(МНО);
•тромбинового времени.
Для оценки степени риска тромбообразования у пациентов с ССЗ оценивают также содержание в крови антитромбина III, продуктов деградации фибрина (ПДФ) и D-димера
[4-7].
АКТИВИРОВАННОЕ ЧАСТИЧНОЕ ТРОМБОПЛАСТИНОВОЕ ВРЕМЯ
Принцип метода заключается в определении времени свертывания плазмы в условиях стандартизации не только контактной, но и фосфолипидной (тромбопластиновой) активации факторов свертывания. С этой целью к плазме добавляют смесь каолина и кефалина (тромбопластиновый активатор), а также хлорид кальция и по секундомеру определяют время свертывания плазмы. В норме АЧТВ (кефалин-каолиновое время) составляет 35-45 с. АЧТВ чрезвычайно чувствительно к дефициту плазменных факторов свертывания, участвующих во внутреннем механизме свертывания (факторы XII, XI, IX, VIII) и не зависит от снижения содержания или функциональной недостаточности тромбоцитов.
Уменьшение АЧТВ <35 с свидетельствует о гиперкоагуляции крови и склонности к тромбозам, увеличение >45 с - о гипокоагуляции крови. Показатель АЧТВ используют для контроля за лечением НФГ.
ПРОТРОМБИНОВОЕ ВРЕМЯ (ПРОТРОМБИНОВЫЙ ИНДЕКС)
Исследование заключается в определении времени рекальцификации плазмы при добавлении в нее тканевого тромбопластина человека или кролика, что приводит к «запуску» свертывания по внешнему механизму. Тканевой тромбопластин в комплексе с фактором VII и ионом Са2+ активирует фактор X, входящий в состав «проактиватора протромбина».
В норме протромбиновое время составляет 12-18 с и во многом зависит от активности тканевого тромбопластина, использованного при исследовании. По этой причине в большинстве случаев для определения этого показателя одновременно по той же методике исследуют плазму донора и вычисляют так называемый протромбиновый индекс (процентное отношение протромбинового времени донора к протромбиновому времени больного). В норме протромбиновый индекс составляет 90-100%. Чем больше протромбиновое время, свидетельствующее о гипокоагуляции крови, тем меньше значение протромбинового индекса, и наоборот.
Удлинение протромбинового времени (уменьшение протромбинового индекса) интегрально отражает недостаточность плазменных факторов, участвующих во внешнем механизме свертывания и в активации протромбина (факторы VII, X, V), а также на конечных этапах коагуляции (факторы I и II). Наиболее частые причины удлинения протромбинового времени (уменьшения протромбинового индекса):
•прием непрямых антикоагулянтов (фениндион, аценокумарол, варфарин и др.);
•дефицит соответствующих витамин К-зависимых факторов свертывания (факторы II, VII, IX, X) при тяжелых поражениях паренхимы печени (гепатит, цирроз, рак) и недостаточности витамина К (механическая желтуха, нарушения всасывания в кишечнике, дисбактериоз кишечника);
•дефицит К-независимого фактора свертывания фибриногена (гипофибриногенемия) при тяжелых поражениях паренхимы печени;
•наличие феномена паракоагуляции, в частности при синдроме ДВС.
МЕЖДУНАРОДНОЕ НОРМАЛИЗОВАННОЕ ОТНОШЕНИЕ
Поскольку тромбопластиновые реагенты, используемые в различных клинических лабораториях для определения протромбинового индекса, имеют различную чувствительность к недостатку факторов свертывания крови, возникла необходимость стандартизации методов определения протромбинового индекса. С этой целью в качестве эталона был выбран один из образцов человеческого мозгового тромбопластина. В настоящее время все тромбопластиновые реагенты, выпускаемые различными фирмами, калибруют по отношению к этому эталону и определяют коэффициент пересчета показателей протромбинового индекса, полученных в той или иной лаборатории. Система такой калибровки получила название «международное нормализованное отношение»(МНО).
В норме МНО составляет около 1,0. Увеличение МНО свидетельствует о гипокоагуляции, а уменьшение - о гиперкоагуляции крови и склонности к тромбообразованию. Показатель МНО используют для оценки эффективности приема непрямых антикоагулянтов.
ТРОМБИНОВОЕ ВРЕМЯ
Метод оценки тромбинового времени заключается в определении времени свертывания плазмы при добавлении в нее тромбина со стандартной активностью, который обладает способностью вызывать превращение фибриногена в фибрин без участия других факторов свертывания крови.
В норме тромбиновое время составляет 15-18 с. Определение тромбинового времени позволяет оценить конечный этап свертывания крови (превращение фибриногена в фибрин). Таким образом, оно зависит от концентрации фибриногена, его свойств и наличия в крови ингибиторов тромбина (гепарина и антитромбина III).
Причины удлинения тромбинового времени:
•афибриногенемия и гипофибриногенемия;
•ДВС-синдром и другие патологические состояния, сопровождающиеся феноменом паракоагуляции с нарушением процесса полимеризации фибрина и нарастанием концентрации в крови ПДФ;
•тяжелые нарушения белково-синтетической функции печени, сопровождающиеся снижением синтеза фибриногена;
•острый фибринолиз;
•увеличение в крови концентрации ингибиторов тромбина (антитромбина III, гепарина).
Удлинение тромбинового времени >18 с свидетельствует о нарушении конечного этапа свертывания крови - превращения фибриногена в фибрин. Определение тромбинового времени используют для контроля за лечением гепарином и фибринолитиками.
АНТИТРОМБИН III
Антитромбин III относят к группе первичных физиологических антикоагулянтов, на долю которого приходится 3/4 активности всех физиологических ингибиторов коагуляции. Он инактивирует все ключевые факторы свертывания: тромбин, факторы Ха, ?Ха, Х?а, Vila.
XIIa. Кроме того, антитромбин III - плазменный кофактор гепарина, образует с ним комплекс, обладающий выраженными антикоагулянтными свойствами [5; 7].
Снижение содержания антитромбина III ниже 5-8 мг/л сопровождается тяжелыми рецидивирующими венозными тромбозами, ТЭЛА, инфарктами органов. При этом антикоагулянтная активность гепарина, вводимого парентерально, резко снижается из-за отсутствия кофактора - антитрипсина III.
ПРОДУКТЫ ДЕГРАДАЦИИ ФИБРИНА (ПДФ)
ПДФ в небольших количествах образуются и в норме (<10 мг/мл) в результате расщепления фибрина и фибриногена под действием плазмина. Повышение содержания ПДФ в плазме крови - признак усиливающегося внутрисосудистого свертывания крови (ДВС-синдром) или массивных тромбозов глубоких вен и тромбоэмболий, сопровождающихся активацией фибринолитической системы. Увеличение содержания ПДФ наблюдается также при лечении фибринолитическими препаратами, при лейкозах, инфекционных заболеваниях, парапротеинемиях, коллагенозах, сепсисе [5; 7].
D-ДИМЕР
D-димер - фрагмент фибриногена (фибрина), образующийся при его расщеплении плазмином. D-димер относят к одному из главных маркеров активации системы
гемостаза, отражающему как интенсивность образования в крови фибрина, так и его лизис. Его концентрация в норме составляет 0,5 мкг/мл. Повышение значений D-димера свидетельствует о возросшем риске тромбообразования или о начавшемся процессе формирования тромба, а также об активации фибринолиза и наблюдается при тромбозах глубоких вен, ТЭЛА или ДВС-синдроме. Нормальные концентрации D-димера полностью исключают наличие тромбоза. Умеренно повышенный уровень D-димера может наблюдаться у больных ИМ, пациентов со злокачественными новообразованиями, заболеваниями печени, сепсисе, свидетельствуя о повышенной склонности этих больных к тромбообразованию.
Список литературы
1.Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. - Рекомендации ВНОК, 2009.
2.Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST ЭКГ. Рекомендации ВНОК, 2007 // Кардиоваскуляр. тер. и профилактика. - 2007. -№ 6(8). - Приложение. - С. 415-500.
3.Исследование системы крови в клинической практике / Под ред. Г.И. Козинца, В.А. Макарова. - М.: Триада-Х, 1997. - 480 с.
4.Кардиология. Национальное руководство. Краткое издание / Под ред. Ю.Н. Беленкова, Р.Г. Оганова. - М.: ГЭОТАР-Медиа, 2012. - 835 с.
5.Пантелеев М.А., Васильев С.А., Синауридзе Е.И. и др. Практическая коагулология / Под ред. А.И. Воробьева. - М.: Практическая медицина, 2011. - 192 с.
6.Ройтберг Т.Е., Струтынский А.В. Внутренние болезни. Лабораторная и инструментальная диагностика. - М.: МЕДпресс-информ, 2013. - 799 с.
7.Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (2009) // Флебология. - 2010. №1. - С. 2-37.
8.Сахарный диабет: диагностика, лечение, профилактика / Под ред. И.И. Дедова и М.В. Шестаковой. - М.: МИА, 2011. - 123 с.
9.American Diabetes Association. Diagnosis and classification of diabetes mellitus // Diabetes Care. - 2011. - Vol. 34 (Suppl. 1). - P. 62-69.
10.Definition and diagnosis of diabetes mellitus and intermediate hyperglycemia. Report of WHO // IDF Consultation, 2006.
11.ESC/EAS Guidelines for the management of dyslipidaemias. The Task Force for the management of dyslipidaemias of the European Society of Cardiology ESC) and the European Atherosclerosis Society (EAS) // Eur. Heart J. - 2011. - N 32. - Р. 1769-1818.

Раздел 9
Глава 5. Молекулярно-генетические и клеточные методы исследования в кардиологии (А.А. Костарева, С.В. Анисимов, Э.В. Земцовский)
ПЕРСОНАЛИЗИРОВАННАЯ МЕДИЦИНА
Развитие фундаментальной науки, молекулярной медицины, генетики и трансляционных биомедицинских исследований позволило сегодня иначе взглянуть на происхождение целого ряда заболеваний ССС и даже пересмотреть структуру причин некоторых заболеваний, в частности СН. Важнейшим следствием этого должно стать внедрение молекулярно-генетических технологий в развитие так называемой персонализированной медицины, предполагающей определение тактики лечения и назначение ЛС в зависимости от наличия конкретных мишеней для их воздействия, индивидуального профиля чувствительности и метаболизма.
Наиболее яркий пример практического внедрения подобных технологий - профилактика тромбозов, которая уже сегодня не может грамотно проводиться без учета генотипов, определяющих резистентность к тому или иному виду антикоагулянтной и дезагрегантной терапии. В ближайшие годы ожидается огромный рост объема научных и клинических данных, которые станут основой индивидуализированного подхода к антитробоцитарной и антикоагулянтной терапии, лечению КМП и нарушений ритма, профилактике ожирения, что неизменно повлечет за собой изменение клинических рекомендаций и необходимость внедрения подобных технологий в широкую клиническую практику. Этот абсолютно новый для медицины подход создаст условия не только для существенного снижения смертности, но и для улучшения отдаленных результатов высокотехнологичных вмешательств на сердце и сосудах.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Молекулярно-генетическая диагностика - очень дорогостоящая и трудозатратная область лабораторной диагностики. Несмотря на существенный прогресс в медикобиологических технологиях, данная область пока не может быть высоко автоматизирована, и работа над одним клиническим случаем занимает несколько недель и даже месяцев. Это, а также отсутствие достаточного количества профессиональных центров специализированной молекулярно-генетической диагностики - причины незначительного внедрения генетической диагностики в кардиологии. Недавно появившиеся методы секвенирования нового поколения активно внедряются в клиническую практику во многих странах мира и, несомненно, в ближайшем будущем сделают эту диагностику более доступной и в нашей стране.
Применение методов генетической диагностики к кардиологии направлено на изучение причин как моногенной патологии (врожденные нарушения ритма, синдром Марфана, КМП), так и полигенных многофакторных заболеваний (АГ, СД 2-го типа, ИБС).
• В случае моногенной патологии генетическая диагностика имеет непосредственное клиническое значение, и определение причинных мутаций генов может повлиять на терапию и прогноз заболевания.
• В случае полигенных многофакторных заболеваний генетические исследования направлены в основном на поиск генетических маркеров предрасположенности, модулирующих риск возникновения, особенностей течения и прогноз заболевания, а также ответа на терапию. Данные исследования носят в основном научный характер, и международные рекомендации об их применении в рутинной клинической практике пока отсутствуют. Даже информация о новых генетических маркерах, достоверно ассоциированных с повышенным риском развития ожирения и ИБС, не имеет доказанного клинического значения, поскольку при большинстве полигенных многофакторных заболеваниях вклад традиционных ФР значительно превышает влияние генетических. Несмотря на большой объем фундаментальных исследований, проведенных в этой области, информация о генетических вариантах, предрасполагающих к развитию заболеваний, на сегодняшний день не может и не должна использоваться для клинических целей. Исключение могут составлять только исследования генетических факторов системы гемостаза.
Показания для проведения генетической диагностики при заболеваниях сердечнососудистой системы
Дороговизна и трудозатратность генетической диагностики при моногенной патологии диктует необходимость формулировки четких клинических показаний к проведению генетического тестирования. Основные факторы, определяющие целесообразность проведения генетической диагностики врожденной патологии, - возможность использовать полученные данные генетического анализа для определения прогноза заболевания, принятия решения о тактике ведения пациента, определения степени риска для кровных родственников и возможность использовать данные генетического анализа для профилактики осложнений заболевания.
На практике генетическую диагностику нечасто используют для подтверждения диагноза, поскольку большинство клинических состояний и заболеваний имеют четкую клиническую картину, и постановка правильного диагноза в большинстве случаев возможна и без дополнительных генетических исследований. Так, в большинстве случаев диагнозы ГКМП, некомпактного миокарда левого желудочка (НМЛЖ), синдрома удлиненного интервала Q-T, синдрома Бругада не нуждаются в подтверждении с помощью генетических методов обследования и могут быть поставлены по клиническим и инструментальным признакам. В то же время знание о наличии определенного генетического дефекта позволяет проводить каскадное скрининговое обследование членов семьи больного для выявления у них заболевания еще на доклиническом уровне. Это позволяет, во-первых, избежать регулярных диагностических манипуляций и наблюдения тем членам семьи, которые не имеют генетического дефекта и, соответственно, не имеют риска развития заболевания; во-вторых, позволяет снять психологическую напряженность и тревогу, связанную с ощущением неизвестности в семьях, где имелись случаи тяжелых наследственных заболеваний.
Другим немаловажным результатом генетического тестирования в ряде случаев может являться возможность назначения этиотропной патогенетической терапии. Так, например, в случае синдрома удлиненного интервала Q-T 3-го типа эффективным может быть назначение препаратов группы блокаторов натриевых каналов IB и IC классов, которые в большинстве случаев противопоказаны при других типах синдрома. Данный подход с подбором этиотропной терапии, основанной на молекулярно-генетической
верификации, лежит в основе персонифицированной медицины. Сегодня спектр возможностей подобной терапии не так широк, но именно в случаях генетически обусловленной врожденной патологии его применение оправдано, и со временем спектр подобных заболеваний будет расширяться.
Таким образом, основные показания для проведения генетической диагностики моногенных заболеваний ССС следующие.
•Подтверждение диагноза у пробанда. Данное показание используют не так часто, поскольку диагноз в большинстве случаев ставят на основании клинических данных. Примером может служить диагностика аритмогенной дисплазии правого желудочка (АДПЖ) на ранних стадиях при наличии эпизодов ЖТ еще без признаков расширения полостей сердца (если в соответствии с модифицированными критериями диагностики диагноз представляется сомнительным). Другой пример - дифференциальная диагностика различных форм амилоидоза и проведение генетической диагностики для исключения его наследственной формы.
•Скрининговое обследование родственников пробанда с выявленным генетическим дефектом. Данное показание наиболее часто используют в клинической практике. Так, если у больного на основе клинической картины заболевания поставлен диагноз ГКМП, а в семье имеются родственники, для которых вопрос о возможном носительстве патогенной мутации актуальный (дети, подростки, занимающиеся спортом, представители профессий, связанных с повышенным риском и ответственностью за людей), генетическая верификация диагноза и последующий скрининг родственников абсолютно показаны.
•Выбор терапевтической тактики у учетом данных генетического анализа. Наиболее часто данное показание используют при наследственных аритмологических синдромах, в частности, при синдроме удлиненного интервала Q-T, когда показания к назначению терапии β-адреноблокаторами определяют с учетом данных генетического анализа.
Широкое внедрение методов молекулярно-генетической диагностики, информированность населения и врачей, с одной стороны, и сложность интерпретации полученных результатов, ответственность, связанная с принятием решений, основываясь на данных генетической диагностики, с другой стороны, продиктовали необходимость создания единых рекомендаций и консенсусного документа, определяющего показания к проведению молекулярно-генетической диагностики при моногенных заболеваниях ССС. Данный документ был разработан совместно обществом Сердечного ритма (Heart Rhythm Society) и Еворопейской ассоциацией сердечного ритма (European Heart Rhythm Association). Этот документ посвящен генетической диагностике при нарушениях ритма сердца и КМП - заболеваниях, при которых данная диагностика наиболее актуальна и востребована.
На сегодняшний момент вопрос о проведении генетической диагностики может рассматриваться для следующих групп заболеваний.
•Синдром удлиненного интервала Q-T.
•Катехолзависимая ЖТ (CPVT).
•Синдром Бругада.
•Прогрессирующее нарушение проводимости (CCD).
•Синдром укороченного интервала Q-T.
•ФП.
•Гипертрофическая КМП (ГКМП).
•Аритмогенная КМП.
•Дилатационная КМП (ДКМП).
•Некомпактный ЛЖ.
•Рестриктивная КМП (РКМП).
•Случаи внегоспитальной остановки сердца с благоприятным исходом.
•Случаи посмертной ДНК-диагностики и генетической диагностики погибших родственников.
Среди данных показаний обращают на себя внимание последние два пункта, которые достаточно неожиданные и новые. Им в данной главе будет уделено особое внимание.
Молекулярно-генетическая диагностика при синдроме удлиненного интервала Q-T
Причина врожденного синдрома удлиненного интервала Q-T в большинстве случаев - мутации в генах, кодирующих ионные каналы кардиомиоцитов. С помощью ионных каналов происходит формирование потенциала действия кардиомиоцита. Нарушение их функции вследствие мутаций влечет грубое изменение процессов автоматизма, возбудимости и проводимости кардиомиоцитов. На сегодняшний момент известно 13 генов мутации, которые ассоциированы с развитием синдрома удлиненного интервала Q-T, и список их ежегодно пополняется. Однако наиболее частые - мутации в генах быстрых и медленных калиевых каналов, а также мутации гена натриевых каналов (KCNQ1, KCNH2, SCN5A, ассоциированные с синдромом удлиненного интервала Q-T 1-3 типов); на долю же каждого их оставшихся 10 генов приходится не более 1-2% случаев заболевания. Мутации в генах, ассоциированных с развитием 1-3 типов, определяются примерно в 50-60% случаев, поэтому генетический скрининг именно этих трех генов целесообразен в рутинной практике у больных с синдромом удлиненного интервала Q-T.
Генетическое исследование показано всем больным с удлинением Q-T и ЖТ. Больным с изолированным удлинением интервала Q-T без признаков нарушений ритма также показано проведение генетического исследования, поскольку первое проявление заболевания в виде эпизода ЖТ может явиться летальным и привести к ВСС. Всем родственникам больных с идентифицированным генетическим дефектом показано генетическое исследование на предмет подтверждения или исключения носительства данного генетического дефекта. Это особенно важно, так как отсутствие ЭКГ-признаков и нормальная длительность интервала Q-T могут наблюдаться примерно в 30-40% случаев заболевания и не исключают риска развития ВСС.
Синдром удлиненного интервала интервала Q-T - пример заболевания, при котором данные генетического анализа необходимы для определения оптимальной тактики ведения больного. Так, при синдроме 1-го типа, связанном с мутациями в гене калиевого канала, развитие эпизодов ЖТ наиболее часто ассоциировано с повышением ЧСС на фоне ФН и эмоционального стресса, поэтому в качестве профилактики развития эпизодов ЖТ максимально эффективно назначение β-адреноблокаторов. В случае же синдрома 3-го типа, связанного с мутациями в гене SCN5A, эффективным антиаритмическим действием могут обладать препараты группы блокаторов натриевых
каналов - флекаинидρ и мексилетин. Идентификация генетической причины заболевания имеет также прогностическое значение. Так, наибольшая частота развития неблагоприятных событий ассоциирована также с 3 типом синдрома (мутации в гене SCN5A). В связи с этим в настоящее время синдром удлиненного интервала Q-T - наиболее частое показание для проведения генетической диагностики как в связи с высокой частотой этого заболевания (1:2000), так и в связи с высокой ее эффективностью (50-60%) и клинической значимостью.
Молекулярно-генетическая диагностика при полиморфной желудочковой тахикардии и синдроме Бругада
Катехолзависимая ЖТ - генетически обусловленное заболевание с возникновением злокачественных эпизодов жизнеугрожающей желудочковой двунаправленной тахикардии на фоне адренергической стимуляции. В большинстве случаев дебют данного заболевания в виде синкопальных состояний и ВСС развивается в детском и подростковом возрасте, чаще в возрасте 8-10 лет. Диагноз подтверждают при проведении теста с ФН, при котором индуцируются типичные эпизоды двунаправленной ЖТ. Заболевание связано с мутациями в гене рианодинового рецептора, контролирующего высвобождение ионов кальция в кардиомиоцитах и обеспечивающего процесс сопряжения возбуждения/сокращения. Мутации в данном гене обнаруживают примерно в 65% случаев заболевания. Более редкая причина - мутации в гене кальсеквестрина и тиадина - белков, также участвующих в обеспечении кальциевого гомеостаза клетки. Поскольку ген рианодинового рецептора - один из самых больших в геноме человека, генетическая диагностика данного заболевания крайне трудна и дорогостояща. Однако, учитывая крайне высокий риск ВСС при данной патологии и тот факт, что в покое все носители причинных мутаций имеют нормальную картину ЭКГ, генетический скрининг - единственный надежный способ подтвердить или опровергнуть наличие заболевания у членов семьи пробанда. Генетическое подтверждение диагноза определяет обязательное назначение терапии β- адреноблокаторами у носителей мутации, а также позволяет снять вопрос о риске ВСС для членов семьи, не имеющих патологического генотипа, что имеет важное психологическое значение. В связи с этим в настоящее время генетическая диагностика показана всем лицам с подозрением на катехолзависимую ЖТ, а в случае выявления генетического дефекта - всем родственникам пробанда.
В отличии от катехолзависимой ЖТ при синдроме Бругада частота выявления генетических дефектов составляет не более 30%. В большинстве случаев в качестве причинного генетического дефекта обнаруживаются мутации в гене натриевого канала; в этом случае заболевание часто сопровождается нарушениями АВ-проводимости. Однако в течение последних несколько лет описано множество новых генетических причин синдрома Бругада, каждая из которых обусловливает развитие только 1-3% случаев заболевания. Таким образом, большинство генетических причин развития синдрома Бругада остается неизвестным. Генетическая диагностика не обязательна для постановки диагноза на основании клинических и ЭКГ-критериев. Прогностическое значение для описанных генетических дефектов также не определено. Генетическое тестирование, таким образом, показано только в случаях синдрома Бругада 1-го типа с клинической картиной заболевания и не показано при изолированном ЭКГ феномене 2-го и 3-го типов. При проведении каскадного семейного скрининга и обнаружении генетического дефекта у родственников пробанда им могут быть даны рекомендации избегать значительных подъемов температуры путем приема антипиретиков, определены
показания к регулярному клиническому наблюдению и противопоказания к приему блокаторов натриевых каналов.
Молекулярно-генетическая диагностика при гипертрофической кардиомиопатии
Воснове развития ГКМП чаще всего лежат мутации генов, кодирующих различные белки структуры саркомера - основной сократительной единицы кардиомиоцитов. В связи с развитием ГКМП идентифицированы более 15 генов, и генетический скрининг на 8 наиболее частых из них дает возможность определить причину заболевания примерно в 60% случаев. Однако генетический анализ не обязателен для постановки данного диагноза, который должен основываться исключительно на клинической картине заболевания, данных анамнеза и инструментального обследования. Убедительные данные о стойких корреляциях между генотипом и фенотипом, которые могли бы иметь клиническое значение в случае ГКМП, пока отсутствуют. В некоторых случаях определение причинного генетического дефекта может иметь прогностическое значение. В связи с большой распространенностью данного заболевания (1:2000) около 5-7% случаев ГКМП связаны с наличием двойных и даже тройных генетических дефектов.
Впоследнем случае заболевание имеет более ранний дебют, больший риск развития ВСС и систолической дисфункции, требующей проведения трансплантации сердца (ТС). В связи с этим носители данных генетических дефектов должны рассматриваться как пациенты высокого риска, несмотря на отсутствие других общепризнанных ФР при ГКМП. Известно также, что при мутациях в гене тропонина Т, несмотря на слабовыраженную гипертрофию миокарда, значителен риск развития желудочковой ВСС.
Таким образом, проведение генетического тестирования может быть показано больным с клинически подтвержденным диагнозом ГКМП при условии, если информация об идентифицированном генетическом дефекте может быть полезна для других членов семьи, решения вопроса о причинах развития случаев ВСС в семье или с целью идентификации группы амбулаторного наблюдения. При ГКМП генетическая диагностика не должна использоваться для подтверждения диагноза в случае сомнительных клинических признаков, а также у больных, не имеющих родственников, заинтересованных в результатах генетического анализа.
Молекулярно-генетическая диагностика при аритмогенной кардиомиопатии
Аритмогенная КМП - заболевание исключительно генетической природы с различной степенью пенетрантности и большой внутрисемейной вариабельностью клинической картины. В основе развития аритмогенной КМП лежат мутации генов, кодирующих белки десмосом - межклеточных контактов кардиомиоцитов. Число генов, ассоциированных с развитием данного заболевания, растет, в связи с чем генетический скрининг причинных мутаций трудоемкий и дорогостоящий.
Частота выявления причинных мутаций при исследовании четырех наиболее частых генов (PKP2, DSG2, DSP, DSC2) составляет приблизительно 50%, при этом наиболее часто обнаруживаются мутации в гене PKP2. Однако интерпретация данных генетического анализа при аритмогенной КМП труднее, чем это может показаться на первый взгляд. Вопервых, в 10-12% случаев причиной развития заболевания могут быть сочетанные мутации в нескольких генах, что диктует необходимость продолжать поиск других генетических дефектов даже при верификации одного. Во-вторых, многие из ранее описанных вариантов, ассоциированных с развитием заболевания, в небольшом проценте определяют и у здоровых лиц, что затрудняет трактовку этих генетических
