
- •8.1. Принципы метаболизма и биоэнергетики
- •8.2. Высокоэнергетические биомолекулы. Структура атф и её роль в энергетическом обмене.
- •8.3. Роль кислорода в метаболизме. Дыхательная цепь. Окислсительное фосфорилирование.
- •8.3.1. Способы синтеза атф
- •8.3.2. Окислительное фосфорилирование.
- •8.3.3. Дыхательная цеп или цепь переноса электронов
- •8.3.4. Стандартные окислительно-восстановительные потенциалы
- •8.4. Организация дыхательной цепи транспорта электронов клеток эукариот
- •8.4.1 Структура митохондрий
- •8.4.2 Компоненты электрон-транспортной цепи
- •5. Белки, содержащие негемовое железо
- •8.4.3. Комплексы окислительного фосфорилирования
- •8.4.3.1. Механизм работы электронтранспортной цепи
8.4. Организация дыхательной цепи транспорта электронов клеток эукариот
В клетках эукариот дыхательная цепь локализована во внутренней мембране митохондрий.
8.4.1 Структура митохондрий
Митохондрии - это органеллы размером с бактерию (около 1 х 2 мкм). Обычно в клетке содержится около 2000 митохондрий, общий объем которых составляет до 25% от общего объема клетки (рис. 8.2):
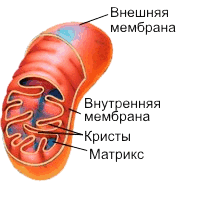
Рис. 8.2. Схема строения митохондрии в разрезе
Митохондрия ограничена двумя мембранами - гладкой внешней и складчатой внутренней, имеющей очень большую поверхность. Складки внутренней мембраны глубоко входят в матрикс митохондрий, образуя поперечный перегородки - кристы. Пространство между внешней и внутренней мембраной носит название межмембранного пространства.
Внутренняя мембрана митохондрий характеризуется необычно высоким содержанием белков (75%). В их число входят транспортные белки-переносчики, ферменты, компоненты дыхательной цепи и АТФ-синтаза.
8.4.2 Компоненты электрон-транспортной цепи
Компонентами электрон-транспортной цепи являются сложные ферменты и простые белки переносчики.
В переносе электронов от субстратов к молекулярному кислороду принимают участие:
1. НАД - зависимые дегидрогеназы;
2. ФАД- зависимые дегидрогеназы;
3. Убихинон (КоQ);
4. Цитохромы b, c, a+a3 ;
5. Белки, содержащие негемовое железо
НАД-зависимые дегидрогеназы. В качестве кофермента содержат НАД и НАДФ. Пиридиновое кольцо никотинамида способно присоединять электроны и протоны водорода.
ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 (ФАД).
Убихинон или коэнзим Q (КоQ) играет роль промежуточного переносчика водородных атомов, т. е. электронов и протонов в митохондриальной мембране, окисляя восстановленную форму флавиновых ферментов и превращается при этом в гидрохинон КоQ∙H2 (рис. 8.3):
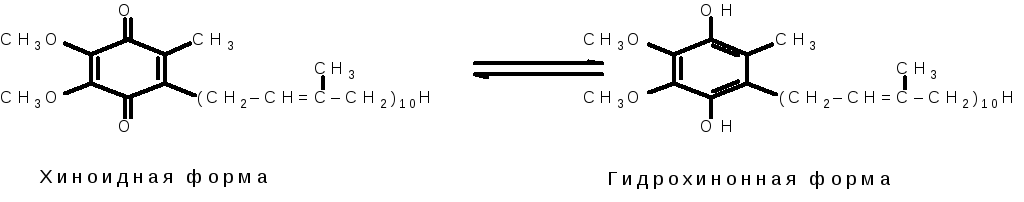
Рис. 8.3. Строение убихинона коэнзимаQ(КоQ)
Цитохромы - белки хромопротеиды, способные присоединять электроны, благодаря наличию в своем составе в качестве простетических групп железопорфиринов.
Они принимают электрон от вещества, являющегося немного боле сильным восстановителем, и передают его более сильному окислителю.
Цитохромы разделяют на подгруппы а, b и с. К двум последним группам относят цитохромы, содержащие обычный гем (рис 8.4)
Цитохромы располагаются в митохондриальной цепи между убихиноном и кислородом. При этом цитохромы включаются в дыхательную цепь в определенной последовательности:
Цит. b → Цит. c1 → Цит. c → Цит. aa3
Цитохромы b, c и c1 выполняют функцию промежуточных переносчиков электроновю
Комплекс цитохромов a и a1, называемый цитохромоксидазой, является терминальным дыхательным ферментом, непосредственно взаимодействующим с кислородом.

Рис. 8.4 Строение гема, входящего в состав цитохромов b и с
!!! В отличии от гема гемолгобина атом железа в цитохромах может обратимо переходить из двух в трехвалентное состояние это обеспечивает транспорт электронов.
Белки, содержащие негемовое железо. В этих белках атомы железа связаны с атомами серы цистеиновых остатков или прямо с атомами серы S2-, поэтому их часто называют железосерными белками и обозначают как Fe-S (рис. 8.5):
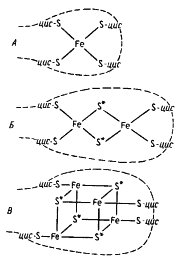
Рис. 8.5. Структура белков, содержащих негемовое железо (Fe-S-белки)
