
fiz
.pdf
термодинамики в этом случае сформулируем так: изменение внутренней энергии термодинамической системы равно сумме количества теплоты, переданной ей извне, и работы, совершенной над этой системой внешними силами:
U Q A1 |
или |
U2 U1 Q A1 |
(87.2) |
Первый закон термодинамики представляет собой наиболее общую формулировку закона сохранения энергии применительно к термодинамическим процессам.
Рассмотрим применение первого закона термодинамики (его еще называют первым началом термодинамики) к изопроцессам в идеальном газе.
1. Изотермический процесс
Пусть идеальному газу извне передано некоторое количество теплоты, причем передача его производилась очень медленно, так медленно, что изменением температуры газа за каждый малый промежуток времени можно было пренебречь и считать процесс передачи тепла изотермическим. Согласно формуле (86.2), определяющей изменение внутренней энергии одноатомного газа,
U 32 Mm R T
Если процесс в газе изотермический, т. е. температура газа постоянна, значит, ее изменение равно нулю. Но тогда и изменение внутренней энергии тоже равно нулю. В этом случае формула (87.1) примет вид:
Q A |
при U 0 . |
|
|
Применение первого закона термодинамики к изотермическому процессу: при изотермическом процессе все количество теплоты, переданное газу извне, расходуется на совершение им работы против внешних сил.
2. Изохорный процесс
Пусть газ находится в закрытом сосуде, через теплопроводящие стенки которого ему передают некоторое количество теплоты Q . Поскольку объем газа будет оставаться постоянным, то процесс его
нагревания будет изохорным. Раз объем газа не изменяется, значит, его изменение равно нулю и работа газом совершаться не будет (см. п. 85). Тогда формула (87.1) примет вид:
Q U |
при A 0 . |
|
|
Применение первого закона термодинамики к изохорному процессу: при изохорном процессе все тепло, переданное газу извне, расходуется на увеличение его внутренней энергии. При этом газ нагревается. И наоборот, если газ изохорно отдает во внешнюю среду некоторое количество теплоты, то его внутренняя энергия уменьшается и он охлаждается.
3. Изобарный процесс
Пусть газ, получив извне некоторое количество теплоты, нагрелся и изобарно расширился. При этом его внутренняя энергия увеличилась и он совершил работу против внешних сил. Поэтому применительно к изобарному процессу формула (87.1) будет записана полностью:
Q U A
Применение первого закона термодинамики к изобарному процессу: при изобарном процессе все тепло, полученное газом извне, расходуется как на изменение его внутренней энергии, так и на совершение им работы против внешних сил.
Следовательно, если некоторую массу газа нагреть под постоянным давлением (изобарно), например на 1 К, то этому газу надо сообщить больше теплоты, чем при изохорном нагревании тоже на 1 К, поскольку при изохорном нагревании тепло пойдет только на изменение внутренней энергии этого газа, а при изобарном – не только на изменение внутренней энергии, но и на совершение им работы против внешних сил. Поэтому у одного и того же газа удельная теплоемкость при постоянном объеме cV
меньше удельной теплоемкости при постоянном давлении cp .

Открытие первого закона термодинамики положило конец мечтам о «вечном» двигателе первого рода – устройстве, которое совершало бы работу только за счет своей внутренней энергии без притока энергии извне бесконечно долго. Такое устройство невозможно, поскольку запас внутренней энергии любой термодинамической системы ограничен, и как только он иссякнет, то согласно первому закону термодинамики и работа системы прекратится.
88. АДИАБАТНЫЙ ПРОЦЕСС
Пусть газ находится в сосуде с теплоизолированными стенками, через которые тепло не может проникать ни наружу, ни внутрь. Но эти стенки могут растягиваться, т. е. объем газа, как и его давление, и температура, могут изменяться. При этих условиях процесс, протекающий в газе, называется
адиабатным.
Адиабатным называется процесс, протекающий в термодинамической системе без теплообмена с внешней средой.
Поскольку при адиабатном процессе термодинамическая система не получает и не отдает тепло, то количество теплоты в формуле (87.1) равно нулю, поэтому применительно к адиабатному процессу первый закон термодинамики примет вид:
при Q 0 |
0 U A |
или |
U A |
Применение первого закона термодинамики к адиабатному процессу: при адиабатном процессе изменение внутренней энергии термодинамической системы равно работе системы, взятой со знаком «минус».
При адиабатном процессе работа термодинамической системы против внешних сил может совершаться только за счет запаса внутренней энергии самой системы, поэтому при совершении работы внутренняя энергия системы уменьшается и ее температура понижается. И наоборот, если внешние силы адиабатно совершают над термодинамической системой работу, то ее внутренняя энергия увеличивается и температура повышается. Значит, если внешние силы совершают отрицательную работу, например сжимая газ, то его внутренняя энергия увеличивается, т. е. ее изменение положительно, а если, наоборот, газ, расширяясь, совершает положительную работу против внешних сил, то его внутренняя энергия уменьшается, т. е. ее изменение отрицательно. Поэтому в последнем равенстве стоит знак «минус».
Подчеркнем еще раз: при адиабатном сжатии газа его внутренняя энергия увеличивается и, согласно формуле,
U 32 Mm R T
температура газа повышается, т. е. он нагревается. И наоборот, при адиабатном расширении газа его внутренняя энергия уменьшается и, согласно той же формуле, температура понижается, т. е. газ охлаждается.
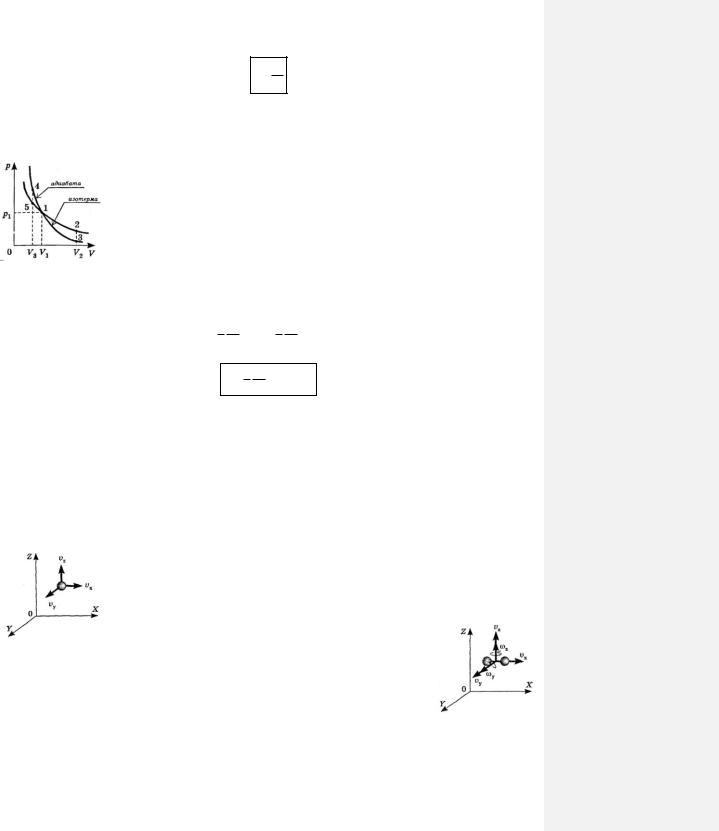
Уравнение адиабатного процесса в идеальном газе похоже на уравнение изотермического процесса (закон Бойля-Мариотта), только в уравнении адиабатного процесса при объеме газа V имеется показатель степени у, а в законе Бойля-Мариотта объем записывается в первой степени:
p1V1 p2V2
– уравнение адиабатного процесса (уравнение Пуассона), p1V1 p2V2
– уравнение изотермического процесса.
Поэтому на графике в координатах p V адиабата изображается кривой, которая идет круче гиперболы – изотермы (рис. 88-1).
Показатель степени в уравнении адиабаты называется коэффициентом Пуассона в честь
французского физика Пуассона, который первым исследовал адиабатный процесс и записал его уравнение. Коэффициент Пуассона равен отношению удельной теплоемкости идеального газа при постоянном давлении cp к удельной теплоемкости этого газа при постоянном объеме cV :
cp cV
Процесс в реальном газе можно считать адиабатным, если он протекает очень быстро, столь быстро, что газ не успевает обменяться теплом с внешней средой. Примером такого процесса может служить процесс истечения отработанного газа из сопла ракеты, который резко расширяется и при этом сильно охлаждается.
|
Предоставим газу возможность расширяться из некоторого состояния с |
|
|
параметрами p1V1 , до объема V2 в первый раз изотермически, т. е. очень медленно |
|
|
(кривая 2-2, рис. 88-1), а во второй раз – адиабатно, т. е. очень быстро (кривая 1-3, |
|
|
рис. 88-1). Поскольку работа расширения газа определяется в первом случае |
|
|
площадью фигуры 1 2 V2 |
V1 , а во втором – площадью фигуры 1 3 V2 V1 и |
|
эта площадь во втором случае меньше, чем в первом, значит, при одинаковом |
|
|
изменении объема газа работа его изотермического расширения больше работы |
|
|
адиабатного расширения. |
|
Рис. 88-1 |
Работа адиабатного |
расширения газа согласно первому закону |
|
||
термодинамики равна:
A U ,
где изменение внутренней энергии идеального одноатомного газа равно:U 32 Mm R T 32 Mm R T2 T1 .
Тогда формула работы адиабатного изменения объема идеального одноатомного газа будет:
A 32 Mm R T1 T2
При адиабатном сжатии газа совершается большая работа, чем при изотермическом, поскольку при адиабатном сжатии внешние силы затрачивают энергию не только на уменьшение объема газа, но и на его нагревание, а при изотермическом – только на уменьшение объема. Поэтому при адиабатном сжатии
давление растет быстрее, чем при изотермическом. На рис. 88-1 площадь фигуры |
1 4 V3 V1 , равная |
работе адиабатного сжатия, больше площади фигуры 1 5 V3 V1 , численно |
равной работе при |
изотермическом сжатии. Как видно из этого же графика, при расширении газа все наоборот.
89. ЧИСЛО СТЕПЕНИ СВОБОДЫ МОЛЕКУЛ. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА С i СТЕПЕНЯМИ СВОБОДЫ МОЛЕКУЛ
свободы молекулы называют любое независимое движение, которое она может совершить. Число таких независимых движений называют числом степеней свободы молекулы и обозначают буквой i.
Одноатомная молекула (например, молекула инертного газа) в декартовой системе координат OX, OY и OZ может двигаться вдоль трех осей координат, и ее скорость можно разложить на три проекции x , y и z (рис. 89-1). Если же она
движется под углом к осям координат, то любой вектор ее скорости все равно можно разложить на эти три проекции. Любое движение одноатомной молекулы можно
рассматривать согласно принципу суперпозиции как одновременное и независимое движение вдоль трех осей координат. Следовательно, одноатомная молекула обладает тремя степенями свободы, т. е. у нее i= 3. Положение одноатомной молекулы в пространстве может быть обозначено тремя координатами x, y и z.
Двухатомную молекулу (например, молекулу кислорода, водорода, азота и др.) можно изобразить в виде маленькой гантели (рис. 89-2). Такая молекула, кроме трех поступательных
движений вдоль осей координат, может двигаться еще и вращательно вокруг двух взаимно

перпендикулярных осей, которые перпендикулярны оси самой гантели. Следовательно, положение двухатомной молекулы в пространстве может быть обозначено тремя координатами x, y и z, и двумя углами ее поворота вокруг этих осей. Такая молекула обладает тремя проекциями скорости x , y и z
на оси координат OX, OY и OZ, а также двумя проекциями угловой скорости на эти оси y и z . Таким
образом, двухатомная молекула имеет пять степеней свободы: три поступательных и две вращательных, т. е. у нее i= 5.
Многоатомная молекула, т. е. молекула, состоящая из трех или более атомов (например, молекула углекислого газа), обладает на одну степень свободы больше, чем двухатомная, так как может вращаться вокруг всех трех осей (рис. 89-3), тогда как вращением двухатомной молекулы вокруг оси, совпадающей с осью «гантели», можно пренебречь. Следовательно,
многоатомная молекула имеет шесть степеней свободы: три поступательных и три вращательных, т. е. у нее i= 6.
Рис. 89-3 Кроме поступательных и вращательных степеней свободы, многоатомные молекулы могут обладать еще и колебательной степенью свободы, т. е.
колебаться около положения равновесия, особенно при высоких температурах.
Все степени свободы, молекул равноправны в том смысле, что на каждую из них приходится одинаковая часть всей энергии молекулы. Это утверждение называют законом равного распределения энергии по степеням свободы молекул.
Ранее было показано, что молекула идеального одноатомного газа обладает энергией
EK 32 kT ,
где k – постоянная Больцмана, а T – абсолютная температура газа. Поскольку она имеет три степени свободы и на каждую степень свободы приходится одинаковая часть кинетической энергии молекулы, то на одну степень свободы молекулы будет приходиться треть всей кинетической энергии:
E1степ. 32 kT : 3 12 kT .
Если молекула имеет i степеней свободы, то её кинетическая энергия EKi равна произведению
кинетической энергии, приходящейся на одну степень свободы, на число степеней свободы i этой молекулы:
|
|
|
|
|
|
|
|
|
|
|
1 |
kT . |
E |
Ki |
iE |
|
или |
E |
Ki |
||||||
|
|
|||||||||||
|
|
|
1степ. |
|
|
|
2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
Пусть идеальный газ состоит из |
|
N молекул. Тогда |
его внутренняя энергия U равная сумме |
|||||||||
кинетических энергий этих молекул, может быть определенна произведением энергии одной молекулы EKi на их число N :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
U |
1 |
kTN . |
|
|
|||||
|
|
|
|
U |
E |
Ki |
N |
|
или |
|
|
||||||||||||
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Поскольку |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
N vN A , |
|
|
|
|
|
||||||||||
где v |
m |
– число молей газа, m – его масса, M – молярная масса и N |
|
– число Авогадро, то |
|||||||||||||||||||
M |
A |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
N |
i |
kT |
m |
N A . |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
M |
|
|
|
|
|
||||||
Здесь |
k |
R |
, R – молярная газовая постоянная. С учетом этого запишем: |
||||||||||||||||||||
|
|||||||||||||||||||||||
|
|
|
N A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
U |
i |
|
|
|
R |
T |
m |
N |
|
|
|
|
(89.1) |
||||
|
|
|
|
|
|
|
|
|
|
|
|
A |
|
||||||||||
|
|
|
|
|
|
|
|
2 NA |
|
M |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Уравнение (89.1) определяет внутреннюю энергию идеального газа с i степенями свободы.

90. ЭЛЕМЕНТЫ КЛАССИЧЕСКОЙ ТЕОРИИ ТЕПЛОЕМКОСТИ И ЕЁ НЕДОСТАТКИ
Классической теорией теплоемкости называют теорию, согласно которой молярные теплоемкости газов при постоянном давлении C p и при постоянном объеме CV не зависят от их химического состава
и температуры.
Покажем, почему это так. Для этого обратимся к формуле внутренней энергии (89.1). Если газ с i степенями свободы молекул нагреть на T кельвин, то изменение его внутренней энергии U станет равно:
U |
i |
vR T |
(90.1) |
|
|||
2 |
|
|
|
С другой стороны, если газ нагреть изохорно, то переданное ему количество теплоты Q будет равно изменению его внутренней энергии U , поскольку работа расширения газа будет равна нулю:
|
|
|
Q U , |
|
|
|
|
||
где из определения молярной теплоемкости C |
Q |
следует, что |
|
|
|
||||
|
|
|
|
||||||
|
|
V |
|
v T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
U Q CV v T . |
|
|
|
(90.2) |
|||
Приравняем правые части выражений (90.1) и (90.2): |
|
|
|
|
|||||
|
i |
vR T C v T , откуда |
C |
i |
R |
(90.3) |
|||
|
|
|
|||||||
2 |
V |
|
|
|
V |
2 |
|
|
|
|
|
|
|
|
|
|
|||
Выражение (90.3) свидетельствует о том, что молекулярная теплоемкость идеального газа не зависит от его химического состава и температуры, а зависит только от числа степеней свободы его молекул, т. е. от числа атомов в молекуле данного газа.
Покажем, что это утверждение справедливо не только для молярной теплоемкости при постоянном объеме CV , но и применительно к молярной теплоемкости газов при постоянном давлении C p . Для этого
сначала установим связь C p с CV применительно к идеальному газу. Пусть газ нагревается изобарно наT . Тогда переданное ему количество теплоты Q в соответствии с формулой молярной теплоемкости
(84.7) равно: |
|
|
|
|
Q Cpv T |
|
|
|
(90.4) |
При этом работа A , совершаемая газом, согласно (85.1) равна: |
|
|
|
|
A vR T |
|
|
|
(90.5) |
При изохорном нагревании, так как A 0 , то Q U CV v T согласно (90.2). |
|
|||
Подставим (90.2), (90.4) и (90.5) в первый закон термодинамики Q U A : |
|
|||
|
|
|
|
|
Cpv T CV v T vR T , откуда |
Cp CV |
R |
|
(90.6) |
|
|
|
|
|
Уравнение (90.6) называют уравнением Роберта Майера в честь немецкого врача, который одним из первых сформулировал закон сохранения и превращения энергии применительно к тепловым процессам.
|
Уравнение Р. Майера: молярная теплоемкость идеального газа при постоянном давлении равна |
||||||||||||
сумме молярной теплоемкости этого газа при постоянном объеме и молярной газовой постоянной. |
|
||||||||||||
|
Теперь покажем, что и молярная теплоемкость идеального газа при постоянном давлении тоже |
||||||||||||
зависит только от числа степеней свободы молекул этого газа. Поскольку C |
|
C R |
и C |
i |
|
R , то |
|||||||
p |
|
||||||||||||
|
|
|
|
|
|
|
|
V |
V |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
i |
|
|
|
|
|
|
|
|||
Cp |
|
|
R R R |
|
1 или |
|
|
|
|
|
|
||
2 |
|
|
|
|
|
|
|
||||||
|
|
2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
Cp |
i 2 |
R |
|
|
|
|
|
(90.7) |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
Следовательно, и молярная теплоемкость идеального газа при постоянном давлении согласно классической теории теплоемкости не зависит от его химического состава и температуры, а зависит

только от числа степеней свободы молекул, которое в свою очередь зависит от числа атомов в этих молекулах.
Вспомним, что коэффициент Пуассона |
равен отношению удельных теплоемкостей cp |
к cV . Но |
|||||||||||||||||||
согласно формуле (84.10) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
c |
|
|
Cp |
и c |
|
|
CV |
. |
|
|
|
||||
|
|
|
|
|
|
|
p |
|
M |
|
|
V |
|
M |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Тогда |
cp |
|
Cp M |
|
Cp |
или с учетом (90.3) и (90.7): |
|
||||||||||||||
|
|
|
|
||||||||||||||||||
|
cV |
|
MCV |
CV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
i 2 R , |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
i 2 |
|
|
(90.8) |
|||||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
2 |
i |
|
R |
|
|
|
i |
|
|
||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
||
Таким образом, величина коэффициента Пуассона тоже зависит только от числа атомов в молекулах данного газа.
Коэффициент Пуассона несложно определить опытным путем. Подобную лабораторную работу легко выполняют первокурсники любого технического вуза. Определив , можно установить и число
степеней свободы молекул исследуемого газа, т. е. ответить на важный вопрос: сколько атомов содержат его молекулы. Действительно, у одноатомного газа i= 3 и, значит, у него
|
3 2 |
|
5 |
1,67 ; |
||
3 |
3 |
|||||
|
|
|
|
|||
у двухатомного газа i= 5 и у него |
|
|
|
|
|
|
|
5 2 |
|
|
7 |
1, 40 ; |
|
3 |
|
3 |
||||
|
|
|
|
|||
у многоатомного газа i= 6 и у него |
|
|
|
|
|
|
|
6 2 |
|
8 |
1,33 . |
||
3 |
3 |
|||||
|
|
|
|
|||
Таким образом, согласно классической теории теплоемкости молярная или удельная теплоемкость данного идеального газа является постоянной величиной. Однако опыт показывает, что этот вывод не при любых температурах газов соответствует действительности. Например, согласно расчетам молярная теплоемкость двухатомного водорода должна быть равна:
CV |
|
i |
R |
5 |
8,31 |
Дж |
|
20,78 Дж моль К |
2 |
2 |
моль |
|
|||||
|
|
|
|
К |
||||
и не должна зависеть от температуры. Но опыт показывает, что при низких температурах молярная теплоемкость водорода примерно равна молярной теплоемкости одноатомного газа, а при высоких – многоатомного. Подобные отклонения от классической теории теплоемкости наблюдаются и в экспериментах с другими газами.
Несоответствие классической теории и эксперимента имеют место не только при определении теплоемкостей газов, но также и кристаллических тел. Согласно этой теории тепловое движение частиц в узлах кристаллических решеток в основном сводится к их колебаниям около положения равновесия. Эти частицы в отличие от молекул идеального газа обладают не только кинетической, но и потенциальной
энергией. Колебательное движение связано с наличием у данной частицы кинетической энергии 12 kT и
потенциальной энергии 12 kT , поэтому на каждую степень свободы частицы кристалла приходится энергия 12 kT 12 kT kT . А так как частица в узле кристаллической решетки может колебаться вдоль

трех осей координат, значит, ей следует приписать три колебательных степени свободы. Тогда каждая частица (молекула, атом, ион), из которых состоит кристаллическое тело, должна обладать энергией 3kT .
Молярная теплоемкость кристалла определяется отношением количества теплоты, сообщенного одному молю кристаллического вещества при нагревании и равного приращению его внутренней энергииU , к изменению его температуры T , ведь работа расширения кристалла близка к нулю:
CV |
U |
(90.9) |
|
T |
|||
|
|
Если имеется 1 моль кристаллического вещества, то его внутренняя энергия равна произведению числа частиц в одном моле, т. е. числа Авогадро N A , на энергию одной частицы, которая, как показано
выше, равна 3kT , поэтому внутренняя энергия 1 моля кристаллического вещества U 3kNAT . Поскольку kN A R , то U моль 3RT и
|
|
|
U 3R T |
(90.10) |
Подставив (90.10) в (90.9), получим: |
|
|
||
C |
3R T |
3R |
C 3R – закон Дюлонга и Пти. |
|
|
|
|||
V |
T |
|
V |
|
|
|
|
|
|
Таким образом, молярная теплоемкость всех кристаллов согласно классической теории теплоемкостей должна быть одинакова и равна утроенной универсальной газовой постоянной:
CV 3R 3.8,31 Дж моль К .
моль К .
Это утверждение называют законом Дюлонга и Пти, и оно хорошо выполняется применительно ко многим кристаллическим веществам при температурах, близких к комнатной. Однако при анализе экспериментальных данных, полученных в опытах с металлами и кристаллическими диэлектриками, наблюдаются отклонения от выводов классической теории теплоемкости кристаллов. Так, согласно классической теории, молярная теплоемкость металлов должна быть больше молярной теплоемкости кристаллических диэлектриков, потому что у металлов, кроме положительных ионов в узлах кристаллической решетки, имеются еще и свободные электроны, беспорядочно движущиеся внутри кристаллической решетки подобно частицам одноатомного газа. Из-за этого тепло, получаемое металлом при нагревании, должно расходоваться не только на усиление тепловых колебаний ионов решетки, но и на увеличение кинетической энергии свободных электронов. А у диэлектриков свободных электронов нет, поэтому передаваемое им тепло должно идти только на увеличение энергии ионов решетки, значит, их теплоемкость должна быть значительно меньше теплоемкости металлов. Однако опыт показывает, что молярная теплоемкость большинства кристаллических диэлектриков примерно такая же, как и молярная теплоемкость металлов. Эти расхождения теории и эксперимента свидетельствуют о том, что выводы классической теории теплоемкости веществ являются приближенными. Более строгой является квантовая теория тепловых свойств веществ, законы которой вы будете изучать в высшей школе.
91. НЕОБРАТИМОСТЬ ТЕПЛОВЫХ ПРОЦЕССОВ. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ И ЕГО СТАТИСТИЧЕСКИЙ СМЫСЛ
В термодинамике любую группу тел или частиц называют термодинамической системой. Если на термодинамическую систему не действуют внешние силы, то она самопроизвольно переходит в состояние теплового равновесия – состояние, при котором все ее термодинамические параметры: давление, объем, температура с течением времени будут оставаться постоянными.
При выводе термодинамической системы из равновесного состояния вследствие изменения одного или нескольких параметров она станет переходить через ряд промежуточных состояний, пока не перейдет в новое состояние с новыми параметрами. Такой переход называется термодинамическим процессом. Например, на рис. 91-1 система совершает термодинамический процесс перехода из состояния 1 с параметрами p1V1 и в состояние 5 с параметрами p5V5 через
Рис. 91-1 |
промежуточные состояния 2, 3 и 4. |
|
При этом каждое промежуточное состояние характеризуется своими |
||
|
||
параметрами. |
|

Если термодинамическая система, претерпев ряд изменений, возвращается в исходное состояние с первоначальными параметрами, то такой процесс называется круговым (или замкнутым, или циклом).
Назовем самопроизвольным такой процесс, при котором в телах, окружающих термодинамическую систему, не происходит никаких изменений. Иными словами, самопроизвольный процесс – процесс, который протекает в термодинамической системе без внешнего воздействия.
Пусть график, изображенный на рис. 91-1, соответствует самопроизвольному переходу термодинамической системы – газа из состояния 1 в состояние 5. Это прямой процесс расширения. Если бы этот газ мог самопроизвольно совершить обратный процесс, вернувшись из состояния 5 в состояние 1, т. е. самостоятельно сжаться, то такой круговой процесс назывался бы обратимым.
Обратимым называется процесс, который может самопроизвольно протекать как в прямом, так и в обратном направлениях.
Но мы хорошо понимаем, что газ не может самопроизвольно вернуться в состояние 2, т. е. сжаться без воздействия внешних сил, ведь из-за хаотического движения молекул он стремится занять весь объем сосуда, в котором находится. И если объем сосуда под действием внешних сил не станет уменьшаться, то и газ сжиматься не будет.
Термодинамические процессы, которые не могут протекать самопроизвольно как в прямом, так и в обратном направлениях, называются необратимыми.
Рассмотрим подробнее, почему процесс расширения газа является необратимым, ведь его молекулы движутся хаотически и независимо друг от друга. Что им мешает собраться так, чтобы объем газа самопроизвольно уменьшился, ведь они не взаимодействуют на расстоянии?
Пусть в некотором сосуде, разделенном на две половины перегородкой с отверстием, находится только одна молекула (рис. 91-2), которая может свободно двигаться в любом направлении. Назовем вероятностью B того, что она окажется в какой-то одной половинке сосуда (левой или правой) отношение числа случаев достоверных, т. е. таких,
при которых это событие наступит, к числу всех возможных случаев этого события. Число достоверных событий, когда молекула может оказаться в какой-либо половине, равно единице, ведь в данный момент времени она может оказаться только или в левой, или в правой половине. А число всех возможных случаев ее расположения равно двум. Значит, вероятность того, что молекула находится в одной из половин сосуда, равна:
B 12 .
Несложно подсчитать, что для двух частиц вероятность того, что они одновременно окажутся в
одной половине |
сосуда |
B |
1 |
|
1 |
, для трех |
B |
1 |
|
1 |
и т. д. Следовательно, для n частиц эта |
||
4 |
22 |
8 |
23 |
||||||||||
|
|
|
|
|
|
|
|
|
|||||
вероятность B |
1 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
2n |
|
|
|
|
|
|
|
|
|
|
||
Если же в одной из половин этого сосуда находится газ, который состоит из статистически огромного числа молекул (например, объем одной половины этого сосуда равен 1 см3, а в нем, как известно, при нормальных условиях содержится 2,7∙1019 молекул воздуха – число Лошмидта), то число
возможных размещений молекул в этих половинах огромно (в нашем примере оно равно 22,7 1019 ), но событие, при котором они все располоясатся в одной половине всего одно, поэтому вероятность B того, что все они окажутся в одной половине, равна:
B |
1 |
0 . |
22,7 1019 |
Событие, вероятность которого равна нулю, невероятно, т. е. невозможно. Значит, все молекулы газа сами никогда не смогут одновременно оказаться в одной половине сосуда, т. е. газ самопроизвольно сжаться не может. По той же причине тепло не может самопроизвольно перейти от холодного тела к горячему, такой процесс невероятен, хотя прямой переход тепла от горячего тела к холодному реален. При трении прямой процесс перехода механической энергии во внутреннюю возможен, а обратный – нет.
Любые термодинамические процессы со статистически огромным количеством молекул и атомов могут самопроизвольно протекать только в одном направлении, т. е. они необратимы, поскольку
вероятность обратного процесса равна нулю. Это утверждение называется вторым законом (вторым началом) термодинамики. Вот некоторые другие его формулировки.
Второй закон термодинамики:
а) любые самопроизвольные процессы в термодинамической системе, состоящей из статистически огромного числа частиц, всегда переводят эту систему из менее вероятного состояния в более вероятное и никогда наоборот;
б) невозможен самопроизвольный процесс передачи тепла от тел, менее нагретых, телам, более нагретым;
в) невозможно изготовить вечный двигатель второго рода – устройство, в котором бы все тепло, полученное от нагревателя, полностью превращалось бы в механическую работу.
В этом состоит статистический смысл второго закона термодинамики.
92. ТЕПЛОВЫЕ ДВИГАТЕЛИ. КОЭФФИЦИЕНТ ПОЛЕЗНОГО ДЕЙСТВИЯ ТЕПЛОВЫХ ДВИГАТЕЛЕЙ И ЕГО МАКСИМАЛЬНАЯ ВЕЛИЧИНА. ПРИНЦИП ДЕЙСТВИЯ ДВИГАТЕЛЯ ВНУТРЕННЕГО СГОРАНИЯ
Тепловые двигатели – это устройства, в которых тепловая энергия превращается в механическую.
Тепловые двигатели разнообразны как по конструкции, так и по назначению. К ним относятся паровые машины, паровые турбины, двигатели внутреннего сгорания, реактивные двигатели. Однако, несмотря на многообразие, в принципе действия различных тепловых двигателей есть общее. Основными частями любого теплового двигателя являются: нагреватель, рабочее тело и холодильник. На рис. 92-1 изображена условная схема любого теплового двигателя.
Рис. 92-1 Нагреватель (паровой котел, горючая смесь, различные виды топлива) выделяет тепловую энергию Q1 , нагревая рабочее тело, которое находится в
рабочей камере двигателя. Рабочим телом может быть пар или газ. Получив количество теплоты Q1 , газ расширяется, поскольку его давление p1 больше внешнего давления (например, атмосферного), и перемещает поршень, совершая положительную работу. При этом его давление падает до p2 , а объем увеличивается от V1 до V2 (рис. 92-2).
|
Теперь, внимание! Если мы будем сжимать газ, проходя те же состояния, что и |
||
|
на участке 1–2 (рис. 92-2), но в обратном направлении, то совершим такую же по |
||
|
абсолютному значению, но отрицательную работу. В результате, вся работа за цикл |
||
|
будет равна нулю. Чтобы работа теплового двигателя была отлична от нуля, работа |
||
|
сжатия газа должна быть меньше работы расширения. На рис. 92-2 работа |
||
|
расширения равна площади |
фигуры 1 2 3 V3 |
V1 , а работа сжатия равна |
Рис. 92-2 |
площади фигуры 1 4 3 V3 |
V1 . Следовательно, |
работа за цикл равна площади |
фигуры 1–2–3–4–1.
Чтобы работа сжатия была меньше работы расширения, надо, чтобы процесс сжатия проходил при меньшей температуре, для чего рабочее тело (газ, пар) надо охладить, т. е. привести в соприкосновение с более холодным телом, которое называют холодильником. Им может являться окружающая тепловой двигатель среда. Холодильнику рабочее тело отдаст при соприкосновении с ним количество теплоты Q2 .
Поэтому работа A , совершенная двигателем, равна разности количества теплоты Q1 полученной от нагревателя, и количества теплоты Q2 , отданной холодильнику:
A Q1 Q2
Все тепловые двигатели работают циклично, т. е. тепловые процессы в них многократно повторяются.
Разные тепловые двигатели при одинаковом количестве теплоты, полученной от нагревателя рабочим веществом, могут совершать разную работу. Работоспособность разных двигателей при

одинаковых затратах тепловой энергии характеризуется их коэффициентом полезного действия (КПД
).
Коэффициентом полезного действия теплового двигателя называется отношение работы, совершенной этим двигателем, к количеству теплоты, полученному от нагревателя:
|
A |
100% |
или |
|
Q1 Q2 |
100% |
|
Q |
Q |
||||||
|
|
|
|
|
|||
|
1 |
|
|
1 |
|
||
Подчеркнем еще раз, что без холодильника ни один тепловой двигатель работать не может. Хоть и жалко отдавать задаром холодильнику немалую часть так нужной нам тепловой энергии, но без этого не обойтись. Это невеселое утверждение является прямым следствием второго закона термодинамики. Поэтому КПД любого теплового двигателя всегда меньше 100%, т. е. не только не может превысить 100%, но даже стать равным этой величине.
Давайте подумаем, каким термодинамическим процессам в газе должны соответствовать участки графика на рис. 92-2, чтобы КПД цикла был наибольшим. Для этого процесс расширения газа при передаче ему количества теплоты фх надо производить так, чтобы работа расширения была максимальна. Значит, этот процесс должен быть изотермическим, потому что именно при изотермическом процессе все тепло, переданное нагревателем рабочему телу, пойдет на совершение работы (см. применение первого закона термодинамики к изотермическому процессу). Итак, процесс расширения газа, которому соответствует участок 1-2 графика, должен быть изотермическим. Пусть он происходит при температуре T1 , где T1 – температура нагревателя.
Затем газ надо охладить до температуры T2 . Но при этом нельзя допустить соприкосновения
горячего газа с каким-либо холодным телом, потому что тогда часть внутренней энергии газа необратимо перейдет этому холодному телу, причем без совершения так нужной нам работы. Желательно также, чтобы процесс охлаждения газа происходил как можно быстрее и чтобы уменьшение его внутренней энергии все же сопровождалось совершением положительной работы. Такой процесс возможен – это адиабатный процесс, который протекает в условиях полной теплоизоляции и очень быстро. Следовательно, процесс охлаждения газа до температуры T2 при расширении, графиком которого
является участок 2-3, должен быть адиабатным.
Затем газ надо снова сжать, причем желательно опять изотермически, т. е. медленно, приведя его теперь в контакт с холодильником, имеющим такую же, как у газа, температуру T2 (участок 3-4), а после
этого сжать его опять адиабатно, увеличив внутреннюю энергию газа, т. е. повысив его температуру до T1
. Так газ вернется в исходное состояние, завершив цикл и совершив при этом работу, численно равную площади, ограниченной замкнутой кривой, соответствующей этому циклу.
Отметим, что весь цикл проведен нами так, что газ не соприкасался с другим телом, температура которого ниже его температуры, ведь даже с холодильником он соприкасался, имея уже температуру T1 ,
такую же, как и температура холодильника. Благодаря этому никакая часть тепла, полученного от нагревателя, не отдавалась холодному телу, поэтому КПД такого цикла максимален.
Вывод: круговой цикл, состоящий из двух изотерм и двух адиабат, соответствует максимальному КПД.
Французский инженер Сади Карно в 1824 г. вывел формулу максимального КПД идеального теплового двигателя, в котором рабочим телом являлся идеальный газ и цикл которого состоял из двух изотерм и двух адиабат – цикла Карно.
Формула КПД цикла Карно, т. е. максимального КПД теплового двигателя имеет вид:
max T1 T2 100%
T1
Здесь T1 – абсолютная температура нагревателя, T2 – абсолютная температура холодильника.
КПД любого реального теплового двигателя всегда меньше КПД цикла Карно такой же конструкции, потому что в реальном газе происходят тепловые потери из-за внутреннего трения (вязкости газа) и, кроме того, изотермический и адиабатный процессы ев чистом виде» неосуществимы, ведь процесс не
