
- •Лекция 1 Первый закон термодинамики. Термохимия
- •1.1 Основные понятия химической термодинамики
- •1.2. Первый закон термодинамики
- •Математическое выражение первого закона термодинамики для различных типов систем:
- •1.3. Термохимия
- •Лекция 2 Второй закон термодинамики. Биоэнергетика. План
- •2.1. Второй закон термодинамики. Энтропия
- •Теорема Карно:
- •Формулировки второго закона:
- •2.2. Свободная энергия Гиббса
- •Способы расчета dg
- •2.3. Биоэнергетика
- •Лекция 3 химическое равновесие План
- •3.1. Кинетическое и термодинамическое описание химического равновесия
- •3.2. Смещение химического равновесия (принцип Ле Шателье)
- •Частные случаи принципа Ле Шателье
- •3.3. Равновесие в биологических средах
- •Гидролиз соли, образованной слабым основанием и сильной кислотой
- •Гидролиз соли, образованной слабой кислотой и сильным основанием
- •Гидролиз соли, образованной слабым основанием и слабой кислотой
- •Лекция 4 Физико-химические свойства растворов План
- •4.1. Растворы и их классификация
- •4.2. Термодинамика растворения
- •4.3. Растворимость газов, жидкостей и твердых веществ в воде
- •Лекция 5 Коллигативные свойства растворов План
- •5.1. Первый закон Рауля
- •5.2. Эбулиоскопический закон Рауля
- •5.3. Криоскопический закон Рауля
- •5.4. Осмос. Осмотическое давление
- •Лекция 6 Растворы электролитов План
- •6.1. Теория электролитической диссоциации с. Аррениуса
- •6.2. Теории слабых и сильных электролитов
- •6.3. Электропроводность растворов электролитов
- •6.4. Роль электролитов в жизнедеятельности организма
- •Лекция 7 Кислотно-основное равновесие в растворах План
- •7.1. Кислотность водных растворов и биологических жидкостей
- •7.2. Буферные растворы
- •7.3. Буферные системы крови
- •Лекция 8 Электрохимия План
- •8.1. Термодинамика окислительно-восстановительных реакций
- •Типы окислительно-восстановительных реакций
- •8.2. Устройство и принцип действия гальванических элементов
- •8.3. Потенциометрические методы анализа
- •Лекция 9 Химическая кинетика
- •9.1. Понятие о скорости и механизме химических реакций
- •9.2. Кинетические уравнения простых и сложных реакций
- •26,6 Года
- •9.3. Влияние температуры на скорость химических реакций
- •Лекция 10 Кинетика ферментативных реакций План
- •10.1. Катализ и катализаторы.
- •10.2. Кинетика ферментативных реакций.
- •Лекция 11 Строение атома
- •11.1. Строение ядра. Изотопы
- •11.2. Квантово-механическая модель электронной оболочки атома
- •11.3. Физико-химические характеристики атомов
- •Лекция 12 Химическая связь
- •12.1. Химическая связь и ее типы
- •12.2. Ковалентная связь
- •12.2.1 Основные положения метода вс
- •Способы перекрывания ао
- •12.2.1 Основные положения метода мо.
- •Энергетическая диаграмма молекулы h2
- •Энергетическая диаграмма аниона h2-
- •Энергетическая диаграмма молекулы n2
- •12.3. Водородная связь
- •Водородных соединений от их молярной массы Примеры соединений с межмолекулярной водородной связью
- •1) Вода
- •Стабилизирующие (а) вторичную структуру белков,
- •Классификация лигандов по дентантности
- •Классификация комплексных соединений
- •1) По природе лигандов
- •2) По скорости образования комплексов:
- •Номенклатура комплексных соединений
- •13.2. Строение кс
- •Спектрохимический ряд лигандов
- •Увеличение энергии расщепления ∆
- •13.4. Биологическая роль кс
- •Лекция 14 Химия биогенных элементов план
- •14.1. Основы биогеохимии
- •6 Неметаллов-органогенов: c, o, h, n, p, s;
- •10 Биометаллов (металлов жизни): Na, k, Mg, Ca (s-элементы) и Fe, Co, Cu, Zn, Mn, Mo (d-элементы).
- •14.2. Химия s-элементов
- •14.3. Химия d-элементов
- •Радиусов d-элементов от их порядкового номера в периоде
- •14.4. Химия p-элементов
- •Лекция 15 Адсорбция на твердых адсорбентах План
- •15.1. Классификация твердых адсорбентов
- •Классификация твердых адсорбентов
- •15.2. Адсорбция на твердых адсорбентах
- •15.3 Адсорбционная терапия
- •15.4. Хроматография
- •Классификация хроматографических методов по доминирующему механизму
- •Лекция 16 Коллоидная химия План
- •Классификация дисперсных систем
- •Электролита AgNo3
- •Электролита кi
- •16.4. Физические свойства золей
- •16.5. Устойчивость коллоидных растворов. Коагуляция
- •Лекция 17 Растворы вмс план
- •Реакции полимеризации
- •Реакции поликонденсации
- •Классификация вмс
- •17.2. Набухание и растворение вмс
- •17.3. Полиэлектролиты
- •Полиамфолита
- •И других полиамфолитов
- •17.4. Коллоидная защита
- •Литература
- •Содержание
2.2. Свободная энергия Гиббса
При протекании химических процессов наблюдаются две противоположные тенденции: (а) стремление отдельных частиц соединится в более крупные агрегаты, что приводит к уменьшению запаса внутренней энергии системы (H → min); (б) стремление агрегатов к разделению на более мелкие частицы, что приводит к увеличению энтропии (S → max).
Обе тенденции находят свое отражение в термодинамической функции состояния, называемой свободной энергией Гиббса или изобарно-изотермическим потенциалом (G):
G = H – TS
DG = DH – TDS
Физический смысл свободной энергии Гиббса понятен из совместного рассмотрения первого и второго законов термодинамики:
Q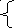 = ΔU
+ А΄
+ p·ΔV
= ΔU
+ А΄
+ p·ΔV
Q = T·ΔS
Отсюда
A' = T·DS – DU – p·DV = TDS – (DU + p·DV),
где DU + p·DV = DH
Следовательно, A' = – (DH – TDS), где DH – TDS = DG
Таким образом, A' = – DG
Соответственно, DG имеет смысл полезной работы, выполненной в системе или над системой. свободная энергия Гиббса (G) — это часть внутренней энергии системы, способная превращаться в полезную работу.
Знак ΔG (+ или –) является критерием возможности протекания самопроизвольных процессов в закрытых системах. Так, если процесс является самопроизвольным, то при его протекании совершается полезная работа (A′ >0); соответственно ∆G < 0. В состоянии термодинамического равновесия полезная работа не выполняется (A′ = 0), следовательно, ∆G = 0.
В ходе несамопроизвольного процесса работа выполняется над системой (A′ < 0), соответственно ∆G > 0. Таким образом, самопроизвольно осуществляются те процессы, протекание которых сопровождается уменьшением свободной энергии Гиббса.
Характер процесса иногда можно изменять, варьируя термодинамические параметры системы: температуру, давление или концентрацию реагирующих веществ (таблица 2).
Таблица 2 — Влияние температуры на характер процесса
|
H |
S |
G |
Условия протекания самопроизвольного процесса |
|
– |
+ |
– |
Реакция протекает самопроизвольно при любой температуре |
|
– |
– |
|
Реакция протекает самопроизвольно при низкой температуре |
|
+ |
+ |
|
Реакция протекает самопроизвольно при высокой температуре |
|
+ |
– |
+ |
Реакция является несамопроизвольной при всех температурах |
Рассчитав ΔG, можно определить:
характер процесса (само- или несамопроизвольный);
величину полезной работы, совершаемой при протекании самопроизвольного процесса.
Способы расчета dg
Свободную энергию химической реакции можно рассчитать по уравнению:
ΔrG = ΔrH – ТΔrS,
где ТΔrS — энтропийный фактор химической реакции.
Свободную энергию химической реакции можно рассчитать на основе закона Гесса:
ΔrG = с·ΔfG (C) + d·ΔfG (D) – a·ΔfG (A) – b·ΔfG (B),
где ∆fG — свободная энергия образования сложного вещества из простых веществ, kДж/моль.
3. Расчет DG переноса вещества из одной фазы в другую выполняется по уравнению:
ΔrG
= – ν·R·T·ln
![]() ,
,
где ν — количество переносимого вещества, моль;
R — универсальная газовая постоянная, равная 8,31 Дж/моль∙К;
СМ1 и CМ2 — концентрации вещества в различных фазах, моль/л (СМ1<CМ2).
Данное уравнение можно использовать для расчета осмотической работы, выполняемой почкой.
