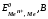Задача n 157
Составьте схему гальванического элемента, напишите электронные уравнения электродных процессов и суммарное уравнение соответствующей окислительно-восстановительной реакции. Вычислите концентрацию раствора электролита или ЭДС.
|
Номер задачи |
Ме-талл 1-го элек-трода |
Электролит 1-го электрода |
Концентрация электролита 1-го электрода, моль/л |
Ме-талл 2-го элек-трода |
Электролит 2-го электрода |
Концентрация электролита 2-го электрода, моль/л |
ЭДС, В |
|
157 |
Hg |
HgCl2 |
0,01 |
Al |
AlCl3 |
1,00 |
? |
Решение
Гальванический элемент - это электрохимическая система, в которой энергия окислительно-восстановительной реакции трансформируется в электрическую энергию, т.е. такая система служит в качестве химического источника тока.
Анодный процесс заключается в окислении металла, характеризующегося более отрицательной величиной электродного потенциала Е0, в катодном процессе участвует частица-окислитель, присутствующая в катодном электролите.
Для металлов, приведенных в условии задачи:
|
Электрод |
|
|
Al3+, Аl
|
-1,662
|
|
Нg2+, Нg
|
+0,854
|
Более отрицательной величиной электродного потенциала характеризуется металл Аl, поэтому именно он и будет участником анодного процесса.
Металл анода окисляется, что можно представить в виде электронного уравнения вида:
Ме0 - m e- = Mem+
Для данного металла:
Аl 0 - 3 e- = Аl 3+
Катодный процесс заключается в восстановлении катионов металла, входящих в состав соли – электролита катода.
Соответствующее электронное уравнение имеет вид:
Men+ + n e- = Me0
Для системы, описанной в условии задачи:
Нg2+ + 2e- = Нg 0
Электрохимическая схема - это условная запись, в которой представлена информация о аноде и катоде с указанием металлов, состава электролитов, а также особенностях конструкции данного
гальванического элемента:
Металл I | Электролит I || Электролит II | Металл II
(с более .. (с менее
отриц.Е0) отриц.Е0)
Анод катод
Для рассматриваемого в задаче гальванического элемента электрохимическая схема имеет вид:
Аl | AlCl3 || HgCl2| Нg
а н о д к а т о д
Чтобы вычислить ЭДС гальванического элемента, необходимо найти разность потенциалов катода и анода:
ЭДС = Е катода - Е анода
Каждый из указанных потенциалов можно вычислить по формуле Нернста:

где Е0 – стандартный электродный потенциал металла анода или катода, n - число электронов, отдаваемых восстановителем или принимаемых окислителем, С - концентрация электролита, моль/л.
Следовательно, ЭДС гальванического элемента может быть представлена следующей формулой:
ЭДС = (Е мет.
катода +
мет.
катода +
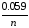 lg
Cэл-та
катода)
– (Е
lg
Cэл-та
катода)
– (Е мет.
анода +
мет.
анода +
 lgCэл-та
анода)
lgCэл-та
анода)
Подставляем численные данные условия задачи и производим необходимые вычисления:
Е мет.
катода = 0.854 В
мет.
катода = 0.854 В
Cэл-та катода = 1 моль/л
lg Cэл-та катода = 0
n =2 для катодного процесса)
Е мет.
анода = -1.662
В
мет.
анода = -1.662
В
Cэл-та анода = 0.01 моль/л
lgCэл-та анода = …….….
n = 3(для анодного процесса)
ЭДС
= (0.854+ 0) – (-1.662 +
 -2)
-2)
ЭДС = 2.549