
Актуальные вопросы современной гепатологии
.pdfУ большей части RIBA-положительных лиц вирус находится в состоянии репликации, что подтверждается выявлением у 75-80% из них HCV. Отсутствие РНК при наличии анти-HCV может быть обусловлено элиминацией вируса после перенесенной инфекции, уровнем виремии ниже порога чувствительности полимеразной цепной реакции либо ложноположительным результатом обнаружения антител. Отмечена связь между отсутствием РНК HCV у ан- ти-HCV-положительных больных и отсутствием воспалительных изменений в биоптатах печени, что является свидетельством элиминации вируса. Вирусная РНК может не выявляться у больных после курса противовирусной терапии, в таких случаях не исключено ее наличие в подпороговых титрах или персистенция вируса в тканях, делающая его недоступным для выявления. Следовательно, позитивных по анти-HCV лиц, даже при отсутствии признаков виремии, необходимо рассматривать как потенциально опасных в плане заражения гепатитом С.
Таблица 3
Рекомбинантные белки, используемые в тест-системах ELISA
и RIBA (Weiland O.,1994)
Методы |
Поколения |
Антигены |
Область HCV |
ELISA |
1-е |
C100 |
NS4 |
|
2-е |
C100 |
NS4 |
|
|
C22 |
core |
|
|
C33 |
NS3 |
|
3-е |
C100 |
NS4 |
|
|
C22 |
core |
|
|
C33 |
NS3 |
|
|
NS5 |
NS5 |
RIBA |
3-е |
C100-3 |
NS4 |
|
|
C33 |
NS3 |
|
|
C22-3 |
core |
|
|
NS5 |
NS5 |
В тест-системах первого, второго и третьего поколений в качестве антигенов использовались или рекомбинантные, или синтетические пептиды. В настоящее время можно выделить также тестсистемы четвертого поколения, в которых в качестве иммуносорбента используют сочетания рекомбинантных и синтетических пептидов.
31
Достижение высокой чувствительности иммуноферментных тест-систем 3 и 4 поколений сопряжено с некоторыми проблемами в обеспечении специфичности исследований, что в ряде случаев может приводить к появлению ложноположительных результатов. Например, проведение какой-либо иммунизации. Рекомендуемые в настоящее время меры по устранению этой проблемы:
А) повторная постановка образца в этой же тест-системе; Б) повторная детекция анти-HCV в другой тест-системе;
В) использование подтверждающих тестов на основе ИФА и иммуноблота.
В тест-системах последнего поколения производства компании DiaSorin (Италия) в качестве антигенов использованы конформационный белок NS3/4а и линейный фьюжн-белок MEFA (Multiple Epitope Fusion Antigens). Последний представляет собой антигенный комплекс, который включает в себя все основные иммунодоминантные эпитопы семи функциональных регионов генома HCV. Подобное сочетание антигенов позволяет значительно увеличить специфичность (99,7%) и чувствительность (100%) тест-системы и соответственно выявлять сероконверсию на самых ранних этапах. Определение тонкой биологической структуры HCV выделило ряд возможных целевых мишеней – белков, принимающих участие в механизмах репликации вируса. Среди них ключевыми оказались протеаза NS3/4А и полимераза NS5В HCV. Разработка системы субгеномной репликации позволила создать и начать изучение специальных препаратов, направленных на адресное лечение HCVинфекции. Другой важной мишенью для антивирусной терапии в рамках генома HCV являются оболочечные белки, которые участвуют в процессе вхождения (фузии) вируса в клетку, а также белок NS5А, вовлеченный в процесс репликации и определяющий устойчивость к интерферону-альфа. Наибольшие успехи на данный момент достигнуты в разработке ингибиторов протеазы NS3/4А HCV, это два соединения: телапревир и боцепревир, влияющих на жизненный цикл HCV.
Определение наличия РНК HCV в сыворотке крови необходимо для:
1)подтверждения инфекции у анти-HCV-позитивных лиц или подозрении на инфицирование при отсутствии антител к вирусу;
2)ранней диагностики острого гепатита;
32
3)контроля за перинатальной передачей вируса;
4)определения показаний к назначению противовирусной те-
рапии;
5)контроля за эффективностью противовирусной терапии. Наибольшее значение в диагностике ГС в настоящее время от-
водится количественному методу выявления РНК HCV с помощью ПЦР. Оптимальными при обследовании пациентов являются тестсистемы с чувствительностью от 50 до 100 МЕ/мл. Другой метод, позволяющий улавливать от 20 до 50 МЕ/мл HCV РНК – это тран- скрипционно-опосредованная амплификация. Оба перечисленных метода имеют исключительную специфичность, достигающую 9899%.
Всемирная организация здравоохранения (ВОЗ) установила международный стандарт для нормализации единиц, в которых выражают концентрацию РНК HCV. Для обеспечения сопоставимости результатов уровни сывороточной РНК следует выражать в МЕ/мл. Важно использовать один и тот же метод для каждого пациента, чтобы обеспечить согласованность при оценке ответа на противовирусную терапию.
Проведенный анализ нуклеотидных последовательностей изолятов вируса гепатита С сделал возможным его классификацию. Описано шесть генотипов HCV, пронумерованных от 1 до 6, и большое количество подтипов (рис. 10). Они произошли из различных районов Африки и Азии, некоторые широко распространены по всему миру. В настоящее время генотип 1 (подтипы 1а и 1в) является наиболее распространенным, при этом подтип 1в чаще встречается в Европе, а подтип 1а – в США. Генотип 3а выявляется в Европе среди потребителей инъекционных наркотиков. В этой группе происходит увеличение заболеваемости HCV-инфекцией генотипа 4, из-за повышения количества иммигрантов из Северной Африки. Генотип 2 обнаруживают в кластерах Средиземноморского региона, а генотипы 5 и 6 выявляют крайне редко.
Особенности распространения отдельных генотипов позволили обозначить их по доминирующему географическому региону:
-генотип 1а условно называют «американским»;
-генотип 1в – «японским»;
-генотип 2с – «итальянским».
33

В России также проведены исследования по определению структуры генотипов, циркулирующих в различных ее регионах. Наиболее часто – в 60-70% случаев определяется генотип 1в. Далее следуют генотипы 3а, 1а и 2а.
Рису- нок
10. Генетическое разнообразие вируса гепатита С
Важной является диагностика латентной HCV-инфекции. Под термином «латентная HCV-инфекция» понимают обнаружение HCV РНК в ткани печени и, в ряде случаев, в мононуклеарных клетках периферической крови при отсутствии HCV РНК в сыворотке крови. Для диагностики латентной HCV-инфекции необходимо применение высокочувствительных методов ПЦР и специальных методик обработки материала, в первую очередь ультрацентрифугирования сыворотки для концентрации вирусных частиц. В 70% случаев латентной HCV-инфекции РНК обнаруживают в мононуклеарах периферической крови. Латентная инфекция встречается при хроническом гепатите неуточненной этиологии, у больных на гемодиализе и при гепатоцеллюлярной карциноме. Важность выявления этой формы заболевания определяет возможность передачи вируса при гемотрансфузиях от доноров с недиагностированной HCV-инфекцией.
34
Выделяют две формы латентной HCV-инфекции:
1 типа – характеризующуюся выявлением HCV РНК в ткани печени у больных хроническим заболеванием органа неуточненной этиологии в отсутствие анти-HCV и HCV РНК в сыворотке крови.
2 типа – с обнаружением HCV РНК в ткани печени у больных со спонтанной или в результате противовирусной терапии элиминацией HCV РНК из сыворотки крови при сохраняющихся антиHCV.
Отсутствие РНК в сыворотке крови при латентной HCVинфекции может быть объяснено очень низким уровнем виремии, не определяемой тест-системами даже с высоким уровнем чувствительности – 50 МЕ/мл. В исследованиях Bartolome с соавт. (2007) HCV РНК была выявлена в сыворотке крови после дополнительного ультрацентрифугирования. Поэтому разработка более чувствительных диагностических тестов и применение ультрацентрифугирования сыворотки позволят уточнить частоту латентной HCVинфекции в популяции и у больных криптогенными заболеваниями печени.
Генотипы и подтипы HCV могут быть определены с помощью различных методов, включая прямое секвенирование, обратную гибридизацию и специфичную к генотипу ПЦР в режиме реального времени. Установлено, что с использованием коммерчески доступных систем анализа можно точно идентифицировать шесть генотипов HCV. Однако различить подтипы HCV 1а и 1в с помощью систем анализа, направленных на выявление 5´ - некодирующего участка генома HCV, у значительной доли пациентов невозможно. Важность правильного определения подтипа может возрасти, как только будут доступны новые противовирусные препараты прямого действия.
Современные рекомендации по диагностике острого и хронического гепатита С (EASL, 2011) следующие:
1.Важен подробный анамнез и данные физикального обследования. Пациенты обязательно должны ответить на вопрос об употреблении алкоголя.
2.Диагностика острой и хронической инфекции HCV основана на выявлении антител против HCV с помощью ИФА и выявлении РНК HCV с помощью чувствительного молекулярного метода.
35
3.Для диагностики острого гепатита С необходимо определение уровня РНК HCV, поскольку РНК появляется до того, как могут быть обнаружены антитела против HCV.
4.Пациента с положительным результатом анализа на антитела против HCV, но с отрицательным на РНК HCV следует повторно обследовать через несколько недель.
5.Наличие антител против HCV и РНК HCV не позволяет отличить острый гепатит С от обострения хронического гепатита С или от острого гепатита, вызванного другими причинами, у пациентов с хроническим гепатитом С.
6.Хронический гепатит С следует подтверждать как по наличию антител против HCV, так и РНК HCV, как качественным, так и количественным анализом.
7.Пациентам с гепатитом, состояние которых характеризуется иммуносупрессией, может потребоваться тест на определение РНК HCV, при этом антитела против HCV обнаружить невозможно.
Также необходимо помнить, что определение концентрации антител HCV IgG к структурным и неструктурным белкам вируса служит одним из диагностических маркеров и прогностических тестов, претендующих на роль «золотого стандарта» при HCV у новорожденных.
Серологическими методами дифференцировать «материнские»
и«собственные» антитела младенца, которые синтезируются именно его иммунной системой в ответ на вертикальную трансмиссию HCV, невозможно. Степень их генетического расхождения начинает увеличиваться с 6-7-месячного возраста и заканчивается к 12-15 месяцам.
У детей с состоявшейся перинатальной инфекцией и формированием собственного инфекционного процесса концентрация специфических антител класса IgG в первые месяцы жизни остается высокой, а с 6 месяцев не уменьшается, а повышается. Стойкое повышение концентрации анти-HCV (core, NS) IgG к 7-9-12 месяцам соответствует инфицированию.
36
Диагностика HBV-инфекции
В1963 году группа исследователей под руководством Баруха Бламберга (1925-2011) сделала неожиданное открытие. Ученые выделили из крови больного гемофилией, жившего в Нью-Йорке, антитела, реагирующие с сывороткой, полученной от австралийского аборигена. Бламберга удивил тот факт, что у больного из НьюЙорка встретился так называемый австралийский антиген, который, как считалось, имеется только у аборигенов.
В1964 году Бламберг перешел в Научно-исследовательский институт рака в Филадельфии и здесь продолжил изучать распределение австралийского антигена. Выяснилось, что антиген не столь тесно связан с принадлежностью к определенной этнической группе. К 1967 году ученый и его сотрудники уже были твердо убеждены в том, что австралийский антиген связан с поражением печени. В 1976 году Бламбергу совместно с Карлтоном Гайдузеком была присуждена Нобелевская премия по физиологии и медицине «за открытия, касающиеся новых механизмов происхождения и распространения инфекционных заболеваний».
Сейчас установлено, что австралийский антиген (HBsAg) является основным маркером вируса гепатита В, который характеризует развитие острого и хронического гепатитов, цирроза и рака печени. Открытие Бламберга позволило разработать эффективную вакцину против гепатита В.
Диагностика HBV-инфекции основана на выявлении в сыворотке крови антигенов и антител к антигенам вируса методом иммуноферментного анализа (ELISA) и рекомбинантного имму- ноблот-анализа (RIBA), который применяют в качестве подтверждающего теста, а также на обнаружении ДНК-вируса в сыворотке крови с помощью методов молекулярной биологии.
Вирион HBV (частица Дейна) состоит из вирусной ДНК, ДНКполимеразы, нуклеокапсида и поверхностной оболочки. Вирусная ДНК представляет собой двухцепочную молекулу, образованную приблизительно 3200 парами нуклеотидов. Геном HBV имеет четыре перекрещивающиеся открытые рамки считывания (гены), которые обозначают латинскими буквами S, C, X и P (рис. 11).
Р-ген кодирует синтез ДНК-полимеразы вируса, обладающей обратной транскриптазной активностью. Таким образом, синтез ви-
37

русной ДНК проходит через образование промежуточной РНК (пре-генома).
Ключевую роль в персистировании вируса и развитии хронической HBV-инфекции играет формирование внутриядерного пула комплементарно закрученной спиральной ДНК вируса (ссс DNA), которая представляет собой своеобразную «мини-хромосому» и является основой для синтеза матричных РНК, определяющих синтез генетического материала и основных белков HBV.
Рисунок 11. Строение генома вируса гепатита В
Х-ген кодирует синтез белка, роль которого полностью не установлена, однако считается, что он способствует репликации и сборке вирусных частиц и участвует в процессах канцерогенеза.
Поверхностная оболочка HBV представлена в основном липидами и белками, и ее белковые компоненты могут существовать в сыворотке и других жидкостях организма либо в составе полного вириона, либо в виде отдельных сфер или цилиндров размером от 20 нм в диаметре. Главная антигенная детерминанта – поверхностный (surface) антиген гепатита В состоит из 3 компонентов: S-, пре- S-1 и пре-S-2- протеина. Пре-S-1 и пре-S-2 играют важную роль в прикреплении вириона и проникновении его в клетку, и их относительно больше в полных вирионах, чем в частицах HBsAg. HBsAg
38
включает главную антигенную детерминанту (а) и несколько подтипов D, X, W, R. Одна из специфических особенностей HBV – повышенная продукция свободного HBsAg.
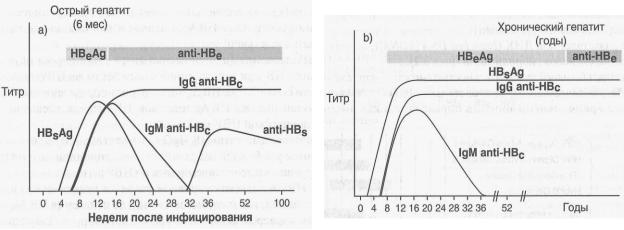
HBsAg представляет собой основной скрининговый маркер HBV-инфекции и обнаруживается в сыворотке крови через 1-10 недель после инфицирования, приблизительно за 2-6 недель до первых симптомов заболевания и повышения активности АЛТ. У больных с острой самолимитирующейся HBV-инфекцией HBsAg исчезает из крови в течение 6 месяцев (рис. 12), при хроническом процессе выявляется на протяжении всего заболевания.
Рисунок 12. Динамика серологических маркеров HBV при остром (а) и хроническом (б) течении инфекции
У части больных (до 20% случаев), особенно при фульминантной печеночной недостаточности, HBsAg может не выявляться в сыворотке крови (вследствие выраженного иммунного лизиса инфицированных гепатоцитов он не успевает в достаточном количестве секретироваться в кровь), в этом случае единственным серологическим маркером острой инфекции будут анти-HBc-IgM. В настоящее время обсуждается возможность широкого использования количественного определения HBsAg в сыворотке крови для оценки активности репликации вируса и эффективности проводимой терапии.
Определение концентрации HBsAg:
-низкий уровень – 10-100 нг/мл;
-средний уровень – 100 – 150 нг/мл;
-высокий уровень – 150-250 и более нг/мл.
39
У больных с низким титром HBsAg гепатит В чаще протекает в легкой форме без выраженных симптомов интоксикации с невысоким уровнем билирубинемии. При ХГВ высокий уровень HBsAg всегда сочетается с репликацией вируса.
Антитела к HBsAg (анти-HBs) продуцируются уже в раннем периоде при острой инфекции, но выявляются в сыворотке крови после исчезновения HBsAg и указывают на возможную элиминацию вируса и клиническое выздоровление. При этом может существовать короткий период времени (от 1-2 недель до 2 месяцев) между исчезновением HBsAg и появлением анти-HBs – так называемое «серологическое окно».
Как правило, анти-HBs направлены на «а»-детерминанту HBsAg и поэтому обладают протективным иммунитетом ко всем серотипам вируса. В большинстве случаев анти-HBs сохраняются в сыворотке крови у всех выздоровевших на протяжении всей жизни.
В ряде случаев (до 24%) HBsAg и анти-HBs могут выявляться в сыворотке крови одновременно, при этом анти-HBs направлены на другие структуры поверхностной оболочки вируса, а не на «а»- детерминанту, и не обладают защитными свойствами. Этих лиц необходимо расценивать как инфицированных вирусом.
Наличие изолированных анти-HBs в сыворотке крови указывает на проведенную вакцинацию против гепатита В.
Частота элиминации HBsAg при лечении любыми современными противовирусными средствами низкая (3-4% при применении пэгинтерферона α и еще ниже при лечении аналогами нуклеоз(т)идов), поэтому важное значение для оптимизации терапии имеет прогнозирование стойкого вирусологического ответа. С этой целью проводится количественный анализ содержания HBsAg в крови. Применение теста помогает оценить целесообразность продолжения лечения с учетом динамики уровня HBsAg. Представляет интерес изучение не только степени, но и скорости снижения уровня HBsAg.
С-ген, или core (ядерный) ген, состоит из главного С-участка и дополнительного pre-C, кодирующих синтез соответственно HBcAg, образующего нуклеокапсид, и HBeAg, который секретируется в кровь и является маркером активной репликации вируса. HBeAg и HBcAg, являются основными мишенями клеточного и гуморального иммунитета, направленного на элиминацию вируса и лизис инфицированных гепатоцитов.
40
