
- •1.10 Распределение Максвелла
- •Из выражений (1.10.5) и (1.10.6) следует, что
- •Это позволяет записать соотношение (1.10.15) в виде
- •Умножим обе части (1.10.20) на υхd υх . В результате будем иметь
- •1.12. Распределение Максвелла для относительных скоростей
- •1.13 Распределение Больцмана
- •Распределение Максвелла-Больцмана
- •1.14 Экспериментальная проверка распределения молекул по абсолютным значениям скорости
- •Глава 7. Жидкости
- •7.1. Общие свойства
- •8.5. Квантовая теория теплоемкости атомарных кристаллических тел по Эйнштейну
1.12. Распределение Максвелла для относительных скоростей
Закон Максвелла (1.10.35) позволяет записать его в форме независимой от температуры газа и массы его молекул. Для этого введем безразмерную относительную скорость
![]() ,
(1.12.1)
,
(1.12.1)
где
![]() -
наиболее вероятная скорость молекулы.
Так как функция и
от υ
монотонно возрастающая, то плотность
распределения
-
наиболее вероятная скорость молекулы.
Так как функция и
от υ
монотонно возрастающая, то плотность
распределения
![]() найдется
из равенства (см. формулу (А.71) Приложения
А)
найдется
из равенства (см. формулу (А.71) Приложения
А)
![]() (1.12.2)
(1.12.2)
Подставим
функцию
![]() из (1.10.35) в (1.12.2)
из (1.10.35) в (1.12.2)
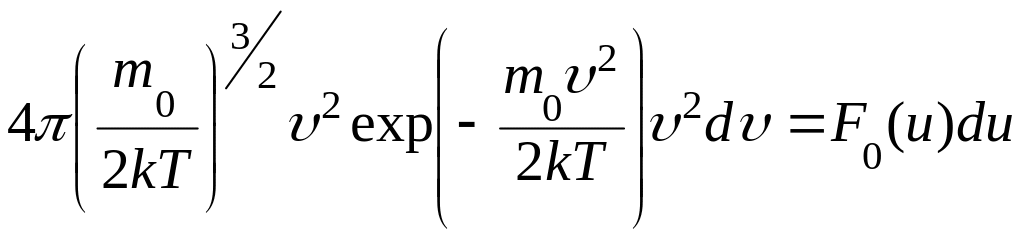 (1.12.3)
(1.12.3)
Учитывая,
что
![]() ,
,
![]() и
и
![]() ,
из (1.12.2)
получим
,
из (1.12.2)
получим
![]() (1.12.4)
(1.12.4)
Плотность
вероятности
![]() называют законом Максвелла для
относительных скоростей. Эта функция,
как видно из (1.12.4), одинакова для всех
газов и не зависит от температуры. Зная
функцию
,
можно вычислить вероятность того, что
относительная скорость молекулы
примет значение на интервале (0,
u):
называют законом Максвелла для
относительных скоростей. Эта функция,
как видно из (1.12.4), одинакова для всех
газов и не зависит от температуры. Зная
функцию
,
можно вычислить вероятность того, что
относительная скорость молекулы
примет значение на интервале (0,
u):

Интеграл в последнем выражении есть функция верхнего предела, т.е.
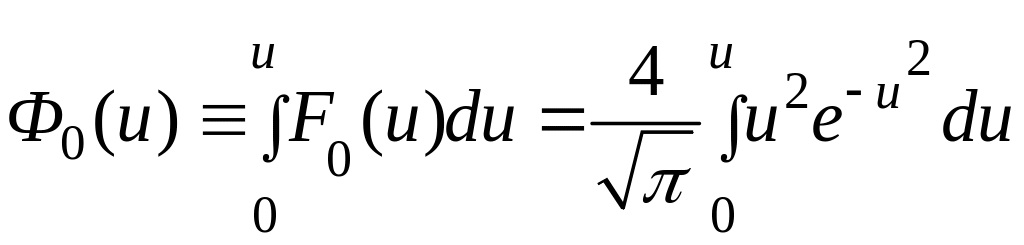 (1.12.5)
(1.12.5)
Этот
интеграл не выражается через элементарные
функции. Его можно подробно вычислить
численными методами для различных
значений u
и
составить соответствующие таблицы.
Располагая такими таблицами, легко
находить любые вероятности того, что
скорость молекулы попадает в тот или
иной интервал. В самом деле, пусть газ,
состоит из молекул массы m0
и находится при температуре T.
Требуется, через табулированную функцию
![]() найти
вероятность того, что скорость
υ
произвольной молекулы заключена в
интервале (υ1,υ2).
найти
вероятность того, что скорость
υ
произвольной молекулы заключена в
интервале (υ1,υ2).
Из
равенства (1.12.2) искомая вероятность
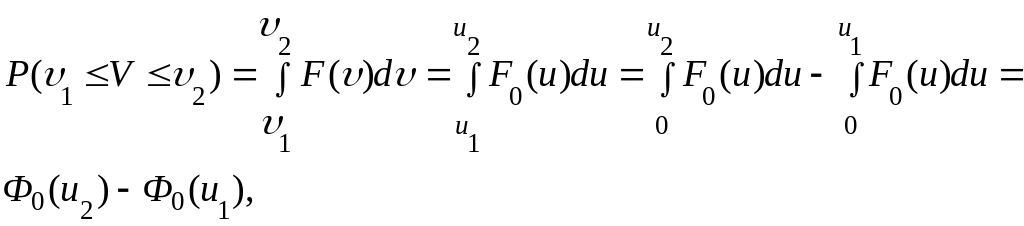
где ui= υi / υвер, i=1,2.
Также легко, к примеру, найти вероятность того, что скорость молекулы будет не меньше заданной υ1. Снова, используя (1.12.2), найдем требуемую вероятность
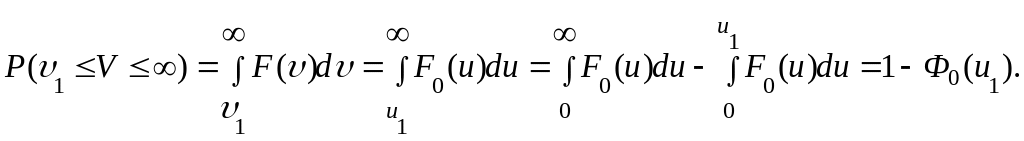 так
как
так
как
![]()
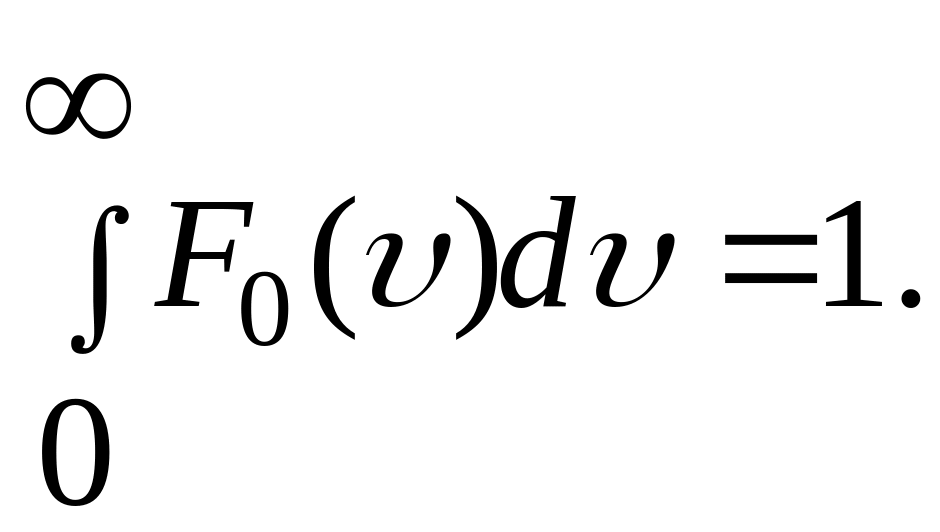
1.13 Распределение Больцмана
Если газ находится в равновесии при температуре Т и отсутствуют внешние поля, то тепловое (хаотическое) движение молекул распределяет их по всему доступному объему равномерно, с постоянной концентрацией. Если же на газ наложить внешнее силовое поле, его молекулы будут иметь тенденцию перемещаться в направлении действия силы и, таким образом, концентрация их в этом направлении будет увеличиваться, хотя, по-прежнему, тепловое движение стремится рассредоточить молекулы равномерно по пространству. Эти два противоположно действующих механизма (тепловое движение и внешнее силовое поле) создают неравномерную, но равновесную концентрацию по пространству. Другими словами, в силовом поле концентрация молекул будет являться функцией пространственных координат n = n(x,y,z), не зависящей от времени (равновесие). Найдем это распределение концентрации по пространству, занимаемому газом.
Для
того, чтобы газ находился в состоянии
термодинамического равновесия во
внешнем поле сил, во-первых, он должен
находиться в тепловом равновесии:
температура газа Т
должна быть постоянной и равной
температуре внешних тел; во-вторых, он
должен находиться в механическом
равновесии: суммарная сила
![]() , действующая на все молекулы произвольного
объема dV
газа
со стороны внешнего поля должна
уравновешиваться силами давления
, действующая на все молекулы произвольного
объема dV
газа
со стороны внешнего поля должна
уравновешиваться силами давления
![]() газа на поверхность этого объема, т.е.
газа на поверхность этого объема, т.е.
![]() (1.13.1)
(1.13.1)
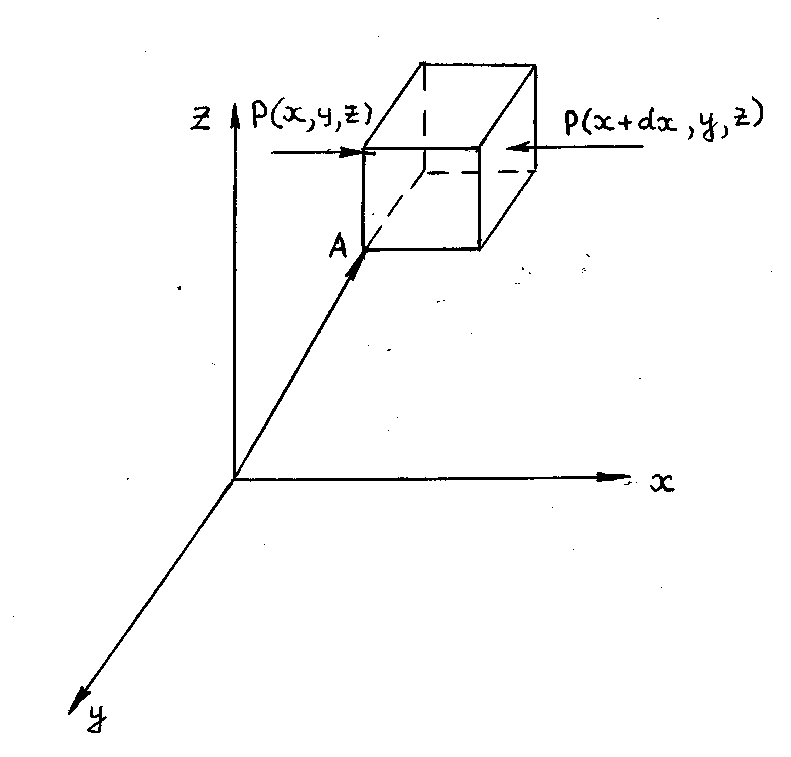
Р и с. 13
Если
dV=dxdydz
-
бесконечно малый элемент объема газа,
находящегося около точки A
с
координатами x,y,z
(рис.13),
то число молекул в нем равно
n(x,y,z)dV.
Ввиду малости объема dV
на
каждую молекулу его действует постоянная
по направлению и по
величине внешняя
сила
![]() и зависящая только от координат точки
A,
т.е.
и зависящая только от координат точки
A,
т.е.
![]() .
Поэтому
.
Поэтому
![]() (1.13.2)
(1.13.2)
С учетом (1.13.2) равенство (1.13.1) перепишем в виде:
![]() (1.13.3)
(1.13.3)
или в проекциях на ось x:
![]() (1.13.4)
(1.13.4)
На рис.13 показан элементарный параллелепипед с указанием сил, действующих в направлении оси X. Если давление на левой грани равно P(x,y,z), то полная сила, действующая на эту грань, будет P(x,y,z)dydz. Давление на правой грани равно P(x+dx,y,z), и полная сила, действующая на эту грань, равна поэтому P(x+dx,y,z)dydz. Так как газ находится в равновесии, то эти силы противоположно направлены и проекция на ось X их равнодействующей может быть найдена просто путем вычитания
![]() (1.13.5)
(1.13.5)
Силы давления на остальные грани перпендикулярны оси X и их проекции на ось X равны нулю. Таким образом, полная сила, действующая на элементарный объем dV в направлении оси X, определится выражением
![]() (1.13.6)
(1.13.6)
Разложим
функцию
![]() по
степеням dx
в точке A(x,y,z).
по
степеням dx
в точке A(x,y,z).
![]() (1.13.7)
(1.13.7)
Подставим разложение (1.13.7) в (1.13.6). В результате будем иметь
![]() (1.13.8)
(1.13.8)
Подобным образом находятся проекции полных сил, действующих на внешнюю поверхность объема dV в направлении осей Y и Z.
![]() (1.13.9)
(1.13.9)
![]() (1.13.10)
(1.13.10)
Будем предполагать внешнее поле потенциальным, для которого
![]() (1.13.11)
(1.13.11)
где
![]() - потенциальная энергия молекулы,
находящейся в точке A(x,y,z).
Откуда
- потенциальная энергия молекулы,
находящейся в точке A(x,y,z).
Откуда
![]() (1.13.12)
(1.13.12)
Подставляя формулы (1.13.12) и (1.13.8) в выражение (1.13.4) и учитывая, что P=nkT, получим
![]() (1.13.13)
(1.13.13)
Аналогичные равенства находятся проектированием сил, входящих в формулу (1.13.1), на оси Y и Z:
![]() (1.13.14)
(1.13.14)
![]() (1.13.15)
(1.13.15)
Умножим равенства (1.13.13) – (1.13.15) соответственно на dx, dy, dz и сложим их. В результате будем иметь
![]() (1.13.16)
(1.13.16)
Выберем
начало отсчета потенциальной энергии
в точке с координатами
![]() ,
т.е. в этой точке
,
т.е. в этой точке
![]() .
.
Пусть значение давления в этой точке задано и равно P0 . Тогда интегрируя левую часть уравнения (1.13.16) в пределах от P0 до P, а правую - от 0 до EP , получим
![]() (1.13.18)
(1.13.18)
Учитывая, что P = nkT, равенство (1.13.17) можем переписать в виде
![]() (1.13.18)
(1.13.18)
Из формул Больцмана (1.13.17) и (1.13.18) видно, что концентрация (давление) молекул больше в тех точках пространства, где меньше их потенциальная энергия. При T → ∞, независимо от значения EP, концентрация n→ n0 = const, т.е. постоянна по всему объему, занятому газом. Таким образом, внешнее поле стремится сосредоточить молекулы в местах, где их потенциальная энергия меньше, а тепловое (хаотическое) движение разбрасывает молекулы по пространству так, что различие в концентрациях молекул в разных областях пространства с разными значениями потенциальной энергии уменьшается с увеличением температуры.
Если
газ находится в равновесии при температуре
Т
в однородном поле земного тяготения,
для которого
![]() ,
то, согласно формуле (1.13.17), давление
газа
,
то, согласно формуле (1.13.17), давление
газа
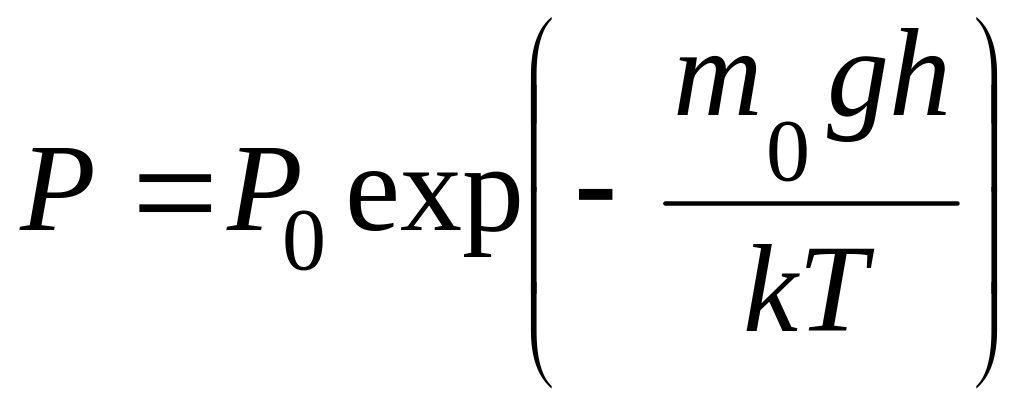 (1.13.19)
(1.13.19)
где m0g - вес молекулы, P0 - давление на высоте h=0, где потенциальная энергия выбрана равной нулю. Эта формула носит название барометрической формулы Лапласа. Из нее следует, что давление газа убывает с высотой тем быстрее, чем больше вес молекулы и чем ниже температура T газа.
Барометрической формулой удобнее пользоваться, если числитель и знаменатель под знаком экспоненты умножить на постоянную Авогадро NA. Тогда
![]() ,
(1.13.20)
,
(1.13.20)
где μ = m0NA - молярная масса газа, R - газовая постоянная.
Формула (1.13.20) описывает земную атмосферу приближенно, так как из-за действия на атмосферу солнечного излучения ее температура не является постоянной (к примеру, в тропосфере, которая простирается до высоты h =10 км, температура убывает линейно до значения Т =220К . Поэтому в высотомерах (альтиметрах), представляющих собой барометры, шкалы которых проградуированы в метрах, необходимо вводить поправку на температуру.
В заключение отметим, что распределение Больцмана (1.13.18) применимо не только к идеальному газу, но к любой системе невзаимодействующих частиц, находящихся в равновесии при температуре Т и под воздействием потенциального силового поля. Например, к системе электронов в металле или полупроводнике, к системе частиц, взвешенных в жидкости или газе и т.п.
