
Volume1
.pdf
2
Химия клетки и биосинтез
На первый взгляд, трудно согласиться с представлением о том, что все живые существа, описанные в главе 1, являются не более чем химической системой. Невероятное разнообразие живых форм, целеустремленная направленность их действий и способность расти и воспроизводиться, кажется, выделяют их из мира твердых тел, жидкостей и газов, которые, как правило, находятся в вéдении химии. Действительно, до девятнадцатого столетия полагали, что животные содержат жизненную силу (жизненное начало) — «дух1», который и определяет их отличительные свойства.
Теперь мы знаем, что в живых организмах нет ничего, что не подчинялось бы законам химии и физики. И все же химия жизни особенная. Во-первых, она основывается преимущественно на соединениях углерода, учение о которых поэтому известно как органическая химия. Во-вторых, клетки на 70 % состоят из воды, и жизнь в значительной степени зависит от химических реакций, протекающих в водном растворе. В-третьих, что наиболее важно, химия клетки чрезвычайно сложна: даже самая простая клетка с точки зрения химии безмерно сложнее, чем какая-либо иная известная химическая система. Хотя клетки содержат огромное разнообразие маленьких углеродсодержащих молекул, большинство атомов углерода в клетках включено в огромные полимерные молекулы — цепи химических субъединиц, связанных между собой по принципу «голова к хвосту». Именно уникальные свойства таких макромолекул и позволяют клеткам и организмам расти и воспроизводиться, а также осуществлять все прочие присущие жизни атрибуты.
2.1. Химические компоненты клетки
Каждое вещество, существующее в природе, состоит из определенной комбинации элементов — простые вещества состоят из элементов одного вида, например, водорода или углерода, которые не могут быть разделены на части или превращены в другие простые вещества химическими средствами. Наименьшая частица элемента, которая все еще сохраняет его отличительные химические свойства, — атом (рис. 2.1). Однако свойства всех остальных веществ, помимо простых — в том числе материалов, из которых построены живые клетки, — зависят от способа, которым входящие в их состав атомы соединяются друг с другом с образованием молекул. Поэтому, для того чтобы понять, каким образом живые организмы построены из неживого вещества, очень важно знать, как образуются всевозможные химические связи, посредством которых атомы объединяются в молекулы.
1 Латинское слово animal (животное) образовано от основы anima, означающей «дыхание», «душа». Согласно верованиям древних, при рождении всякой твари в нее вдыхалась душа (женское начало) или дух (animus) — мужское начало. При этом дух определял не только способность дышать, но также природные качества и характер его обладателя. — Прим. пер.

Глава 2. Химия клетки и биосинтез 69
Рис. 2.1. Очень схематичное представление атома углерода и атома водорода. Ядро каждого атома,
кроме водорода2, состоит из положительно заряженных протонов и электрически нейтральных нейтронов.Числоэлектроновватомеравночислуегопротонов(атомныйномер),такчтоатомнеимеет результирующего заряда (в целом электрически нейтрален). Поскольку именно электроны определяют химическое поведение атома, все атомы данного элемента имеют один и тот же атомный номер. Нейтронысутьнезаряженныесубатомныечастицыпочтитойжемассы,чтоипротоны.Онивносятвклад вструктурнуюустойчивостьядра:еслиихслишкоммногоилислишкоммало,ядроможетразрушиться (радиоактивныйраспад),—ноневлияютнахимическиесвойстваатома.Благодарянейтронамэлемент можетсуществоватьвнесколькихфизическиотличающихся,нохимическиидентичныхформах,названныхизотопами;всеизотопыимеютразноечислонейтронов,ноодинаковоечислопротонов.Вприроде встречаютсямногочисленныеизотопыпочтивсехэлементов,втомчисленеустойчивые.Например,тогда какосновнаямассауглероданаЗемлесуществуетввидеустойчивогоизотопауглерода-12сшестьюпро- тонамиишестьюнейтронами,естьтакженебольшоеколичествонеустойчивогоизотопа,радиоактивного углерода-14,ватомекоторогошестьпротоновивосемьнейтронов.Углерод-14подвергаетсярадиоактив- номураспадуснебольшой,нопостояннойскоростью.Этосоздаетосновуметода,известногокакдатированиерадиоактивнымуглеродом,которыйиспользуетсявархеологиидляопределениявременипроисхожденияорганическихматериалов.
В действительности нейтроны, протоны и электроны бесконечно малы относительно атома в целом; здесьихразмерыоченьпреувеличены.Крометого,диаметрядрасоставляетлишьоколо10–4 диаметра электронногооблака.Наконец,хотяэлектроныпоказаныздесьввидеотдельныхчастиц,вдействительностиихповедениеподчиняетсязаконамквантовоймеханики,иникакимметодомневозможноточно предсказатьместоположениеэлектронавконкретныймоментвремени.
2.1.1. Клетки построены из атомов всего лишь нескольких типов
Под атомной массой атома или молекулярной массой молекулы понимается их масса относительно таковой для атома водорода3. Она, по существу, равна совокупной массе протонов и нейтронов, которые атом или молекула содержат, так
2Изотопа водорода-1 — Прим. ред.
3Атомная единица массы (а. е. м.), она же дальтон (Да), — единица измерения масс атомов, молекул и элементарных частиц. За атомную единицу массы принята 1/12 массы изотопа углерода 12С. Рекомендована к применению IUPAC в 1961 году. — Прим. ред.

70 |
|
|
Часть 1. Введение в мир клетки |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
как электроны намного легче и практически |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ничего не привносят в общую массу атома |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
или молекулы. Таким образом, главный изо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
топ углерода имеет атомную массу 12 и обо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
значается как 12C, тогда как неустойчивый |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изотоп углерода имеет атомную массу 14 и за- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
писывается символом 14C. Масса атома или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
молекулы часто выражается в дальтонах, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
один дальтон соответствует атомной единице |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
массы, приблизительно равной массе атома |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
водорода (см. сноску 3). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Атомы настолько малы, что трудно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
представить себе их размер. Отдельный атом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
углерода имеет примерно 0,2 нм в диаметре, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
так что потребуется около 5 миллионов таких |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
атомов, уложенных по прямой, чтобы отме- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рить один миллиметр. Масса протона или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нейтрона приблизительно 1/(6·1023) грам- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис.2.2.Мольимолярныерастворы |
мов, так что один грамм водорода содержит |
|||||||||||
|
|
|
6·1023 атомов. Это огромное число 6·1023, |
||||||||||||
названное числом Авогадро, представляет собой ключевой коэффициент масштабирования, описывающий соотношения между количествами, измеряемыми вошедшими в повседневный быт величинами, и количествами, выражаемыми в мерах отдельных атомов или молекул. Если некоторое вещество имеет молекулярную массу X, это значит, что 6·1023 молекул этого вещества имеют массу X граммов. Это количество называют одним молем вещества (рис. 2.2).
Известно 89 природных элементов, каждый из которых отличается от всех остальных числом протонов и электронов в атомах. Живые организмы, однако, построены лишь из небольшой выборки этой совокупности элементов, причам четыре из них: углерод (C), водород (H), азот (N) и кислород (O) — составляют 96,5 % массы организма. Такой состав живых организмов разительно отличается от неживой неорганической окружающей среды (рис. 2.3), и это служит свидетельством отличительного характера химии жизни.
2.1.2. Характер взаимодействия атомов определяют электроны внешней оболочки
Чтобы понять, как атомы соединяются друг с другом с образованием молекул, из которых, в свою очередь, состоят живые организмы, мы сосредоточим внимание на электронах. Протоны и нейтроны прочно связаны друг с другом в ядре и меняют партнеров только в экстремальных условиях, например: в процессе радиоактивного
4 Моль — это количество вещества, содержащее 6,02 × 1023 структурных единиц (атомов, молекул, ионов, радикалов) данного вещества. Число 6,02 × 1023 называется числом Авогадро. Молярная масса численно равна относительной молекулярной массе и измеряется в граммах на моль (г/моль). —
Прим. ред.
5 Молярная концентрация — количество вещества (в молях), содержащееся в 1 л раствора. В одномолярном растворе (1 М) содержится 180 г глюкозы в литре раствора, тогда как в одномиллимолярном
(1 мМ) — 180 мг/л. — Прим. ред.

Глава 2. Химия клетки и биосинтез |
71 |
Рис. 2.3. Распространенность некоторых химических элементов в неживой природе (земная кора) |
|
всравнениисихотносительнымсодержаниемвтканяхчеловека.Относительноесодержаниекаждого |
|
элементавыраженокакпроцентотобщегочислаатомоввещества,включаяводу.Такимобразом,из-за |
|
обилияводыболеечем60 %атомоввживоморганизме—атомыводорода.Относительноесодержание |
|
элементовсхожедлявсехживыхсуществ. |
|
распада, или в недрах солнца, или же во чреве ядерного реактора. В живых тканях перегруппировкам подвергаются только электроны атомов. Они формируют оболочку атома и определяют химические закономерности, согласно которым атомы объединяются с образованием молекул.
Электроны находятся в непрерывном движении вокруг ядра, но движения в таком субмикроскопическом масштабе повинуются совершенно иным законам, сильно отличающимся от известных в повседневной жизни. Согласно этим законам, электроны в атоме могут находиться лишь в определенных дискретных состояниях, названных орбиталями, а числу электронов, которые могут быть размещены на орбитали данного типа — так называемой электронной оболочке, — положен строгий предел. Электроны, находящиеся наиболее близко к положительному ядру, притягиваются к нему наиболее сильно и занимают самую внутреннюю, наиболее сильно связанную с ядром оболочку. На этой оболочке находится максимум
72 Часть 1. Введение в мир клетки
два электрона. Вторая оболочка более отдалена отядра, и ее электроны связаны слабее. Эта вторая оболочка удерживает до восьми электронов. Третья оболочка содержит электроны, которые связаны еще слабее; она также содержит до восьми электронов. Четвертая и пятая оболочки могут содержать по 18 электронов каждая. Атомы, окруженные более чем четырьмя оболочками, встречаются в биологических молекулах крайне редко.
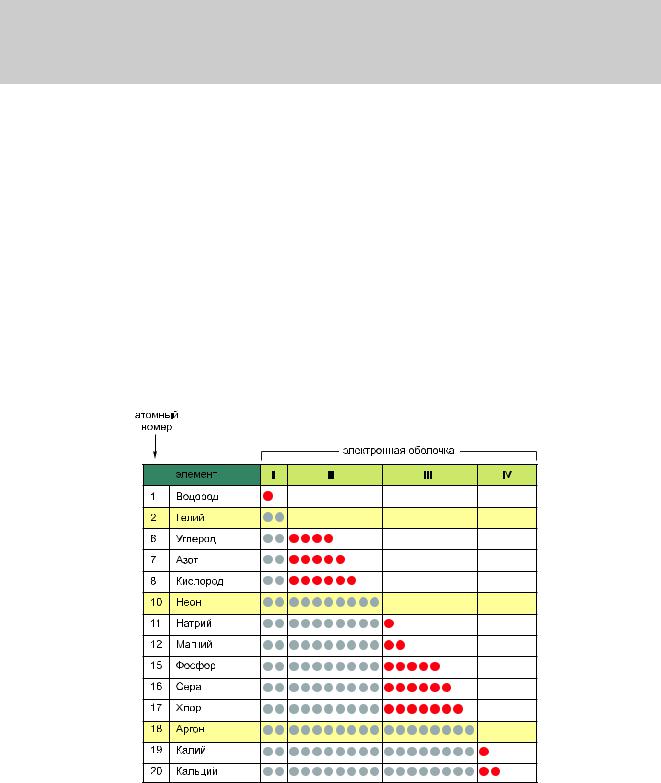
Самое устойчивое положение в атоме занимают те электроны, которые находятся в состоянии максимальной связи с ядром, то есть когда они занимают самые близкие к ядру оболочки. Поэтому в случае больших атомов электроны заполняют орбитали по порядку: первую оболочку перед второй, вторую перед третьей и так далее. Атом, внешняя оболочка которого полностью заполнена электронами, особенно устойчив и поэтому химически инертен. Например, гелий с 2 электронами, неон с 2 + 8 электронами и аргон с 2 + 8 + 8 электронами — это инертные газы. Водород, напротив, имеет лишь один электрон и только наполовину заполненную оболочку, поэтому представляет собой весьма реакционноспособный атом. Аналогично другие атомы, встречающиеся в живых тканях, имеют незаполненные внешние электронные оболочки и могут отдавать, принимать или обобществлять электроны при взаимодействии друг с другом и образовывать в результате этого взаимодействия как молекулы, так и ионы (рис. 2.4).
Рис.2.4.Завершенныеинезавершенныеэлектронныеоболочкинекоторыхраспространенныхэлемен-
тов.Всеэлементы,распространенныевживыхорганизмах,имеютнезаполненныевнешниеоболочки (красные) и могут, таким образом, участвовать в химических реакциях с другими атомами. Сравнения радипоказанынекоторыеэлементы,электронныеоболочкикоторыхполностьюзаполнены(выделены желтым);ониявляютсяхимическиинертными.

Глава 2. Химия клетки и биосинтез 73
Поскольку незаполненная электронная оболочка менее устойчива, чем заполненная, атомы с неполными внешними оболочками стремятся к взаимодействию с другими атомами, чтобы приобрести или потерять столько электронов, сколько требуется для достижения полного заполнения внешней оболочки. Такой обмен электронами происходит либо путем передачи электронов от одного атома другому, либо посредством обобществления электронов двух атомов. Эти два способа обусловливают два типа химических связей между атомами: ионная связь образуется, когда один атом отдает электроны другому, тогда как ковалентная связь образуется, когда два атома обобществляют пару электронов (рис. 2.5). Часто такая пара электронов распределена неравнозначно, если частично переданные электроны находятся между двумя атомами, которые притягивают их по-разному — один из них более электроотрицателен, нежели другой; в результате такого способа взамодействия — промежуточного между ионнным и ковалентным — образуется
полярная ковалентная связь, которую мы обсудим позже.
Рис.2.5.Сравнениековалентнойиионнойсвязей.Атомымогутдостигатьболееустойчивогорасположения электронов на своей внешней оболочке за счет взаимодействия друг с другом. Ионная связь образуется,когдаэлектроныпередаютсяотодногоатомадругому.Ковалентнаясвязьобразуется,когда электроныобобществляютсяатомами.Нарисункепредставленыдвакрайнихслучая;частоковалентные связиобразуютсясчастичнойпередачей(неравномернымобобществлением)электронов,чтодаетполярнуюковалентнуюсвязь(см.рис.2.43).
Атом водорода, которому недостает лишь одного электрона для заполнения своей электронной оболочки, обычно заимствует его путем обобществления электронов, образуя одну ковалентную связь с другим атомом; часто эта связь полярная, что означает неравномерное распределение электронов. Другие распространенные в живых клетках элементы: C, N и O с незавершенной второй оболочкой, а также P и S с не до конца заполненной третьей оболочкой (см. рис. 2.4), — как правило, обобществляют электроны, образуя несколько ковалентных связей, и достигают заполнения внешней оболочки до восьми электронов. Число электронов, которые

74 Часть 1. Введение в мир клетки
атом должен получить или отдать (путем обобществления либо передачи), чтобы заполнить свою внешнюю оболочку, называют его валентностью.
Определяющая роль внешней электронной оболочки в проявлении элементом тех или иных химических свойств означает следующее: если элементы разместить в порядке возрастания их атомного номера, то мы заметим периодическое повторение элементов с подобными свойствами. Так, элемент, скажем, с незавершенной второй оболочкой с одним электроном будет вести себя почти так же, как элемент, у которого заполнена вторая оболочка, а на незавершенной третьей — один электрон. У металлов, например, на незавершенных внешних оболочках только один или несколько электронов, тогда как инертные газы, как мы только что видели, имеют заполненные внешние оболочки. Эта закономерность лежит в основе знаменитой периодической системы элементов, представленной на рис. 2.6, при этом элементы, входящие в состав живых организмов, выделены цветом.
Рис. 2.6. Элементы, упорядоченные согласно своему атомному номеру, составляют периодическую таблицу Менделеева. Элементы, которые проявляют подобные свойства, распределены по группам наоснованиичислаэлектроноввовнешнейоболочке.Например,MgиCaстремятсяотдатьдваэлектрона со своих внешних оболочек; C, N и O завершают (заполняют до конца) свои вторые электронные оболочки за счет обобществления электронов. Четыре элемента, выделенные красным, составляют 99 % общегочислаатомовэлементов,имеющихсявтелечеловека.Ещесемьэлементов,выделенныхсиним, вместе составляют приблизительно 0,9 % от общего количества. Остальные элементы, показанные зеленым, нужны человеку в ничтожных количествах (микроколичествах). Остается неясным, нужны нам элементы,показанныежелтым,илинет.Химияжизни,по-видимому,представленапреимущественно химиейлегкихэлементов.
Атомные массы, представляющие собой суммарную массу протонов и нейтронов в атомном ядре, отличаются дляразных изотопов одного итогожеэлемента.Атомныемассы,показанныездесь,представляютмассынаиболеераспространенныхизотоповкаждогоэлемента.
2.1.3. Ковалентные связи образуются за счет обобществления электронов
Все характеристики клетки зависят от молекул, из которых она состоит. Согласно определению, под молекулой6 понимают группу атомов, которые удержива-
6 В классической химии это понятие трактуется шире. Молекула — это наименьшая частица вещества, определяющая его свойства. Состоит из атомов одного или различных химических эле-

Глава 2. Химия клетки и биосинтез 75
ются вместе ковалентными связями; здесь для дополнения своих внешних оболочек атомы обобществили электроны, а не обменялись ими между собой. В самой простой из возможных молекул — молекуле водорода (H2) — два атома водорода, каждый с единственным электроном, делят между собой два общих электрона — именно столько их необходимо для заполнения первой оболочки. Такие обобществленные электроны формируют электронное облако с отрицательным зарядом, которое имеет наибольшую плотность в области между двумя положительно заряженными ядрами и помогает удерживать их вместе — в противовес взаимному отталкиванию между одноименными зарядами, которое в противном случае отдалило бы их друг от друга. Силы притяжения и отталкивания находятся в равновесии, когда ядра разнесены на характеристическое расстояние, названное длиной связи.
Следующее свойство всякой связи — ковалентной или нековалентной — это сила связи, которая измеряется количеством энергии, которое необходимо затратить для разрыва этой связи. Она часто выражается в единицах килокалорий на моль (ккал/моль), где одна килокалория равна количеству энергии, необходимому для повышения температуры одного литра воды на один градус Цельсия (по стоградусной шкале Цельсия). Таким образом, если 1 килокалория должна быть потрачена на разрушение 6·1023 связей определенного типа (то есть 1 моля этих связей), то сила такой связи составляет 1 ккал/моль. Равносильной, широко применяемой мерой энергии является килоджоуль (кДж), который равен 0,239 ккал.
Чтобы понять значение силы связей, полезно сравнить их со средними энергиями ударов, которые молекулы постоянно испытывают при столкновении с другими молекулами в окружающей их среде (их тепловой энергией), равно как и с другими источниками биологической энергии, например светом и окислением глюкозы (рис. 2.7). Энергия ковалентной связи, как правило, выше тепловой энергии колебаний атомов в молекуле в 100 раз, так что ковалентные связи в молекуле сопротивляются растяжению, производимому тепловыми колебаниями, и обычно разрываются только в ходе определенных химических реакций с другими атомами
имолекулами. Образование и разрушение ковалентных связей суть бурные события,
ив живых клетках они с большой точностью управляются весьма специфичными катализаторами, названными ферментами. Нековалентные связи, как правило, намного слабее; позже мы увидим, что они важны в клетке в тех случаях, когда молекулам для осуществления своих функций необходимо легко объединяться
ирасходиться.
Рис.2.7.Некоторыевидыэнергии,важныедляклеток.Обратитевнимание,чтосравнениеприведено налогарифмическойшкале.
ментов и существует как единая система атомных ядер и электронов. Атомы удерживаются в молекуле с помощью химических связей. — Прим. ред

76 Часть 1. Введение в мир клетки
Если атом водорода способен образовывать только единственную ковалентную связь, то другие обычные для клеток атомы, которые образуют в них ковалентные связи: O, N, S и P, равно как и важнейший во всех отношениях атом углерода, — могут образовывать сразу несколько таких связей. Внешняя оболочка этих атомов, как мы узнали, может разместить до восьми электронов, и они образуют ковалентные связи с таким количеством других атомов, которое необходимо для достижения этого числа. Кислород, с шестью электронами на внешней оболочке, переходит в наиболее устойчивое состояние, когда приобретает два дополнительных электрона, которые делит с другими атомами, и поэтому образует до двух ковалентных связей. Азот, с пятью внешними электронами, образует самое большее три ковалентные связи, тогда как углерод, с четырьмя внешними электронами, образует до четырех ковалентных связей и, таким образом, делит с другими атомами четыре пары электронов (см. рис. 2.4).
Когда один атом образует ковалентные связи с несколькими другими, эти связи определенным образом ориентированы друг относительно друга в пространстве, что отражает ориентацию орбит обобществленных электронов. Поэтому ковалентные связи такого атома, помимо длины связи и энергии связи, характеризуются определенным углом связи (рис. 2.8). Четыре ковалентные связи, которые может образовывать атом углерода, например, расположены так, будто указывают на четыре угла правильного тетраэдра. Точная ориентация ковалентных связей составляет основу трехмерной геометрии органических молекул.
Рис. 2.8. Геометрия ковалентных связей. а) Пространственное расположение ковалентных связей, которыемогутбытьобразованыкислородом,азотомиуглеродом.б)Молекулы,образованныеизэтих атомов,имеютточнуютрехмернуюструктуру,представленнуюздесьввидемоделейизшарикови палочекнапримереводыипропана.
Структура молекулы воды может задаваться углами и длинами всех ее ковалентных связей. Атомы окрашены согласно следующей общепринятой системе обозначений: H — белый; C — черный; O —
красный;N—синий.
2.1.4. Существуют различные типы ковалентных связей
Большей частью ковалентные связи основаны на обобществлении двух электронов — по одному от каждого из участвующих атомов; такие связи называют оди-

Глава 2. Химия клетки и биосинтез 77
Рис. 2.9. Сравнение двойной и одинарной углеродной-
углероднойсвязи.а)Молекулаэтанасодинарнойковалентной связью между двумя атомами углерода иллюстрирует тетраэдрическое расположение одинарных ковалентных связей, об- разованныхуглеродом.КаждаяиздвухCH3-групп,соединенных ковалентной связью, может поворачиваться относительно другой вокруг оси связи. б) Двойная связь между двумя атомами углерода в молекуле этена (этилена) видоизменяет геометрию связеймеждуатомамиуглерода,выстраиваявсеатомыводной плоскости(синий);двойнаясвязьпрепятствуетвращениюодной группыCH2 относительнодругой.
нарными связями. Некоторые ковалентные связи, однако, образуются за счет обобществления более одной пары электронов. Например, могут быть обобществлены четыре электрона, по два от каждого
участвующего атома; такая связь называется двойной связью. Двойные связи короче и прочнее, чем одинарные, и оказывают характерное влияние на трехмерную геометрию молекул, их содержащих. Одинарная ковалентная связь между двумя атомами, как правило, допускает вращение одной части молекулы относительно другой вокруг оси связи. Двойная связь препятствует такому вращению, обусловливая более жесткую и менее гибкую структуру (рис. 2.9 и приложение 2.1,
стр. 172–173).
В некоторых молекулах электроны подлежат дележу между тремя и более атомами, в результате чего образуются связи, которые имеют гибридный характер – промежуточный между одинарными и двойными связями. Например, очень устойчивая молекула бензола состоит из кольца, образованного шестью атомами углерода, в котором электроны распределены равномерно (хотя обычно их изображают в виде чередующейся последовательности одинарных и двойных связей, как показано в приложении 2.1).
Когда атомы, соединенные одинарной ковалентной связью, принадлежат разным элементам, эти два атома обычно притягивают поделенные электроны с разной силой. По сравнению с атомом углерода, например, атомы O и N притягивают электроны сильнее, тогда как атом H — немного слабее. По определению, полярная (в электрическом смысле) структура — это структура, в которой на одном конце сосредоточен положительный заряд (положительный полюс), а на другом конце – отрицательный заряд (отрицательный полюс). Поэтому ковалентные связи, в которых электроны распределены подобным образом, на-
зывают полярными ковалентными связями (рис. 2.10). Например, ковалентная связь между кислородом и водородом, O–H, или между азотом
и водородом, N–H, является полярной, тогда как в связи между углеродом и водородом, C–H, электроны притягиваются обоими атомами почти одинаково и связь почти неполярна.
Рис. 2.10. Полярные и неполярные ковалентные связи. Сравнение картин рас-
пределенияэлектроноввполярноймолекулеводы(H2O)инеполярноймолекуле кислорода(O2) (δ+ —частичноположительныйзаряд;δ– —частичноотрицатель- ныйзаряд).
