
Volume1
.pdf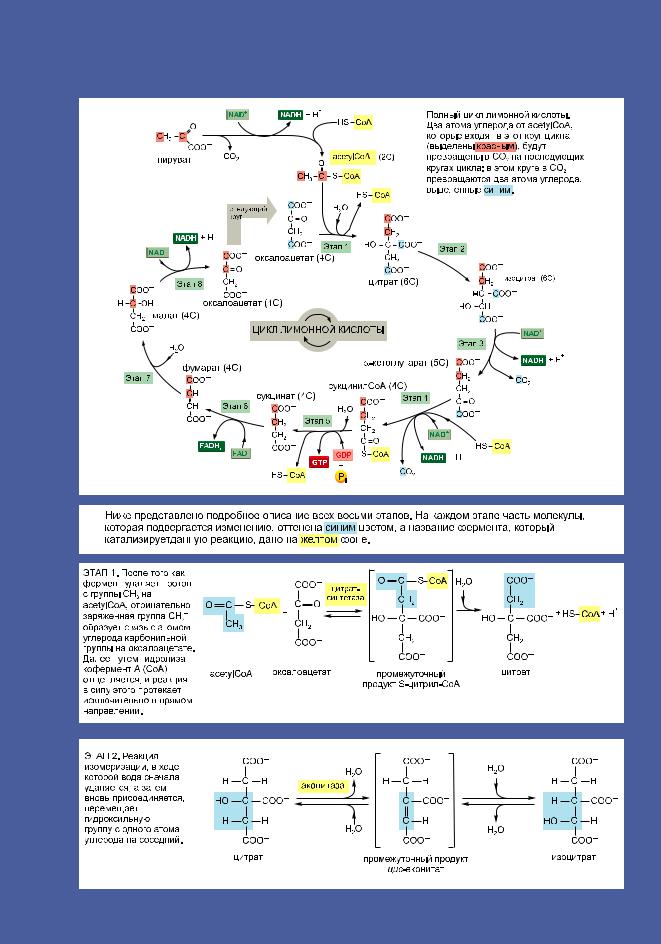
188 Приложение 2.9. Полный цикл лимонной кислоты
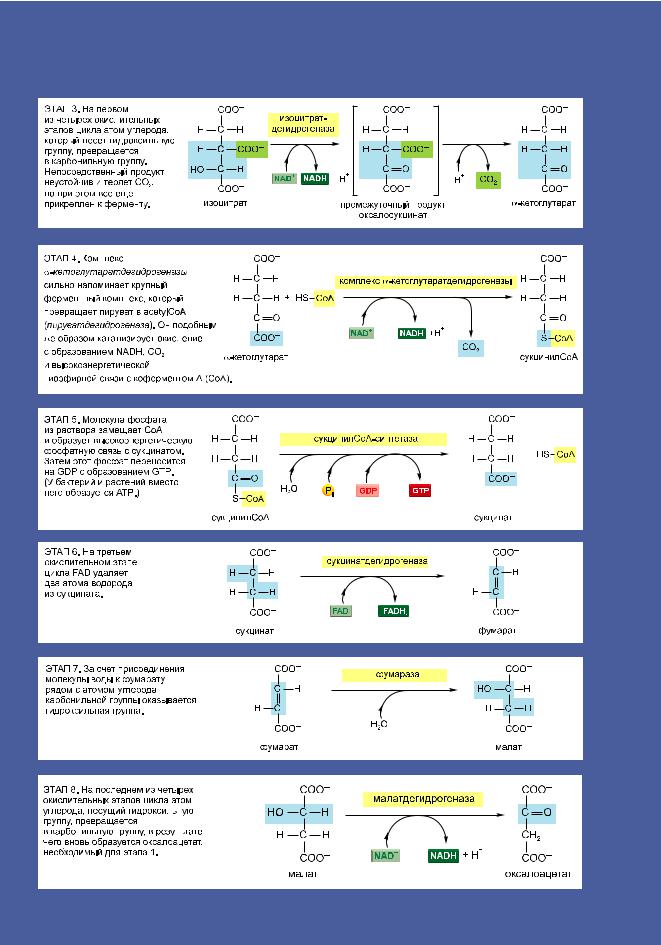
Приложение к главе 2 189

3
Белки
Когда мы смотрим на клетку через микроскоп или анализируем ее электрическую или биохимическую активность, мы, в сущности, наблюдаем за белками. Белки составляют основную долю сухой массы клетки. Они не только служат стандартными компоновочными блоками клетки, но и выполняют почти все ее функции. Так, ферменты обеспечивают клетку замысловатым молекулярным «ландшафтом», где, как истоки рек, «берут начало» многочисленные химические реакции. Белки, погруженные в плазматическую мембрану, образуют каналы и насосы, которые управляют прохождением маленьких молекул в клетку и из нее. Другие белки несут сообщения от одной клетки к другой или работают интеграторами сигналов, пересылая группы сигналов внутрь клетки – от плазматической мембраны к ядру. А есть такие, которые служат крошечными молекулярными машинами с подвижными органами: кинезин, например, проталкивает органеллы через цитоплазму; топоизомераза может распутать спутавшиеся молекулы ДНК. Некоторые специализированные белки функционируют как антитела, токсины или гормоны; есть белки – молекулы антифриза, эластические волокна, канаты или источник люминесценции. Прежде чем мы утвердимся в надежде постичь принципы работы генов, механизмы сокращения мышц, природу нервных импульсов, таинство развития эмбриона или узнать, как работает наше тело, мы должны глубоко понять то, что объединяет все эти процессы, – это белки.
3.1. Форма и структура белков
С химической точки зрения белки, безусловно, являются наиболее сложными по структуре и выполняют наиболее замысловатые функции по сравнению со всеми прочими известными молекулами. Возможно, это не покажется удивительным, если представить, что структура и химия каждого белка развивались, тонко настраивались и отлаживались на протяжении миллиардов лет истории эволюции. И все же даже искушенных специалистов не может не удивлять необычайная многогранность белков.
Вэтом параграфе мы рассмотрим, как местоположение каждой аминокислоты
вдлинной цепи аминокислот, которая и образует белок, определяет его трехмерную структуру. Далее в этой главе, на фоне полученных представлений о строении белка на атомном уровне, мы опишем, как точная форма каждой молекулы белка определяет ее функцию в клетке.
3.1.1. Форма белка определяется последовательностью входящих в его состав аминокислот
Белки собираются из 20-ти различных аминокислот, каждая из которых характеризуется своими химическими свойствами. Молекула белка состоит из длинной цепи этих аминокислот, связанных между собой ковалентными пептидными связями.

Глава 3. Белки 191
Белки поэтому известны также под названием полипептидов. Каждому типу белка свойственна уникальная последовательность аминокислот, и существует много тысяч различных белков, причем каждому присуща своя собственная специфическая последовательность аминокислот.
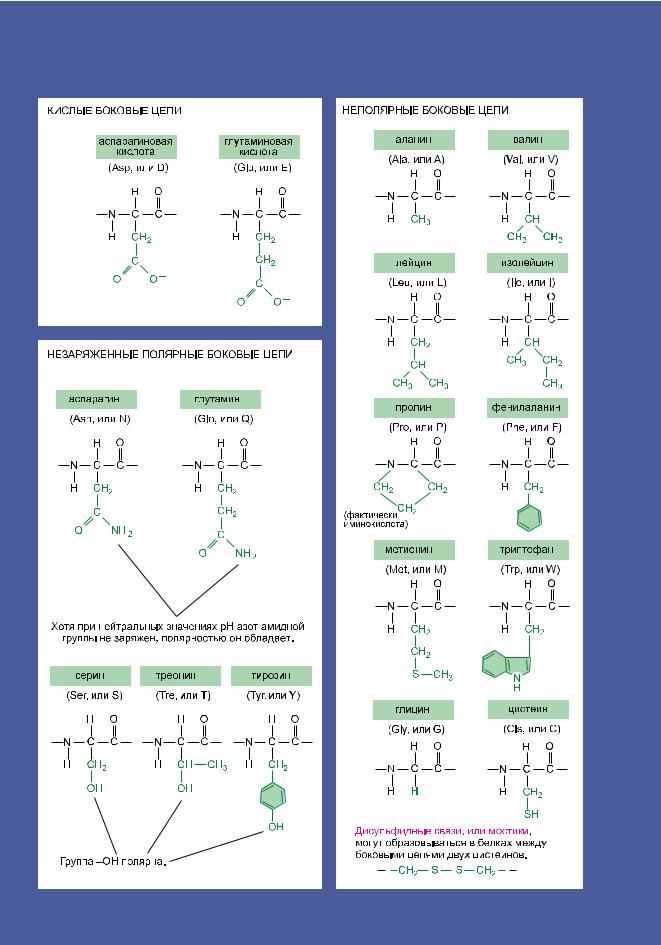
Повторяющаяся последовательность атомов, образующая стержень полипептидной цепи, называется полипептидной основной цепью (полипептидным остовом). К этой цепи из повторяющихся звеньев прикреплены те группы, которые не участвуют в создании пептидной связи, но придают аминокислотам их уникальные свойства: 20 различных боковых цепей аминокислот (рис. 3.1). Некоторые из этих боковых цепей неполярны и гидрофобны («боящиеся воды»), другие отрицательно или положительно заряжены, некоторые легко образуют ковалентные связи и так далее. В приложении 3.1 (стр. 194–195) показаны их атомные структуры, а на рис. 3.2 приведены их полные и сокращенные названия.
Как было сказано в главе 2, атомы ведут себя подобно твердым шарам с определенным радиусом (ван-дер-ваальсов радиус). Выполнение требования, что никакие два атома не должны перекрываться, значительно ограничивает возможные углы связей в полипептидной цепи (рис. 3.3). Это условие и другие стерические взаимодействия накладывают строгие ограничения на число возможных вариантов трехмерного расположения атомов (или конформацию). Тем не менее длинная гибкая цепь типа белка может все же сворачиваться огромным числом способов.
Кроме того, сворачивание белковой цепи (фолдинг) определяется множеством слабых нековалентных связей, которые образуются между различными участками цепи. В них участвуют как атомы основной полипептидной цепи, так и атомы боковых цепей аминокислот. Известно три типа слабых связей: водородные связи,
силы электростатического притяжения и ван-дер-ваальсовы силы, о чем было сказано в главе 2 (см. разд. 2.1.8). Отдельные нековалентные связи в 30–300 раз слабее типичных ковалентных связей, определяющих целостность биологических молекул. Но множество слабых взаимодействий, действующих вместе, может прочно скрепить две области полипептидной цепи друг с другом. Вот так объединенная сила большого числа таких нековалентных взаимодействий определяет устойчивость каждой по-своему скрученной формы (рис. 3.4).
Четвертая «слабая сила» также играет ведущую роль в формировании пространственной структуры белка. Как было описано в главе 2, гидрофобные молекулы, а в их числе и неполярные боковые цепи определенных аминокислот, имеют тенденцию притягиваться друг к другу в водной среде, что минимизирует их разрушающее действие на стянутую водородными связями сеть молекул воды (см. разд. 2.1.8 и приложение 2.2, стр. 174–175). Поэтому важный фактор, управляющий фолдингом любого белка, — это распределение его полярных и неполярных аминокислот. Неполярные (гидрофобные) боковые цепи в белке — таких аминокислот, как фенилаланин, лейцин, валин и триптофан, — стремятся группироваться во внутренней части молекулы (так же как и гидрофобные капельки масла объединяются в воде и образуют одну большую каплю). Это позволяет им избежать контакта
сводой, которая окружает их в клетке. В отличие от них, полярные группы — те, что принадлежат, например, аргинину, глутамину и гистидину, — как правило, устраиваются поближе к поверхности, где они могут образовывать водородные связи
сводой и другими полярными молекулами (рис. 3.5). Полярные аминокислоты, погруженные внутрь белка, обычно соединены водородными связями с другими полярными аминокислотами или с основной цепью полипептида.
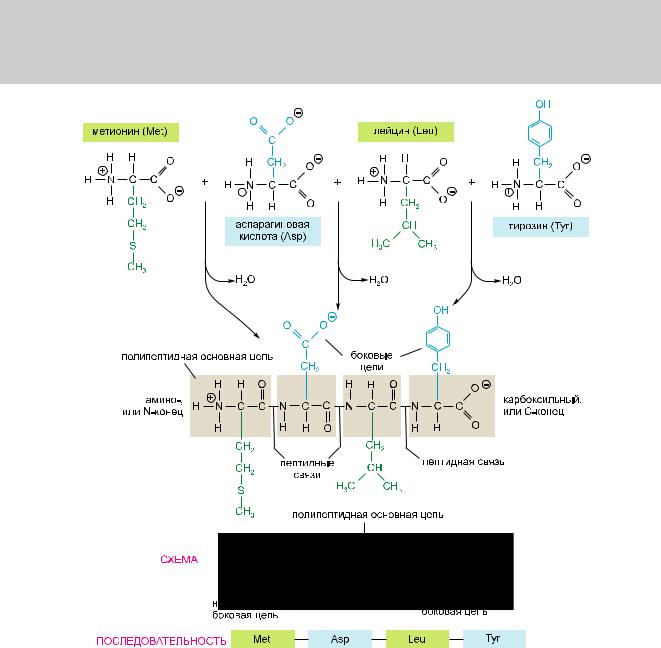
192 Часть 1. Введение в мир клетки
Рис. 3.1. Составные части белка. Белок состоит из полипептидной основной цепи и присоединенных кнейбоковыхцепей.Белкиразныхтиповотличаютсямеждусобойпопоследовательностиичислуаминокислот;поэтомуименнопоследовательностьхимическиразличныхбоковыхцепейпридаеткаждому белкуегонеповторимыекачества.Дваконцаполипептиднойцепихимическиразличны:конец,несущий свободную аминогруппу (NH3+, также записывается как NH2), называют аминоконцом, или N-концом, атот,чтонесетсвободнуюкарбоксильнуюгруппу(COO–,такжезаписываемуюввидеCOOH),величают карбоксильнымконцом,илиC-концом.Аминокислотнуюпоследовательностьбелкавсегдапредставляют внаправленииN→Cичитаютслеванаправо.
3.1.2. В результате фолдинга белок принимает конформацию
сминимальной энергией
Врезультате всех вышеперечисленных взаимодействий большинство белков принимает специфическую трехмерную структуру, которая предопределена поряд-
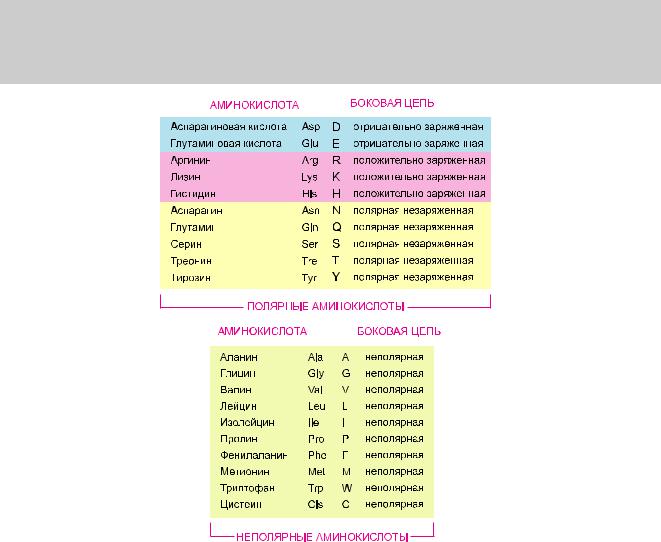
Глава 3. Белки 193
Рис. 3.2. Двадцать аминокислот, из которых построены белки. Каждой аминокислоте соответствует определенноетрехбуквенноеиоднобуквенноеобозначения.Аминокислотсполярнымицепямистолько же, как и с неполярными; однако некоторые боковые цепи, приведенные здесь как полярные, достаточновелики,поэтомуобладаютинекоторыминеполярнымисвойствами(например,Tyr,Tre,Arg,Lys). Структурыаминокислотможнонайтивприложении3.1(стр.194–195).
ком расположения аминокислот в их цепях. В конечном счете, любая полипептидная цепь, как правило, принимает такую форму, или конформацию, в которой ее свободная энергия будет минимальной. Биологи изучали фолдинг белка в пробирке, используя высокоочищенные белки. В результате обработки некоторыми растворителями, которые разрушают нековалентные связи, удерживающие цепь в свернутом состоянии, белок разворачивается, или денатурирует. Подобная обработка преобразует белок в гибкую полипептидную цепь, утерявшую свою естественную форму. После удаления денатурирующего агента белок в большинстве случаев вновь самопроизвольно сворачивается, или ренатурирует, в первоначальную конформацию (рис. 3.6). Это указывает на то, что последовательность аминокислот содержит всю необходимую информацию, определяющую трехмерную структуру белка, что является важным моментом для понимания его функции в клетке.

194 Приложение 3.1. 20 аминокислот, образующих белки
Приложение к главе 3 195

196 Часть 1. Введение в мир клетки
Рис. 3.3 Стерические ограничения на углы связей в полипептидной цепи. а) Каждая аминокислота
«привносит»восновнуюцепьполипептидатрисвязи(обозначеныкраснымцветом).Пептиднаясвязь лежитводнойплоскости(выделенасерымфоном) инедопускаетвращения.Новращениеможетпроис- ходитьвокругосисвязиСα–С,уголвращениякоторойназываютгреческойбуквой«пси»(ψ),ивокругоси связиN–Cα,уголвращениякоторойназывают«фи»(j).Подоговоренности,боковыецепиаминокислот частообозначаюткакR-группы(показанызеленымикружками).
б) Конформация атомов в основной цепи молекулы белка определяется всеми парами углов вращения j и ψ — по паре от каждой входящей в цепь аминокислоты; из-за пространственных затруднений впределахкаждойаминокислотывращениявокругуказанныхсвязейограничены,ипоэтомубольшого разнообразия в парах углов j и ψ не возникает. На этой так называемой карте Рамачандрана каждая точкапредставляетсобойпарууглов,наблюдаемуювбелке.Группаточеквнижнемлевомсекторедает представлениеовсехаминокислотах,которыерасположенывструктурахтипаα-спирали(см.рис.3.7,а). (ИзображениенавидебзаимствованоизJ. Richardson,Adv.Prot.Chem.34:174–175,1981.Сразрешения издательстваAcademicPress.)
Каждый белок обычно сворачивается в единственно возможную устойчивую конформацию. Однако при взаимодействии белка с другими молекулами клетки его конформация несколько меняется. Как мы увидим позже, такое изменение формы нередко оказывает огромной влияние на функцию белка.
Хотя белковая цепь и способна свернуться в свою правильную конформацию без какой-либо внешней помощи, в этом процессе часто участвуют специальные белки, названные молекулярными шаперонами. Этим молекулярные «наставники» связывают

Глава 3. Белки 197
Рис.3.4.Свернутьсябелкупомогаютнековалентныесвязитрехтипов.Хотякаждаятакаясвязьсамапо себевесьмаслаба,еслиониобразуютсяодновременноивбольшомколичестве,какэточастоибывает, тосоздаетсяпрочнаяструктура,каквпредставленномпримере.Какинапредыдущемрисунке,боковые цепиаминокислотобозначенывобщемвидебуквойR.
Рис. 3.5. Как белок принимает компактную конформацию. Полярные боковые цепи аминокислот, как правило,расположенынавнешнейсторонебелка,гдеонимогутвзаимодействоватьсводой;неполярные боковыецепиаминокислотпогруженывнутрьиобразуютплотноупакованноегидрофобноеядро,которое спрятаноотводы.Наэтомсхематическомрисункебелоксодержитвсеголишьоколо30-тиаминокислот.
частично свернутые полипептидные цепи и помогают им продвигаться по наиболее энергетически благоприятному пути фолдинга. В стесненных условиях цитоплазмы,
