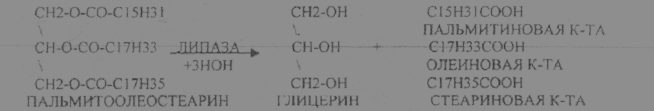- •Экзаменационные вопросы/ответы на экзамен по биохимии для стоматологического факультета 2012 года
- •1. Биохимия, ее задачи. Значение биохимии для медицины. Современные биохимические методы исследования.
- •2. Аминокислоты, их классификация. Строение и биологическая роль аминокислот. Хроматография аминокислот.
- •Фолдинг белка. Шапероны.
- •4. Электро-химические свойства белков как основа методов их исследования. Электрофорез белков крови.
- •5. Принципы классификации белков. Характеристика простых белков. Характеристика гистонов и протаминов.
- •6. Хромопротеины. Строение и функции гемоглобина. Типы гемоглобинов. Миоглобин.
- •7. Углевод-белковые комплексы. Строение углеводных компонентов. Гликопротеины и их протеоглиганы.
- •8. Современные представления о структуре и функциях нуклеиновых кислот. Первичная и вторичная структуры днк. Строение мономеров нуклеиновых кислот
- •9. Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его строение. Роль металлов в ферментативном катализе, примеры.
- •10. Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов.
- •11. Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз. Примеры реакций с участием оксидоредуктаз
- •12. Современные представления о механизме действия ферментов. Стадии ферментативной реакции, молекулярные эффекты, примеры.
- •13. Ингибирование ферментов. Конкурентное и неконкурентное ингибирование, примеры реакций. Лекарственные вещества как ингибиторы ферментов.
- •3.Субстратное ингибирование
- •15. Обмен веществ и энергии. Этапы обмена веществ. Общий путь катаболизма. Катаболизм пирувата.
- •16. Цитратный цикл, его биологическое значение, последовательность реакций.
- •22. Сопряжение реакций цикла трикарбоновых кислот с дыхательной цепью ферментов. Написать эти реакции.
- •17.Современные представления о биологическом окислении. Над-зависимые дегидрогеназы. Строение окисленной и восстановленной форм над.
- •18. Компоненты дыхательной цепи и их характеристика. Фмн и фад-зависимые дегидрогеназы. Строение окисленной и восстановленной форм фмн.
- •20. Пути синтеза атф. Субстратное фосфорилирование (примеры). Молекулярные механизмы окислительного фосфорилирования (теория Митчелла). Разобщение окисления и фосфорилирования.
- •1.Мембрана митохондрий не проницаема для протонов.
- •2.Образуется протонный потенциал в процессе транспорта электронов и протонов.
- •3.Обратный транспорт протонов в матрикс сопряжен с образованием атф.
- •21. Потребность человека в белках. Незаменимые аминокислоты. Биологическая ценность белков. Роль белков в питании.
- •22.Превращение белков в органах пищеварительной системы.
- •23. Гниение белков и аминокислот в кишечнике. Пути образования продуктов гниения. Примеры.
- •24. Механизм обезвреживания продуктов гниения белков. Роль фафс и удф-гк в этом процессе (конкретные примеры).
- •25. Переаминирование и декарбоксилирование аминокислот. Химизм процессов, характеристика ферментов и коферментов. Образование амидов.
- •26.Декарбоксилирование аминокислот,роль витамина в6.Образование биогенных аминов
- •27. Дезаминирование аминокислот. Виды дезаминирования. Окислительное дезаминирование. Непрямое дезаминирование аминокислот на примере тирозина.
- •28. Синтез мочевины (орнитиновый цикл), последовательность реакций. Биологическая роль.
- •29. Особенности обмена пуриновых нуклеотидов. Их строение и распад. Образование мочевой кислоты. Подагра.
- •30.Генетический код
- •31. Механизмы репликации днк (матричный принцип, полуконсервативный способ). Условия, необходимые для репликации. Этапы репликации
- •32. Биосинтез рнк (транскрипция). Условия транскрипции.
- •33.Этапы транскрипции
- •34. Биосинтез белка. Этапы трансляции и их характеристика. Белковые факторы биосинтеза белка. Энергетическое обеспечение биосинтеза белка.
- •35. Строение оперона. Регуляция биосинтеза белка у прокариотов. Функционирование лактозного и гистидиновых оперонов.
- •36. Особенности и уровни регуляции биосинтеза белка у эукариотов. Амплификация генов, энхансерные и сайленсерные элементы.
- •38. Виды молекулярных мутаций и их метаболические последствия.
- •39. Основные углеводы организма человека, их строение и классификация, биологическая роль.
- •40. Роль углеводов в питании. Переваривание и всасывание углеводов в органах пищеварительной системы. Написать реакции. Непереносимость дисахаридов.
- •41. Биосинтез и распад гликогена в тканях. Биологическая роль этих процессов. Гликогеновые болезни.
- •42. Катаболизм глюкозы в анаэробных условиях. Химизм процесса, биологическая роль.
- •43. Катаболизм глюкозы в тканях в аэробных условиях. Гексозодифосфатный путь превращения глюкозы и его биологическая роль. Эффект Пастера.
- •44. Гексозомонофосфатный путь превращения глюкозы в тканях и его биологическая роль.
- •45. Пути образования глюкозы в организме. Глюконеогенез. Возможные предшественники, последовательность реакций, биологическая роль.
- •46. Характеристика основных липидов организма человека, их строение, классификация, суточная потребность и биологическая роль.
- •47. Биологическая ценность липидов пищи. Переваривание, всасывание и ресинтез липидов в органах пищеварительной системы.
- •48. Характеристика липопротеинов крови, их биологическая роль. Роль липопротеинов в патогенезе атеросклероза Коэффициент атерогенности крови и его клинико- диагностическое значение.
- •49. Окисление высших жирных кислот в тканях. Окисление жирных кислот с нечетным числом углеродных атомов, энергетический эффект.
- •66. Окисление глицерина в тканях. Энергетический эффект этого процесса.
- •67. Биосинтез высших жирных кислот в тканях. Биосинтез жиров в печени и жировой ткани.
- •51. Холестерол. Его химическое строение, биосинтез и биологическая роль. Причины гиперхолестеринемии.
- •78. Витамин в6 и pp. Роль в обмене аминокислот, примеры реакций, строение.
- •82. Биотин, пантотеновая кислота, их роль в обмене веществ.
- •55. Механизм действия липофильных сигнальных молекул. Механизм действия nо. Действие сигнальных молекул через тирозинкиназные рецепторы. Принципы иммунноферментного анализа уровня сигнальных молекул.
- •57. Гормоны передней доли гипофиза, классификация, их химическая природа, участие в регуляции процессов метаболизма. Семейство пептидов проопиомеланокортина.
- •58. Гормоны задней доли гипофиза, место их образования, химическая природа, влияние на функции органов-мишеней.
- •59. Инсулин, схема строения, участие в регуляции метаболических процессов. Специфика в действии на рецепторы органов мишеней, инсулиноподобные факторы роста (ифр)
- •61. Тиреоидные гормоны, место их образования, строение, транспорт и механизм действия на метаболические процессы.
- •62. Тиреокальцитонин, паратиреоидный гормон. Химическая природа, участие в регуляции обмена веществ.
- •91. Глюкагон и соматостатин. Химическая природа. Влияние на обмен веществ.
- •63. Участие адреналина в регуляции обмена веществ. Место выработки. Структура адреналина,механизм его гормонального действия, метаболические эффекты.
- •64. Кортикостероидные гормоны. Структура, механизм действия, их роль в поддержании гомеостаза. Участие глюкокортикоидов и минералокортикоидов в обмене веществ.
- •65. Гормоны половых желез: эстрадиол и тестостерон, их строение, механизм действия и биологическая роль.
- •95. Простаноиды - регуляторы обмена веществ. Биологические эффекты простаноидов и химическая природа.
- •66. Межклеточный матрикс, его компоненты, функции. Характеристика коллагена, его строение. Полиморфизм коллагеновых белков.
- •67. Этапы синтеза и созревания коллагена. Роль ферментов и витаминов в этом процессе. Катаболизм коллагена.
- •68. Особенности строения и функции эластина. Неколлагеновые структурные белки: фибронектин и ламинин.
- •69. Гликозаминогликаны. Строение, функции.
- •70. Протеогликаны межклеточного матрикса, их состав, функции. Образование надмолекулярных комплексов. Метаболизм протеогликанов.
9. Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его строение. Роль металлов в ферментативном катализе, примеры.
Ферменты - это биологические катализаторы белковой природы. Ферменты начинают своё каталитическое действие в ЖКТ, продолжают его в тканях, на этапе выведения и образования конечных продуктов. Все реакции в организме ферментативные.
1. Повышают скорость реакции.
2. В реакциях они не расходуются.
3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом.
ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ.
1 .Ферменты обладают более высокой эффективностью действия.
2.Ферменты чувствительны к температуре (ТЕРМОЛАБИЛЬНЫ)
3.Ферменты чувствительны к значениям РН среды.
4.Ферменты обладают высокой специфичностью действия.
5.Ферменты - это катализаторы с регулируемой активностью.
Ферменты, как и все функциональные белки, могут быть простыми и сложными. Простые ферменты представлены только белковой частью (состоят из АК) - ПЕПСИН, ТРИПСИН, ФОСФАТАЗЫ. В структурном отношении имеют 3 уровня организации.
Сложные ферменты представлены:
1 .Белковой частью (состоит из АК) - АПОФЕРМЕНТ;
2.Небелковой частью - КОФАКТОР.
Выделяют 2 основных КОФАКТОРА:
А. Ионы металлов (К, Na, Ca, Mg, Mn) большинство всех ферментов являются МЕТАЛЛОФЕРМЕНТАМИ. В продуктах питания должны обязательно содержаться микроэлементы.
В. КОФЕРМЕНТЫ - низкомолекулярные органические вещества не белковой природы.
Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. АКТ. Ц обычно располагается в гидрофобном углублении , изолируя субстрат от воды. В образовании АКТ. Ц, участвуют боковые группы АК (12-20 АК), причём эти АК могут находиться на разных участках ПОЛИПЕПТИДНОЙ цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы: NH2 (АРГ,ЛИЗ), СООН (АСП, ГЛУ), SH (ЦИС), ОН (СЕР,ТРЕ), ИМИДАЗОЛ (ГИС), ГУАНИДИНО-группа..
Контактный участок -это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту.
Каталитический участок - место, где проходит сама каталитическая реакция.
Свойства ферментов. Лабильность конформации, влияние температуры и рН среды. Специфичность действия ферментов, примеры реакций.
СВ-ВА ФЕРМЕНТОВ.
1 .Высокая каталитическая активность. УРЕАЗА повышает скорость реакции в 10 раз.
2.Ферменты проявляют ТЕРМОЛАБИЛЬНЫЕ свойства - чувствительность к изменению температуры. При повышении температуры на каждые 10 градусов, скорость ферментативных реакций повышает в 1,5-2 раза (правило ВАНТ - ГОФФА). Уже при 50-60 градусах наблюдается денатурация, а при 100 гр. - полная денатурация с потерей активности. При понижении температуры структура его сохраняется, поэтому при последующем повышении Т. активность восстанавливается. Температура, при которой фермент проявляет максимальную активность, называется ОПТИМАЛЬНОЙ.
3.Ферменты чувствительны к изменениям РН среды. Ферменты с оптимальными значениями РН в нейтральной среде - КАТАЛАЗа РН=7, в кислой среде (пепсин РН=1,5-2,5), в щелочной среде (АРГИНАЗА РН=10-11). Изменение РН приводит к конформационной перестройке не только активного центра, но и всей молекулы фермента. При оптимальном значении РН функциональные группы активного центра находятся в наиболее реакционно-способном состоянии.
4.Специфичность действия ферментов. Различают следующие виды специфичности:
А) Абсолютная специфичность. Ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты. УРЕАЗА ГИДРОЛИЗУЕТ МОЧЕВИНУ.
В) СТЕРИОСПЕЦИФИЧНОСТЬ. Ей обладают ферменты, действующие на пространственные или стереоизомеры. ЦИС и ТРАНС изомеры; оптические изомеры (ЭНАНТИОМЕРЫ).
С) Групповая специфичность. Ей обладают ферменты, которые катализируют реакции сходных по строению субстратов. Пример: ЛИПАЗА - участвует в расщеплении ЛИПИДОВ. ПЕПТИДАЗЫ действуют на субстраты с ПЕПТИДНЫми связями.