
- •Изопроцестер: 3
- •21.Қайтымсыз машиналардың пәкі қайтымды машиналардың пәкінен кіші
- •29.Диэлектрик ток өткізбейтің зат.
- •30. Электрлік ығысу оны d әрпі арқылы белгілейді де электрлік ығысу (немесе электрлік индукция) д.А. Сонымен электрлік ығысу (электрлік индукция) деп өрнегімен анықталатын қатысты айтады.
екінші
постулатн қолданамыз, жарық жылдамдығы
екі жүйедеде бірдей, онда x=ct,
![]() теңдеулерді
теңдеулерді
![]() қатысты шешейік
қатысты шешейік
![]() ,
,
![]() ,
,
![]() ,
,
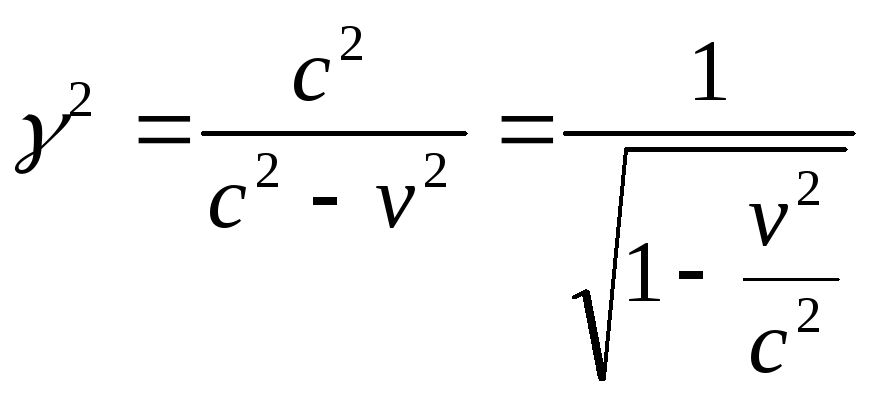 ,
,
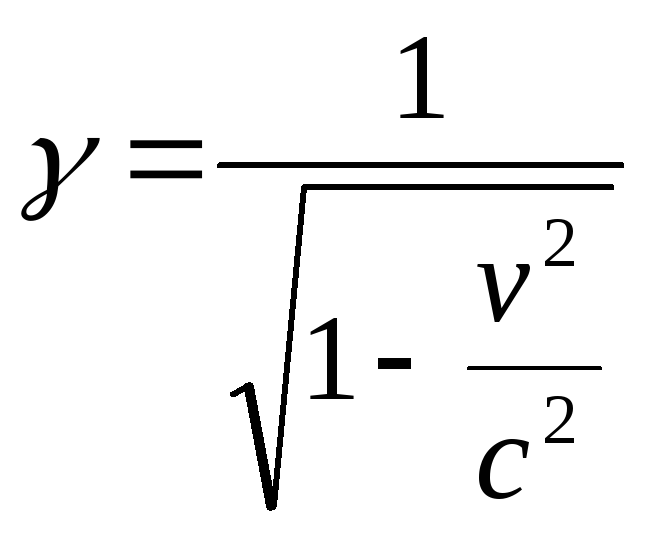 бұдан егер
бұдан егер
![]() ,
,
![]() онда
онда
 ,
,
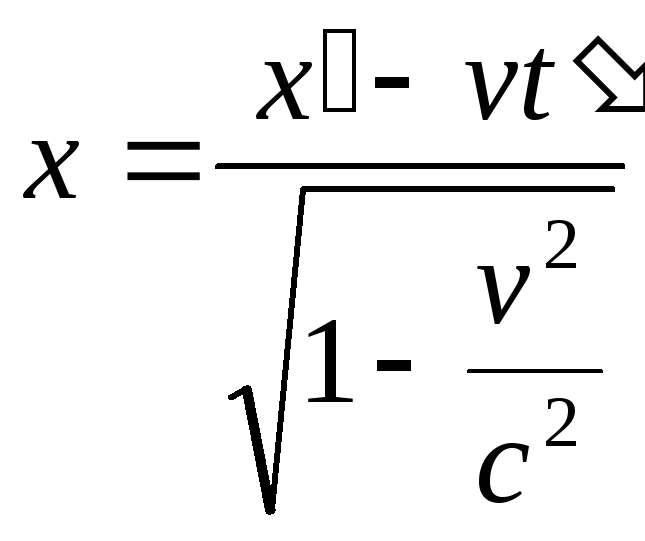 ,
,
![]() ,
,
![]()
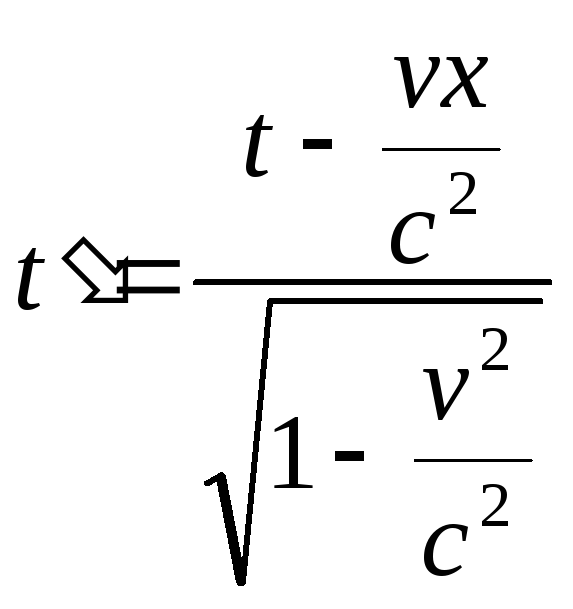 ,
,
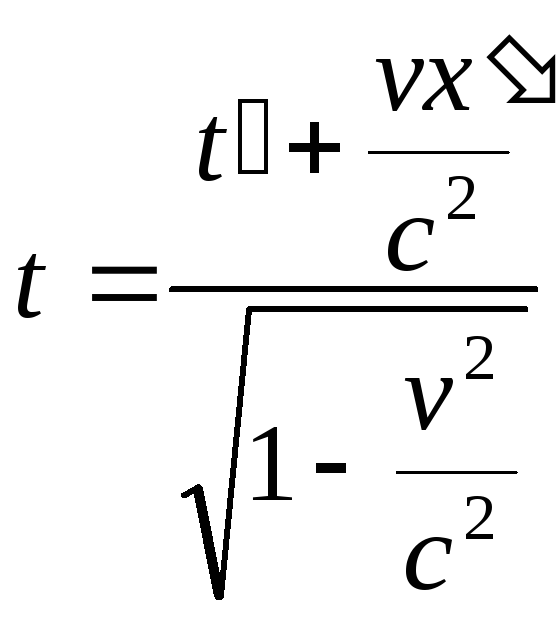
Лоренц түрлендірулері.
Егер
![]() болса, онда Лоренц түрлендірулері
Галилей түрлендірулеріне айналады.
болса, онда Лоренц түрлендірулері
Галилей түрлендірулеріне айналады.
-
Динамиканың негізгі міндеті материлық нүктенің бастапқы күйін ( бастапқы уақыттағы координаттары мен жылдамдығы) және түсірілген күшті біле отырып алдағы уақыттағы күйлерін есептеу.
Инерттілік дененің басқа денелермен әсерлескенде жылдамдығы әр түрлі өзгеру қасиеті.
Масса
скалярлық
шама ілгерілемелі қозғалған дененің
инерттілік өлшеушісі.Дене неғұрлым
инертті болса, массасы көп болады.Дененің
массасы оның құрайтың бөлшектердің
қосындысына тең.![]()
Күш веторлық шама әсерлесу кезіндегі бір дененің екінші денеге тигізетін әсерін сиппаттайды.Күштердің тәуелсіздік принципі егер денеге бірнеше күштер әсер етсе, онда қорытқы күші осы күштердің векторлық қосындыларымен анықталады.
![]()
Энергия
мен импульс арасындағы байланыс
![]()
-
МКТ ның негіздері (МКТ) статистикалық тәсілі арқылы газдың физикалық қасиеттерін зерттейтін теория. Молекула кинетикалық теорияның негізі : 1.жүйедегі бөлшектер үшін импульстың, импульс моменттінің, энергиясының, зарядтың сақталу заңдары орындалады және бөлшектер саны тұрақты. 2. бөлшектердің бір бірінен айыра аламыз. 3. жүйеде өтетін физикалық процестер кеңістік және уақыт бойынша үздіксіз мәндерге ие болады. 4. кез келген бөлшек басқа бөлшектерге тәуелсіз координата мен жылдамдық мәндеріне ие болады.
МКТ-нын негізгі теңдеуі газ күйін сипаттайтын параметрлер мен олекулалардың ілгерілемелі кинетикалық энергиясының арасындағы байланыс. Негізгі теңдеуін қорытып шығару үшін қарапайым идеал газын қарастырайық. Ол үшін молекулалардың ыдыс қабырғаларын соғуының нәтижесінде пайда болатын қысымды есептейік. Газ молекулалары куб тәріздес ыдыс ішінде хаосты қозғалсын.
14. Термодинамиканың параметрлері деп физикалық күйін сипаттайтын физикалық шамаларды айтады.
Жүйенің ішкі энергиясы молекулалардың ретсіз қозғалысының кинетикалық энергиясы, молекулалардың өзара әсерлесуінші потенциялық энергиясы және ішкі молекулалық энергиясы кіреді. Ішкі энергия жүйе күйінің функциясы болып табылады.
Жүйеге істелген жұмыс (А) сыртқы денелердің жұйеге берген энергиясы.
Жылу мөлшері (Q) жылу алмасу процесінде сыртқы денелерді жүйеге беретін энергиясы.
Ішкі энергия негізінен екі түрлі процесте өзгереді: дененің немесе денеге қарсы сыртқы күштің А жұмыс істеуімен және денеге беретін немесе алынатын Q жылу мөлшері есебінен.
Тепе теңдік күйлер сыртқы орта өзгермеген жағдайда жүйенің параметрлік мәндері қанша қажет болса, сонша тұрақты болып қалатын күйді айтады.
Изопроцестер: 3
Изотермиялық: Бойль Мариотт заңы T=const идеал газдың берілген массасының қысымының көлеміне көбейтіндісі PV=const T=const m=const тұрақты болып қалады.
тұрақты температурада өтетін процесс (изо-равный, термо-теплый) T=const (тұрақты темпераурада) жұйенің параметрлерінің арасындағы тәуелділікті өрнектейтін графикті айтады.
Изобаралық:
Гей
Люссак (изобаралық процесс үшін) P=const
да идеал газ берілген массасының көлем
температурада сызықты өзгереді.
![]() p=const m=const
p=const m=const
![]() ші
цельсий бойыншы
ші
цельсий бойыншы
![]() газдың
көлемі t шкаласы бойынша температура
газдың
көлемі t шкаласы бойынша температура
![]()
![]() Тұрақты қысымда өтетін процесті
изобаралық процесс деп атайды.
Тұрақты қысымда өтетін процесті
изобаралық процесс деп атайды.
Изохоралық: Шарль заңы Түрақты V=const Идеал газдың берілген массасының қысымы температурадан сызықты өзгереді. Тұрақты көлем кезінде өтетін процесс.
15.
Статикалық таралу заңы орындалу
үшін ретсіз қозгалган молекулалар саны
орасан зор қөп болуы тиіс, ол ықтималдық
теорияға негізделген. Газ молекуласының
жылдамдықтары бойынша таралу заңын
статикалық заң дейміз. Газдың МКТ негізгі
теңтеуңн қорытып шығарғанда , жылулық
қозғалыс салдараның молекулалар әртүрлі
жылдамдықпен қозғалады. Осы жылдамдықтармен
қозғалатын молекулалар саның қарастырайық.
Мәндері V1 and V2 жылдамдықтары арасында
жататын молекулалар саны. Молекулалар
жылдамдығының бағыты мен шамасы
соқтығысуы кезінде өзгеруі кездейсоқ.
Сонымен қатар молекулалардың жылдамдықтары
оның аса ықтимал мәнінің төнірегіндн
топтасады, өйткені молекулалардың
тоқтап қалуы немесе жжылдамдығы шексіз
болуы ықтималдығы өте аз. Бұнда V=0 мен
![]() мәндеріне қарай молекулалар саны аз,
олар бір аса ықтимал
мәндеріне қарай молекулалар саны аз,
олар бір аса ықтимал
![]()
мәнінде
жатады. Берілген N молекулалар ішінен
жылдамдықтары
![]() интервалында жататын молекулалардың
иқтималдығы
интервалында жататын молекулалардың
иқтималдығы
![]() мұнда
мұнда
![]() таралу функциясы д.а. Таралу функциясын
теория жүзінде Максвелл ашты.
таралу функциясы д.а. Таралу функциясын
теория жүзінде Максвелл ашты.
![]()
![]() ,
,
![]() ,
,
![]() ,
,
![]()
16.Больцманның
таралу заңы барометрлік
формула әртүрлі биіктіктегі газ
молекуласының концентрациясының
анықтауңв мүмкіндік береді P=nkT өрнегін
қолдансақ
![]() ,
,
![]() дегі молекулалар концентрациясы, ал n
h биіктіктегі концентрациясы
дегі молекулалар концентрациясы, ал n
h биіктіктегі концентрациясы
![]() екенін ескерсек
екенін ескерсек
![]()
Больцманның
таралу заңы
![]() .
.
17.
Механикалық жүйесінің еркіндік дәрежесі
жүйе орның анықтауға мүмкіндік беретін
тәуелсіз шамалар жиынтығы. Кеңістікте
материялық нүктенің үш еркіндік дәрежесі
бар оның орны x,y,z, координаталарымен
анықталады. Абсолюттә қатты дененің
алты еркіндік дәрежесі болады, үшеуі
ілгерілемелі (x,y,z), үшеуі айналмалы (![]() ).
Егер молекула бір атомнан түрса, оны
материялық нүкте ретінде қарастырамыз,
еркіндік дәрежесә i=3. Екә атомды болса,
бір біріне байланысқан гантел ретінде
қарастырамыз i=5. Үш атомды және одан көп
молеуланы абсолютті дене ретінде
қарастырамыз i=6. Энерргияның еркіндік
дәрежелері бойынша біркелкі таралу
заңы статикалық физика заңынан кез
келген еркіндік дәрежесіне
).
Егер молекула бір атомнан түрса, оны
материялық нүкте ретінде қарастырамыз,
еркіндік дәрежесә i=3. Екә атомды болса,
бір біріне байланысқан гантел ретінде
қарастырамыз i=5. Үш атомды және одан көп
молеуланы абсолютті дене ретінде
қарастырамыз i=6. Энерргияның еркіндік
дәрежелері бойынша біркелкі таралу
заңы статикалық физика заңынан кез
келген еркіндік дәрежесіне
![]() тең орташа кинетикалық энергия сәйкес
келеді.
тең орташа кинетикалық энергия сәйкес
келеді.
Тербеліс
энергиясының орташа мәні
![]() бір моль газдың ішкі энергиясы,
молекулалардың кинетикалық энергиясынан
тұрады
бір моль газдың ішкі энергиясы,
молекулалардың кинетикалық энергиясынан
тұрады
![]()
18.Термодинамиканың
бірінші бастамасы жүйеге
берілген жылу мөлшері жүйенің ішкі
энергиясының өсімшесіне және жүйенің
сыртқы денелерде атқаратың жұмысына
тең.Егер Q>0 жылу беріледі,Q<0 жүйеден
жылу алынады,Q=0 адибаталық процесс.
![]()
Жүйе
параметрлерінің аз ғана өзгерісіне
сәйкес келетін термодинамиканың І
бастамасы мынадай түрде жазылады.
![]() .
.
Мұндағы
![]() элементар жылу мен жұмысы.dU жүйенің
ішкі энергиясының өсімшесі.
элементар жылу мен жұмысы.dU жүйенің
ішкі энергиясының өсімшесі.
Идеал газдың изопроцестеріне қолдану
Изохора
![]() ,
,![]()
Изобара
![]()
Изотерма
![]()
![]()
-
Идеал газдың жылу сыйымдылығы дененің температурасын бір Кельвинге көтеруге қажетті жылу мөлшері
 меншікті жылу сыйымдылығы бір кг заттың
температурасын бір кельвинге көтеруге
қажетті жылу мөлшері
меншікті жылу сыйымдылығы бір кг заттың
температурасын бір кельвинге көтеруге
қажетті жылу мөлшері
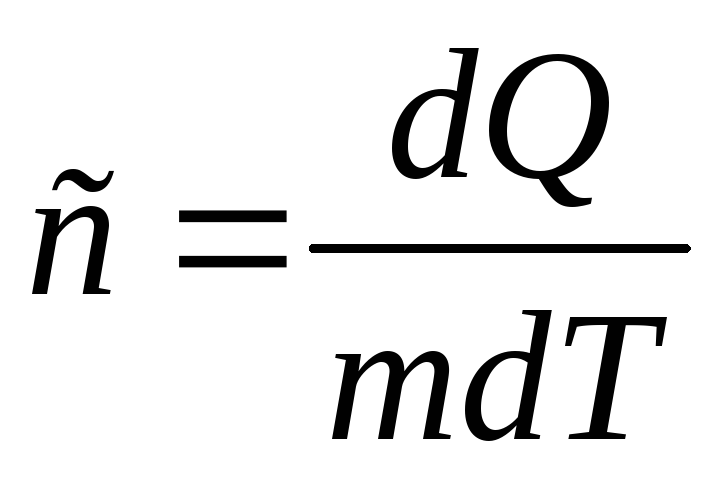 . Молярлық жылу сыйымдылығы бір моль
заттын температурасы бір кельвинге
көтеруге қажетті жылу мөлшері
. Молярлық жылу сыйымдылығы бір моль
заттын температурасы бір кельвинге
көтеруге қажетті жылу мөлшері
 .
Денені тұрақты көлемде қыздырғанда
барлық жылу ішкі энергияны арттыруға
жұмсалады, бір кило моль үшін
.
Денені тұрақты көлемде қыздырғанда
барлық жылу ішкі энергияны арттыруға
жұмсалады, бір кило моль үшін
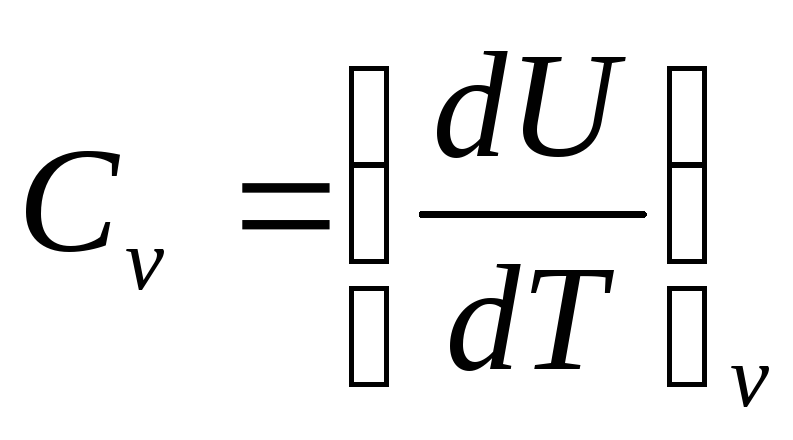 .
P=const жылу мөлшері ішкі энергияны
арттыруымен қатар дененің көлемін
ұлғайтуға қажетті жұмысқа жұмсалады
.
P=const жылу мөлшері ішкі энергияны
арттыруымен қатар дененің көлемін
ұлғайтуға қажетті жұмысқа жұмсалады
 ,
,

Изохора A=0
Изобара
![]()
Изотерма
![]()
![]()
Адиабаталық
![]() ,
,
![]() ,
,
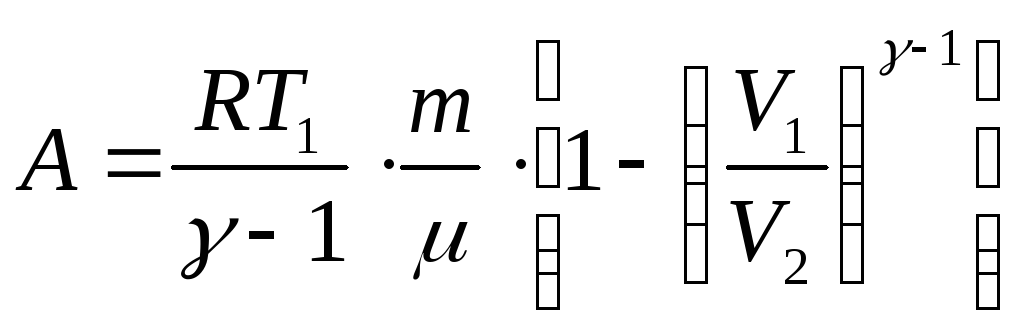
Политропты
![]() ,
,
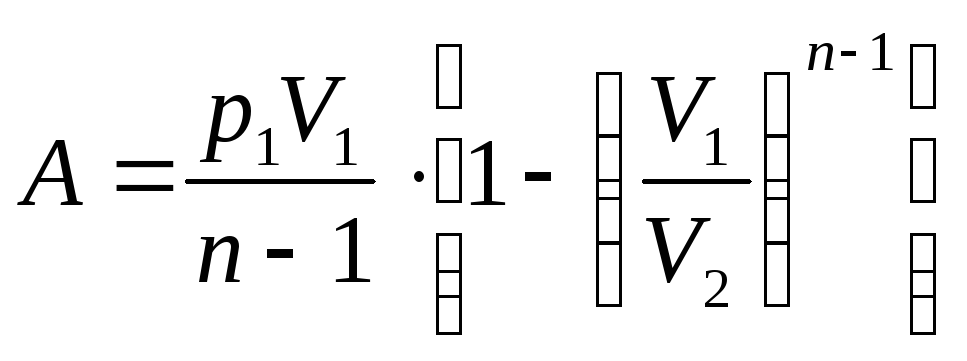
20. Қайтымды процесс кері бағытта өткізуге болатын процесті тура бағытта өткізгенде жүйе қандай күйлерден өтсе, кері бағытта сондай тізбегінен өтетін процесті айтады. Қайтымды процеске тек тепе тең процестер жатады. Қайтымды процесте жүйені қоршаған денелерде ешқандай өзгеріс болмайды.
Қайтымсыз процестер өздігінен бір бағытта өтетін процес. Нақты процестер қайтымсыз процестер болады. Олар мейлінше баяу өте отырып, қайтымды процестерге тек жуықтай алады. Қайтымды процеске мысал ретінде вакумдегі абсолют серпімді серіппеге ілінген дененің өлшейтің тербелісің алуға болады. Кедергісі бар ортада өтетін процестердің барлығы қайтымды процестер. Қайтымсыз процестерге температуралары әр түрлі денелердің бір біріне жылу алмасу салдарынан температуралары тенелу процесі жатады, себебі жылу ыссы денеден салқынға беріледі, керісінше болу мүмкін емес.
Карно
циклы
4 қайтымды процестен тұрады :2 изотермадан,2
адиабатадан. Циклді жүзеге асыру үшін,
жылулық дене (газ), суытқыш және қыздырғыш
болуы тиіс.Q жылу мөлшері газ бірінші
күйден екінші күйге изотермиялық түрде
өткенде:![]() .
.
Адиабаталық
ұлғаю барысында газ 2ші күйден 3ші күйге
өткенде:![]()
Изотермдік
сығылғанда:
![]()
Адиабаталық
сығылу 4тен 1ге
![]()
Адиабаттық
ұлғаю және сығылу үшін теңдіктері
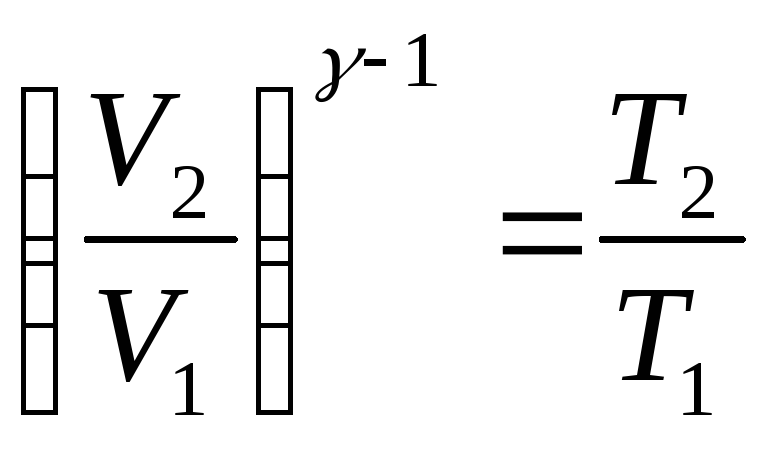 ,
,
![]()
