
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Получение алканов
- •2. Каталитическое гидрирование (Ni, Pd, Pt) ненасыщенных углеводородов при нагревании:
- •4. Гидролиз карбидов
- •5. Декарбоксилирование солей низших карбоновых кислот
- •Химические свойства алканов
- •2. Нитрование (реакция Коновалова)- реакция радикального замещения sr.
- •3. Реакции дегидрирования
- •5. Реакции горения
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •1. Крекинг и пиролиз нефтепродуктов.
- •2. Каталитическое (Ni, Pt, Pd) дегидрирование алканов при нагревании :
- •Химические свойства алкенов.
- •2. Реакции полимеризации:
- •3. Реакции окисления
- •Решение:
- •1) Условию задачи отвечает следующее строение:
- •Задачи и упражнения для самостоятельного решения
- •97. Смесь этена с бутаном, с плотность по водороду 21,5, сожгли. Продукты сгорания 20 л этой смеси пропустили через избыток раствора гидроксида кальция. Определите массу выпавшего осадка.
- •Диеновые углеводороды
- •1. Галогенирование
- •4. Полимеризация.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Алкины.
- •2. Взаимодействие карбидов металлов с водой
- •4. Дегидрогалогенирование дигалогеналканов:
- •5. Из галогеналканов под действием цинка:
- •Химические свойства алкинов
- •1. Галогенирование
- •3. Гидратация.
- •4. Гидрирование.
- •6. Кислотные свойства алкинов
- •8. Горение
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Циклоалканы
- •Получение циклоалканов
- •2. Циклогексан и его производные получают гидрированием бензола:
- •Химические свойства циклоалканов
- •Примеры решения задач Пример 18.
- •Решение:
- •Пример 19.
- •Решение:
- •Пример 20.
- •Задачи и упражнения для самостоятельного решения
- •Получение аренов
- •Химические свойства аренов
- •1. Электрофильное замещение в бензольном кольце
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •2. Гидролиз алкилгалогенидов в кислой или щелочной среде:
- •3. Гидролиз сложных эфиров:
- •4. Восстановление более высокоокисленных соединений
- •5. Биохимические методы.
- •1. Кислотные свойства.
- •3. Дегидратация(отщепление воды).
- •5. Окисление спиртов
- •1. Многие из химических свойств двухатомных и трёхатомных спиртов походят на таковые одноатомных спиртов. Отличия:
- •Задачи и упражнения для самостоятельного решения
- •1. Кислотные свойства
- •2. Реакции электрофильного замещения в бензольном кольце
- •3. Окислительно-восстановительные реакции
- •4. Реакции комплексообразования
- •Задачи и упражнения для самостоятельного решения
- •Карбонильные соединения
- •Получение карбонильных соединений
- •1. Окисление спиртов
- •4. Гидратация алкинов(реакция Кучерова).
- •5. Получение ацетона в промышленности
- •Химические свойства карбонильных соединений
- •1. Окисление
- •2. Восстановление.
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Карбоновые кислоты
- •1. Растворимые кислоты диссоциируют в воде:
- •2. Карбоновые кислоты (особенно растворимые в воде)
- •9. Окисление
- •11. Реакции в бензольном ядре ароматических кислот
- •12. Реакции ненасыщенных кислот
- •Примеры решения задач
- •Задачи и упражнения для самостоятельного решения
- •Сложные эфиры. Жиры.
- •2. Взаимодействие ангидрида карбоновой кислоты со спиртом
- •3. Взаимодействие хлорангидрида карбоновой кислоты со спиртом
- •Углеводы
- •1. Окисление
- •3. Алкилирование аминов:
- •4. Взаимодействие с ангидридами и хлорангидридами
- •7. Особенности ароматических аминов(анилина)
- •8. Окисление анилина
- •2. Обработка галогенсодержащих карбоновых кислот избытком аммиака:
- •3. Реакции, обусловленные наличием двух функциональных групп в
1. Кислотные свойства
В связи с тем, что неподелённая электронная пара атома кислорода гидроксильной группы вступает во взаимодействие с π – электронами бензольного ядра, электронная плотность смещается в сторону бензольного ядра(+М-эффект), на последнем возникает дефицит электронной плотности и атом водорода приобретает большую подвижность.
По этой причине фенол является слабой кислотой
а) В водных растворах диссоциируют по кислотному типу:
C6H5OH = C6H5O- + H+
б) Реакция с активными металлами.
2C6H5OH + 2Na 2C6H5ONa + H2
в) В отличие от спиртов растворяется (как и другие фенолы ) в водных растворах щелочи, образуя феноляты
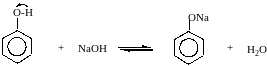
C6H5OH + NaOH C6H5ONa + H2O
Феноляты, будучи солями слабых кислот, частично гидролизованы в водном растворе, который поэтому обладает щелочной реакцией.
Фенолы можно выделить из фенолятов подкислением даже такими слабыми кислотами как угольная: C6H5ONa + H2O + CO2 = C6H5OH + NaHCO3
2. Реакции электрофильного замещения в бензольном кольце
а) При взаимодействии с бромной водой образуется 2, 4, 6, - трибромфенол, так как кислород гидроксигруппы сопрягается с двойной связью бензольного кольца и в орто- и пара- положениях увеличивается электроотрицательность. Наблюдается обесцвечивание бромной воды и выпадение белого творожистого осадка( качественная реакция).

б) При нитровании фенола концентрированной азотной кислотой образуется 2,4,6-тринитрофенол(пикриновая кислота). Благодаря наличию
трёх групп –NO2 связь О-Н ещё больше поляризуется и кислотные свойства усиливаются.

2,4,6-тринитрофенол
При нитровании фенола разбавленной азотной кислотой образуется смесь ортонитрофенола и паранитрофенола.
3. Окислительно-восстановительные реакции
а)Окисление
Фенолы( особеннои многоатомные фенолы) легко окисляются, давая многообразные продукты окисления. Лёгкая окисляемость позволяет использовать их в качестве антиоксидантов.
Антиокислительные свойства фенолов связаны с их способностью реагировать с пероксидными радикалами RO2• , ведущими цепь окисления, с образованием в результате этого малоактивных радикалов, не способных продолжать окисление:
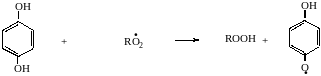
гидрохинон пероксидный
радикал
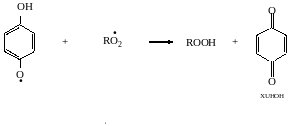
б)Восстановление
Ni, 150oC
C6H5OH + 3H2 C6H11OH
При действии Li[AlH4] при 350оС фенол восстанавливается в бензол
Li[AlH4], 350oC
C6H5OH C6H6
