Канонические структкры резонансная структура
Заряд комплексного иона равен алгебраической сумме заряда центрального атома и зарядов лигандов, например:
[Fe+2(CN-1)6]4- → заряд = (+2) + 6(-1) = -4
[Fe+3(H2O)6]3+ → заряд = (+3) + 6(0) = +3
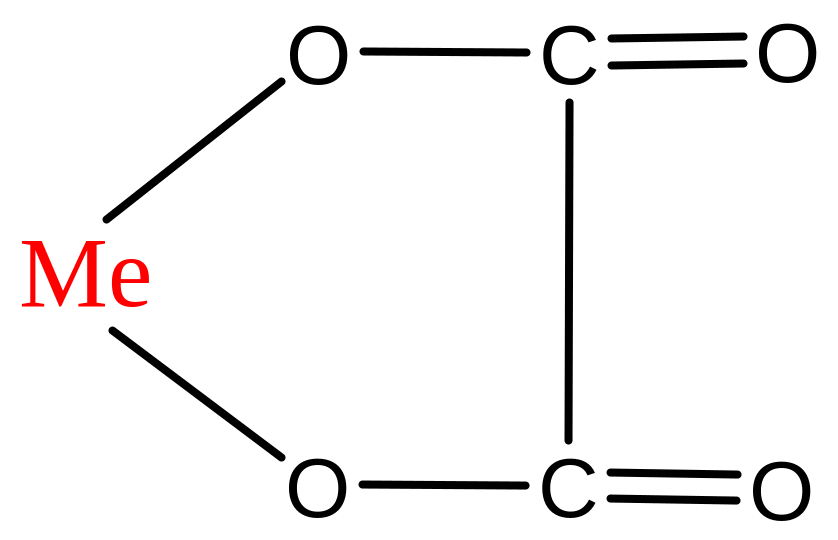
Некоторые лиганды способны образовывать циклические структуры с центральным атомом. Это свойство лигандов называется их хелатообразующей способностью, а образуемые такими лигандами соединения называются хелатными соединениями (клешневидными). Они содержат би- и полидентантный лиганд, который как бы захватывает центральный атом подобно клешням рака:
Оксалатный комплекс Ме
|
Трисэтилендиамин кобальта(III) |
Примером хелатообразно- го лиганда является этилендиамин. Для краткости его обозначают символом «en», что позво- ляет записать формулу - компл. иона Трисэтилен - диамин кобальта(III) как [Co(en)3]3+
|
К группе хелатов относятся и внутрикомплексные соединения, в которых центральный атом входит в состав цикла, образуя ковалентные связи с лигандами разными способами донорно-акцепторным и за счёт неспаренных электронов (обменный механизм). Комплексы такого рода характерны для аминокислот. Так, глицин (аминоуксусная кислота) образует хелаты с ионами Cu2+, Pt2+, Rh3+, например:
|
Хелатные соединения отличаются особой прочностью, так как центральный атом в них как бы «блокирован» ци- клическими лигандами. Поэтому их применяют для умягчения воды, для маскировки «лишних» ионов |
металла при крашении и изготовлении цветной пленки. Большое применение они находят в аналитической химии, велико их место и в природе. Так, гемоглобин состоит из комплекса-гема, связанного с белком-глобином. В геме центральным ионом является Fe+2, вокруг которого координированы 4 атома азота, принадлежащие к сложному лиганду с циклическими группировками. Гемоглобин обратимо присоединяет кислород и доставляет его из легких по кровеносной системе ко всем тканям.
Хлорофилл, участвующий в процессах фотосинтеза в растениях, построен аналогично, но в качестве центрального иона, содержит Mg2+.

 Заряд центрального иона (точнее
степень окисления центрального атома)
является основным фактором, влияющим
на координационное число.
Заряд центрального иона (точнее
степень окисления центрального атома)
является основным фактором, влияющим
на координационное число.
|
+1 +2 +3 +4 |
→ → → → |
2 4;6 6;4 8 |
|
Красным отмечены наиболее часто встречающиеся координационные числа. Координационное число не является неизменной величиной для данного комплексообразователя, а обусловлено также и природой лиганда, его электронными свойствами. Даже для одних и тех же комплексообразователей или лигандов координационное число зависит от агрегатного состояния, от концентрации компонентов и температуры раствора.
Геометрическая форма комплексного иона зависит от координационного числа его центрального атома. Комплексы с кч = 2 имеют линейную структуру, с кч = 4 –обычно тетраэдрическую, однако некоторые комплексы с кч = 4 имеют плоскую квадратную структуру. Комплексные ионы с кч = 6 чаще всего имеют октаэдрическую структуру.
кч = 2 кч = 4 кч = 4

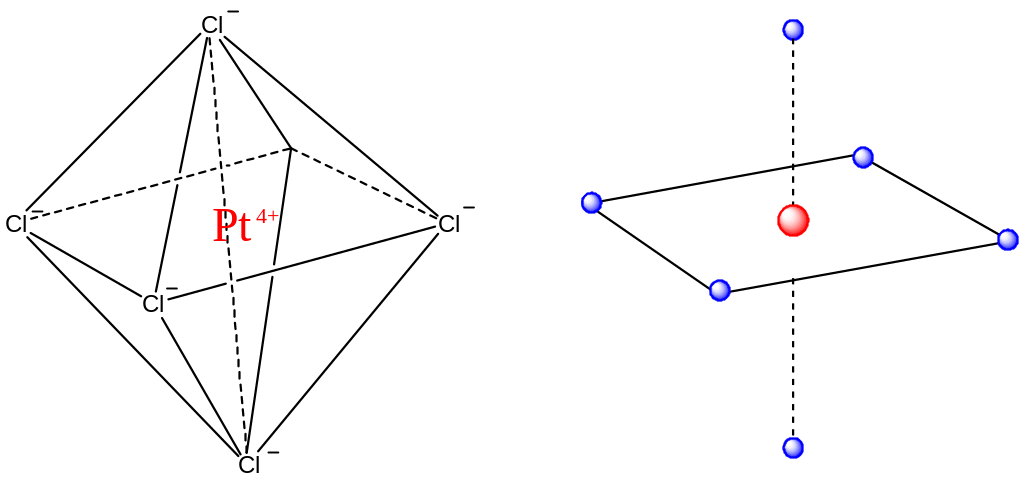 кч=6
кч=6