
- •Лекция №1.
- •1. Предмет и задачи физической химии
- •2. Химическая термодинамика
- •Основные понятия термодинамики
- •2.2 Первое начало термодинамики
- •Лекция №2.
- •2.3. Приложения первого начала термодинамики к химическим процессам
- •2.4 Теплоемкость. Зависимость теплового эффекта реакции от температуры. Закон Кирхгоффа.
- •Лекция №3.
- •2.5 Второе начало термодинамики. Энтропия
- •2.6 Статистическая интерпретация энтропии
- •Лекция №4.
- •2.7 Третье начало термодинамики
- •2.8 Расчет абсолютной энтропии
- •2.9 Термодинамические потенциалы
Лекция №2.
2.3. Приложения первого начала термодинамики к химическим процессам
Закон Гесса
Как известно, большинство химических реакций сопровождаются выделением (экзотермические реакции) либо поглощением (эндотермические реакции) теплоты. Первое начало термодинамики дает возможность рассчитать тепловой эффект химической реакции при различных условиях её проведения.
Тепловой эффект (теплота) химической реакции - количество теплоты, выделившейся либо поглотившейся в ходе реакции. Тепловой эффект относят, как правило, к числу молей прореагировавшего исходного вещества, стехиометрический коэффициент перед которым максимален.
Например, реакцию окисления водорода в химической термодинамике записывают в виде:
Н2 + 1/2 О2 = Н2О
и тепловой эффект рассчитывают на 1 моль водорода.
Тепловые эффекты, сопровождающие протекание химических реакций, являются предметом одного из разделов химической термодинамики - термохимии. Определим некоторые понятия термохимии.
Теплота образования вещества - тепловой эффект реакции образования 1 моля сложного вещества из простых. Теплоты образования простых веществ в устойчивом агрегатном состоянии при стандартных условиях принимаются равными нулю.
Теплота сгорания вещества - тепловой эффект реакции окисления 1 моля вещества в избытке кислорода до высших устойчивых оксидов.
Теплота растворения - тепловой эффект процесса растворения 1 моля вещества в бесконечно большом количестве растворителя. Теплота растворения складывается из двух составляющих: теплоты разрушения кристаллической решетки (для твердого вещества) и теплоты сольватации:
∆Нраств = ∆Нкр.реш.+ ∆Нсольв.
Поскольку ∆Нкр.реш. всегда положительно (на разрушение кристаллической решетки необходимо затратить энергию), а ∆Нсольв. всегда отрицательно, знак ∆Нраств. определяется соотношением абсолютных величин ∆Нкр.реш. и ∆Нсольв.:
∆Нраств = │∆Нкр.реш│-│∆Нсольв│
Тепловые эффекты химических реакций изучает термохимия. Во многих случаях эти реакции протекают при постоянном объеме или давлении. Из первого закона термодинамики следует, что при этих условиях теплота совпадает с изменением функции состояния. При постоянном объеме:
QV =∆U , а при постоянном давлении: Qp = ∆H.
Эти равенства в применении к химическим реакциям составляют суть закона Гесса, который является частным случаем первого начала термодинамики:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Выше было показано, что изменение энтальпии ∆Н (тепловой эффект изобарного процесса Qp) и изменение внутренней энергии ∆U (тепловой эффект изохорного процесса Qv) не зависят от пути, по которому система переходит из начального состояния в конечное.
Рассмотрим некоторый обобщенный химический процесс превращения исходных веществ A1, A2, A3... в продукты реакции В1, B2, В3..., который может быть осуществлен различными путями в одну или несколько стадий:
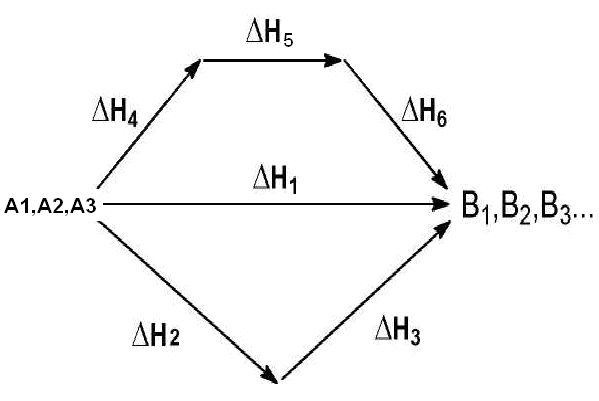
Согласно закону Гесса, тепловые эффекты всех этих реакций связаны cледующим соотношением: ∆Н1 = ∆Н2 + ∆Н3 = ∆Н4 + ∆Н5 + ∆Н6 (1.17)
Примером, поясняющим закон Гесса, может служить горение углерода, которое можно осуществить разными путями:
1 путь – в одну стадию: С + О2 СО2, Н1
2 путь – в две стадии: а) С + 1/2О2 СО, Н2
б) СО + 1/2О2 СО2, Н3
Согласно закону Гесса: Н1 = Н2 + Н3.
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса:
1. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты:
Н0х.р.
=![]() (νiН0обр.)прод.-
(νiН0обр.)исх.
(1.20)
(νiН0обр.)прод.-
(νiН0обр.)исх.
(1.20)
Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты.
Н0х.р. = (νiН0сгор.)исх.- (νiН0сгор.)прод. (1.21)
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье-Лапласа).
Величины тепловых эффектов химических реакций зависят от условий, в которых проводятся реакции. Поэтому табличные значения теплот различных процессов принято относить к стандартному состоянию - температуре 298 К и давлению 101325 Па (760 мм. рт. ст.; 1 атм.); величины тепловых эффектов при данных условиях называют стандартными тепловыми эффектами и обозначают Н°298 и U°298 соответственно.
Задача №2.
Рассчитать тепловой эффект реакции окисления одного моля глюкозы (теплота образования кислорода по определению равна нулю).
Решение:
С6Н12О6 + 6 О2 = 6 СО2 + 6 Н2О
Н0х.р. = [6 Нобр.(Н2О) + 6 АНобр.(СО2)] - [Нобр.(С6Н12О6)]
Н0обр.( Н2О)= -285,8 кДж/моль
Н0обр. .(СО2)= - 393,5 кДж/моль
Н0обр. (С6Н12О6)= - 1274,5 кДж/моль
Н0х.р. = [6 · (-285,8) + 6 · (- 393,5) + 1274,5] кДж/моль = - 2801,3 кДж/моль
Задача №3.
Рассчитать
изменение энтальпии химической реакции:
3С2Н2![]() С6Н6,
пользуясь справочными данными.
С6Н6,
пользуясь справочными данными.
Решение:
1 способ: пользуясь 1-м следствиям из закона Гесса, можно рассчитать изменение энтальпии химической реакции:
Н0х.р. = [ Н0обр.( С6Н6) - 3 · Н0обр.( С2Н2)]
Н0обр.( С6Н6) = 82,9 кДж/моль; Н0обр.( С2Н2) = 226,8 кДж/моль
Н0х.р. = [82,9 – 3 · 226,8] кДж/моль = -597,5 кДж/моль
2 способ: по 2-му следствию из закона Гесса:
Н0х.р. = [3 · Н0сгор..(С2Н2) - Н0сгор.( С6Н6)]
Н0сгор.( С6Н6) = - 3302 кДж/моль; Н0обр.( С2Н2) = - 1300 кДж/моль
Н0х.р. = [3 · (-1300) – (-3302)] кДж/моль = - 598 кДж/моль
