
- •1.Функции печени
- •2. Роль печени в обмене углеводов, липидов, аминокислот
- •3. Инактивация гормонов и детоксикация чужеродных и лекарственных соединений
- •4. Биохимическая диагностика функций печени
- •5. Синтез гемоглобина. Нарушения синтеза гема. Порфирии. Гемоглобинопатии
- •6. Обмен железа
- •7. Распад гемоглобина. Образование пигментов желчи, кала и мочи
- •8. Диагностическое значение определения желчных пигментов в крови и моче
- •9. Нарушения обмена билирубина
- •10. Типы желтух и способы их диагностики
- •12. Основные биохимические константы крови и химический состав плазмы крови
12. Основные биохимические константы крови и химический состав плазмы крови
Общее количество крови в организме взрослого человека составляет в среднем 6 – 8% от массы тела, что соответствует от 5 до 6 литров крови, а у женщины – от 4 до 5.
Относительная плотность крови – 1,050 – 1.060 зависит в основном от количества эритроцитов. Относительная плотность плазмы крови – 1.025 – 1.034, определяется концентрацией белков.
Вязкость крови – 5 усл.ед., плазмы – 1,7 – 2,2 усл.ед., если вязкость воды принять за 1. Обусловлена наличием в крови эритроцитов и в меньшей степени белков плазмы.
Осмотическое давление крови в среднем составляет 7,6 атм.
Онкотическое давление крови – часть осмотического давления, создаваемого белками плазмы. Оно равно 0,03 – 0,04 атм, или 25 – 30 мм рт.ст.
Кислотно-основное состояние крови (КОС)- В норме рН – 7,36 (реакция слабоосновная); артериальной крови – 7,4; венозной – 7,35. При различных физиологических состояниях рН крови может изменяться от 7,3 до 7,5.
состав крови
Кровь состоит из жидкой части плазмы и взвешенных в ней форменных элементов: эритроцитов, лейкоцитов и тромбоцитов. На долю форменных элементов приходится 40 – 45%, на долю плазмы – 55 – 60% от объема крови. Это соотношение получило название гематокритного соотношения, или гематокритного числа. Часто под гематокритным числом понимают только объем крови, приходящийся на долю форменных элементов.
• Плазма крови.
• Эритроциты, или красные кровяные тельца. Содержат гемоглобин - дыхательный пигмент красного цвета.
• Лейкоциты, или белые кровяные тельца. Выполняют защитные функции.
• Тромбоциты, или кровяные пластинки. Необходимы для свертывания крови.
13. Глобулины.
В отличие от альбуминов глобулины не растворимы в воде, а растворимы в слабых солевых растворах.
1-глобулины
В эту фракцию входят разнообразные белки. 1-глобулины имеют высокую гидрофильность и низкую молекулярную массу - поэтому при патологии почек легко теряются с мочой. Однако их потеря не оказывает существенного влияния на онкотическое давление крови, потому что их содержание в плазме крови невелико.
Функции v1-глобулинов.
Транспортная. Транспортируют липиды, при этом образуют с ними комплексы - липопротеины. Среди белков этой фракции есть специальный белок, предназначенный для транспорта гормона щитовидной железы тироксина - тироксин-связывающий белок.
Участие в функционировании системы свертывания крови и системы комплемента - в составе этой фракции находятся также некоторые факторы свертывания крови и компоненты системы комплемента.
Регуляторная функция. Некоторые белки фракции 1-глобулинов яляются эндогенными ингибиторами протеолитических ферментов. Наиболее высока в плазме концентрация 1-антитрипсина. Содержание его в плазме от 2 до 4 г/л (очень высокое), молекулярная масса - 58-59 кДа. Главная его функция - угнетение эластазы - фермента, гидролизующего эластин (один из основных белков соединительной ткани). 1-антитрипсин также является ингибитором протеаз: тромбина, плазмина, трипсина, химотрипсина и некоторых ферментов системы свертывания крови. Количество этого белка увеличивается при воспалительных заболеваниях, при процессах клеточного распада, уменьшается при тяжелых заболеваниях печени. Это уменьшение - результат нарушения синтеза 1-антитрипсина, и связано оно с избыточным расщеплением эластина. Существует врожденная недостаточность (1-антитрипсина. Считают, что недостаток этого белка способствует переходу острых заболеваний в хронические.
К фракции 1-глобулинов относят также 1-антихимотрипсин. Он угнетает химотрипсин и некоторые протеиназы форменных элементов крови.
2-глобулины
Высокомолекулярные белки. Эта фракция содержит регуляторные белки, факторы свертывания крови, компоненты системы компемента, транспортные белки. Сюда относится и церулоплазмин. Этот белок имеет 8 участков связывания меди. Он является переносчиком меди, а также обеспечивает постоянство содержания меди в различных тканях, особенно в печени. При наследственном заболевании - болезни Вильсона - уровень церулоплазмина понижается. Вследствие этого повышается концентрация меди в мозге и печени. Это проявляется развитием неврологической симптоматики, а также циррозом печени.
Гаптоглобины.
Содержание этих белков составляет приблизительно 1/4 часть от всех 2-глобулинов. Гаптоглобин образует специфические комплексы с гемоглобином, освобождающимся из эритроцитов при внутрисосудистом гемолизе. Вследствие высокой молекулярной массы этих комплексов они не могут выводиться почками. Это предотвращает потерю железа организмом.
Комплексы гемоглобина с гаптоглобином разрушаются клетками ретикуло-эндотелиальной системы (клетки системы мононуклеарных фагоцитов), после чего глобин расщепляется до аминокислот, гем разрушается до билирубина и экскретируется желчью, а железо остается в организме, и может быть реутилизировано. К этой же фракции относится и 2-макроглобулин. Молекулярная масса этого белка 720 кДа, концентрация в плазме крови 1,5-3 г/л. Он является эндогенным ингибитором протеиназ всех классов, а также связывает гормон инсулин. Время полужизни 2-макроглобулина очень малое - 5 мин. Это универсальный "чистильщик" крови, комплексы "2-макроглобулин-фермент" способны сорбировать на себе иммунные пептиды, например, интерлейкины, факторы роста, фактор некроза опухолей, и выводить их из кровотока. С1-ингибитор - гликопротеид, является основным регуляторным звеном в классическом пути активации комплемента (КПК), способен угнетать плазмин, калликреин. При недостатке С1-ингибитора развивается ангионевротический отек.
Глобулины
К этой фракции относятся некоторые белки системы свертывания крови и подавляющее большинство компонентов системы активации комплемента (от С2 до С7).
Основу фракции -глобулинов составляют Липопротеины Низкой Плотности (ЛПНП) (Подробнее о липопротеинах: смотрите лекции "Метаболизм липидов").
C-реактивный белок. Содержится в крови здоровых людей в очень низких концентрациях, менее 10 мг/л. Его функция неизвестна. Концентрация С-реактивного белка значительно увеличивается при острых воспалительных заболеваниях. Поэтому С-реактивный белок называют белком "острой фазы" (к белкам острой фазы относятся также -1-антитрипсин, гаптоглобин).
Гамма-глобулины
В этой фракции содержатся в основном антитела - белки, синтезируемые в лимфоидной ткани и в клетках РЭС, а также некоторые компоненты системы комплемента.
Функция антител - защита организма от чужеродных агентов (бактерии, вирусы, чужеродные белки), которые называются антигенами.
Главные классы антител в крови:
иммуноглобулины G (IgG);
иммуноглобулины M (IgM);
иммуноглобулины A (IgA), к которым относятся IgD и IgE.
Среди криоглобулинов существует белок фибронектин. Это высокомолекулярный гликопротеин (молекулярная масса 220 кДа). Он присутствует в плазме крови и на поверхности многих клеток (макрофагов, эндотелиальных клеток, тромбоцитов, фибробластов). Функции фибронектина:
обеспечивает взаимодействие клеток друг с другом;
способствует адгезии тромбоцитов;
предотвращает метастазирование опухолей.
Плазменный фибронектин является опсонином - усиливает фагоцитоз. Играет важную роль в очищении крови от продуктов распада белков, например, распада коллагена. Вступая в связь с гепарином, участвует в регуляции процессов свертывания крови. В настоящее время этот белок широко изучается и используется для диагностики особенно при состояниях, сопровождающихся угнетением системы макрофагов (сепсис и др.).
Интерферон - это гликопротеин. Имеет молекулярную массу около 26 кДа. Обладает видовой специфичностью. Вырабатывается в клетках в ответ на внедрение в них вирусов. У здорового человека его концентрация в плазме мала. Но при вирусных заболеваниях его концентрация увеличивается.
Строение молекулы иммуноглобулина. Молекулы всех классов иммуноглобулинов имеют сходное строение. Разберем их строение на примере молекулы IgG. Это сложные белки, которые являются гликопротеинами и обладают четвертичной структурой.
В состав белковой части иммуноглобулина входят всего 4 полипептидные цепи: 2 одинаковые легкие и 2 одинаковые тяжелые цепи. Молекулярная масса легкой цепи составляет 23 кДа, а тяжелой - от 53 до 75 кДа. С помощью дисульфидных (-S-S-) связей (мостиков) тяжелые цепи соединены между собой и легкие цепи также удерживаются около тяжелых цепей.
Синтез иммуноглобулинов значительно отличается от синтеза других белков. Каждая из L-цепей кодируется группой из 3-х различных генов, а Н-цепь - четырьмя генами. Таким образом обеспечивается огромное разнообразие структуры антител, их специфичность к различным антигенам. В организме человека потенциально возможен синтез приблизительно 1 миллиона различных антител.
Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы: секреторные, индикаторные и экскреторные. Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза. Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Один из них находится главным образом в цитозолеклетки (ЛДГ, альдолаза), другие – в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (β-глюкуронидаза, кислая фосфатаза) и т.д. Большая часть индикаторных ферментов в сыворотке кровиопределяется в норме лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток«вымываются» в кровь; их активность в сыворотке резко возрастает, являясь индикатором степени и глубины повреждения этих тканей.
Экскреторные ферменты синтезируются главным образом в печени (лейцинаминопептидаза, щелочнаяфосфатаза и др.). В физиологических условиях эти ферменты в основном выделяются с желчью. Еще не полностью выяснены механизмы, регулирующие поступление данных ферментов в желчные капилляры. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность вплазме крови повышается.
Особый интерес для клиники представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследоватьактивность креатинкиназы, АсАТ, ЛДГ и оксибутиратдегидрогеназы.
При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке кровизначительно увеличивается активность АлАТ и АсАТ, сорбитолдегидрогеназы, глутаматдегидрогеназы и некоторых других ферментов. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится γ-глутамилтранспептидаза, или γ-глутамилтрансфе-раза (ГГТ). Данный фермент – высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени, внутрипеченоч-ной или внепеченочной закупорке желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении печени. Иногда повышение активности ГГТ наблюдается при застойной сердечной недостаточности, редко – после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы.
Органоспецифическими ферментами для печени считаются также гистида-за, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке кровисвидетельствует о поражении печеночной ткани.
В настоящее время особо важным лабораторным тестом стало исследование активности изоферментов всыворотке крови, в частности изофермен-тов ЛДГ. Известно, что в сердечной мышце наибольшей активностьюобладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени – ЛДГ4 и ЛДГ5 (см. главу 10). Установлено, что у больных с острым инфарктом миокарда в сыворотке крови резко повышается активность изоферментов ЛДГ1 и отчасти ЛДГ2. Изоферментный спектр ЛДГ в сыворотке крови при инфаркте миокарда напоминает изоферментный спектр сердечной мышцы. Напротив, при паренхиматозном гепатите в сыворотке кровизначительно возрастает активность изоферментов ЛДГ4 и ЛДГ5 и уменьшается активность ЛДГ1 и ЛДГ2.
Диагностическое значение имеет также исследование активности изофер-ментов креатинкиназы в сыворотке крови. Существуют по крайней мере 3 изофермента креатинкиназы: ВВ, ММ и MB. В мозговой ткани в основном присутствует изофермент ВВ (от англ. brain – мозг), в скелетной мускулатуре – ММ-форма (от англ. muscle – мышца). Сердце содержит гибридную МВ-форму, а также ММ-форму. Изоферменты креатинкиназы особенно важно исследовать при остром инфаркте миокарда, так как МВ-форма в значительном количестве содержится практически только в сердечной мышце. Повышение активности МВ-формы в сыворотке кровисвидетельствует о поражении именно сердечной мышцы.
Возрастание активности ферментов сыворотки крови при многих патологических процессах объясняется прежде всего двумя причинами: 1) выходом в кровяное русло ферментов из поврежденных участков органов или тканей на фоне продолжающегося их биосинтеза в поврежденных тканях; 2) одновременным повышением каталитической активности некоторых ферментов, переходящих в кровь. Возможно, что повышение активности ферментов при «поломке» механизмов внутриклеточной регуляции обмена веществ связано с прекращением действия соответствующих регуляторов и ингибиторов ферментов, изменением под влиянием различных факторов строения и структуры макромолекул ферментов.
Кинин-калликреиновая система — группа белков крови, играющих роль в воспалении, контроле артериального давления, коагуляции и возникновении болевых ощущений. Важнейшими компонентами данной системы являются брадикинин икаллидин.
Состав
Кинин-калликреиновая система состоит из группы высокомолекулярных белков, небольших полипептидов, а также набора активирующих и деактивирующих компоненты ферментов
Белки
Высокомолекулярный кининоген (ВМК) и низкомолекулярный кининоген (НМК) служат предшественниками полипептидов. Сами они активностью не обладают.
ВМК синтезируется в печени наряду с прекалликреином. Не обладает каталитической активностью.
НМК синтезируется местно, многими тканями и секретируется вместе с тканевым калликреином.
ВМК и НМК образуютя в результате альтернативного сплайсинга одного гена[3].
Полипептиды
Брадикинин, действующий на В2 и в меньшей степени на B1 рецепторы, образуется из ВМК под действием калликреина. По химическому составу — нонапептид.
Каллидин — декапептид, высвобождающийся из НМК при воздействии на него тканевого калликреина.
Ферменты
Калликреины (тканевой и плазменный) — сериновые протеазы, катализирующие образование кининов из кининогенов[4]. Прекалликреин служит предшественником плазменного калликреина. Он может катализировать образование кининов только после активации фактором Хагемана.
Карбоксипептидазы присутствуют в двух формах: циркулирующей N-форме и связаной с мембраной M-формой.
Ангиотензинпревращающий фермент (АПФ или кининаза II) инактивирует группу пептидов, включая брадикинин. Катализирует образование ангиотензина II из ангиотензина I.
Нейтральная эндопептидаза также инактивирует кинины.
Белки острой фазы – большая группа белков сыворотки крови (в основном α-глобулинов) с молекулярной массой от 12 кДа до 340 кДа и различными функциями, объединенных по общему признаку – быстрое и значительное увеличение концентрации при бактериальной, вирусной, паразитарной инфекции, физической или химической травме, токсической или аутоиммунной реакции, злокачественных новообразованиях. Смысл данного увеличения заключается в повышении резистентности клеток к окислению, в ограничении повреждения тканей, в подавлении скорости размножения бактерий.
Синтез белков острой фазы осуществляется печенью, моноцитами, лимфоцитами, нейтрофилами. Их концентрация зависят от стадии заболевания и/или от масштабов повреждений. Синтез белков включается и регулируется рядом медиаторов, среди которых цитокины, анафилотоксины и глюкокортикоиды.
К белкам острой фазы относят С-реактивный белок, сывороточный амилоид А,гаптоглобин, α2-макроглобулин, церулоплазмин, α1-гликопротеин, α1-антитрипсин,орозомукоид, компоненты комплемента С1-С4, С9. Трансферрин также относят к белкам острой фазы, но его концентрация при воспалениях снижается – его называют негативнымбелком острой фазы.
Содержание небелкового азота в цельной крови и плазме почти одинаково и составляет в крови 15–25 ммоль/л. Небелковый азот крови включает азот мочевины (50% от общего количества небелкового азота),аминокислот (25%), эрготионеина (8%), мочевой кислоты (4%), креатина (5%), креати-нина (2,5%), аммиака и индикана (0,5%) и других небелковых веществ, содержащих азот (полипептиды, нуклеотиды, нуклеозиды,глутатион, билирубин, холин, гистамин и др.). Таким образом, в состав небелкового азота входит главным образом азот конечных продуктов обмена простых и сложных белков.
Небелковый азот крови называют также остаточным азотом, т.е. остающимся в фильтрате после осаждениябелков. У здорового человека колебания в содержании небелкового (остаточного) азота крови незначительны и в основном зависят от количества поступающих с пищей белков. При ряде патологических состояний уровень небелкового азота в крови повышается. Это состояние носит название азотемии. Азотемия в зависимости от вызывающих ее причин подразделяется на ретенционную и продукционную. Ретенционная азотемия развивается в результате недостаточного выделения с мочой азотсодержащих продуктов при нормаль-
ном поступлении их в кровяное русло. Она в свою очередь может быть почечной и внепочечной.
При почечной ретенционной азотемии концентрация остаточного азота в крови увеличивается вследствие ослабления очистительной (экскреторной) функции почек. Резкое повышение содержания остаточного азотапроисходит в основном за счет мочевины. В этих случаях на долю азота мочевины приходится 90% небелкового азота крови вместо 50% в норме. Внепочечная ретенционная азотемия может возникнуть в результате тяжелой недостаточности кровообращения, снижения артериального давления и уменьшения почечного кровотока. Нередко внепочечная ретенционная азотемия является результатом наличия препятствия оттоку мочи после ее образования в почке.
Продукционная азотемия развивается при избыточном поступлении азотсодержащих продуктов в кровь, как следствие усиленного распада тканевых белков при обширных воспалениях, ранениях, ожогах, кахексии и др. Нередко наблюдаются азотемии смешанного типа.
Безазотистые органические вещества - продукты жирового и углеводного обмена. Глюкоза (в артериальной крови 4,44-6,66 ммоль/л). Уровень глюкозы характеризует поступление углеводов из внешней среды и уровень гормонов, регулирующих углеводный обмен. Лактат и пируват. Нормы: 1-1,1 ммоль/л и 80-85 ммоль/л соответственно. Метаболиты, разрушаются в печени с образованием глюкозы. Холестерин - в свободном виде и в виде соединений (эфиров) 3,9-6,5 ммоль/л. Отдельные жирные кислоты в свободном виде и в виде эфиров - показатель жирового обмена.
14.Гемоглобин, транспорт кислорода кровью.
Гемоглоби́н (от др.-греч. αἷμα — кровь и лат. globus — шар) — сложныйжелезосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинствабеспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях[1].
Главная функция гемоглобина состоит в переносе кислорода. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови намного сильнее( почти в 500 раз), чем кислород, образуя карбоксигемоглобин (HbCO). Некоторые процессы приводят к окислению иона железа в геме до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин(HbOH) (metHb, от мета… и гемоглобин, иначе гемиглобин илиферригемоглобин, см. Метгемоглобинемия). В обоих случаях блокируются процессы транспортировки кислорода. Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в легких.
Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови.[2]
Метгемоглобин — производное гемоглобина, в котором железо окислено (трехвалентно). Метгемоглобин не способен переносить кислород. Образуется в организме при некоторых видах отравлений.
15.Токсичные формы кислорода, их образование и воздействие на клетки организма.
Кислород, необходимый организму для функционирования ЦПЭ и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы.
К активным формам кислорода относят:
ОН• - гидроксильный радикал;
![]() -
супероксидный анион;
-
супероксидный анион;
Н2О2 - пероксид водорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций - вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, например, когда клетки белой крови с участием активных форм кислорода разрушают фагоцитированные клетки бактерий. Но в остальных клетках свободнорадикальное окисление приводит к разрушению органических молекул, в первую очередь липидов, и, соответственно, мембранных структур клеток, что часто заканчивается их гибелью. Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов (ПОЛ).
В ЦПЭ поглощается около 90% поступающего в клетки О2. Остальная часть О2 используется в других окислительно-восстановительных реакциях. Ферменты, участвующие в окислительно-восстановительных реакциях с использованием Кислорода, делятся на 2 группы: оксидазы и оксигеназы.
Оксидазы используют молекулярный кислород только в качестве акцептора электронов, восстанавливая его до Н2О или Н2О2.
Оксигеназы включают один (монооксигеназы) или два (диоксигеназы) атома кислорода в образующийся продукт реакции.
Хотя эти реакции не сопровождаются синтезом АТФ, они необходимы для многих специфических реакций в обмене аминокислот (см. раздел 9), синтезе жёлчных кислот и стероидов (см. разделы 8, 11), в реакциях обезвреживания чужеродных веществ в печени (см. раздел 12).
294
В большинстве реакций с участием молекулярного кислорода его восстановление происходит поэтапно с переносом одного электрона на каждом этапе. При одноэлектронном переносе происходит образование промежуточных высокореактивных форм кислорода.
В невозбуждённом состоянии кислород нетоксичен. Образование токсических форм кислорода связано с особенностями его молекулярной структуры. О2 содержит 2 неспаренных электрона с параллельными спинами, которые не могут образовывать термодинамически стабильную пару и располагаются на разных орбиталях. Каждая из этих орбиталей может принять ещё один электрон.
Полное восстановление О2 происходит в результате 4 одноэлектронных переходов:
![]()
Супероксид, пероксид и гидроксильный радикал - активные окислители, что представляет серьёзную опасность для многих структурных компонентов клетки (рис. 6-30).
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, инициируя цепные окислительные реакции (см. раздел 8).
Большая часть активных форм кислорода образуется при переносе электронов в ЦПЭ, прежде всего, при функционировании QH2-дегидрогеназного комплекса. Это происходит в результате неферментативного переноса ("утечки") электронов с QH2 на кислород (рис. 6-31).
В отличие от рассмотренного механизма на этапе переноса электронов при участии цитохромоксидазы (комплекс IV) "утечка" электронов не происходит благодаря наличию в ферменте специальных активных центров, содержащих Fe и Сu и восстанавливающих О2 без освобождения промежуточных свободных радикалов.
В фагоцитирующих лейкоцитах (гранулоцитах, макрофагах и эозинофилах) в процессе фагоцитоза усиливаются поглощение кислорода и образование активных радикалов. Активные формы кислорода образуются в результате активации NADPH-оксидазы, преимущественно локализованной на наружной стороне плазматической мембраны, инициируя так называемый "респираторный взрыв" с образованием активных форм кислорода (см. раздел 14).
Защита организма от токсического действия активных форм кислорода связана с наличием во всех клетках высокоспецифичных ферментов: супероксиддисмутазы, каталазы, глутатион-пероксидазы, а также с действием антиоксидантов (
16.Супероксиданионзависимый апоптоз.
17.Система антиоксидантной защиты
Антиоксиданты (антиокислители) — ингибиторы окисления, природные или синтетические вещества, способные замедлятьокисление (рассматриваются преимущественно в контексте окисления органических соединений).
Механизмы действия
Окисление углеводородов, спиртов, кислот, жиров и других веществ свободным кислородом представляет собой цепной процесс. Цепные реакции превращений осуществляются с участием активных свободных радикалов — перекисных (RO2*), алкоксильных (RO*), алкильных (R*), а также активных форм кислорода (супероксид анион, синглетный кислород). Для цепных разветвлённых реакций окисления характерно увеличение скорости в ходе превращения (автокатализ). Это связано с образованием свободных радикалов при распаде промежуточных продуктов — гидроперекисей и др.
Механизм действия наиболее распространённых антиоксидантов (ароматические амины, фенолы, нафтолы и др.) состоит в обрыве реакционных цепей: молекулы антиоксиданта взаимодействуют с активными радикалами с образованием малоактивных радикалов. Окисление замедляется также в присутствии веществ, разрушающих гидроперекиси (диалкилсульфиды и др.). В этом случае падает скорость образования свободных радикалов. Даже в небольшом количестве (0,01—0,001 %) антиоксиданты уменьшают скорость окисления, поэтому в течение некоторого периода времени (период торможения, индукции) продукты окисления не обнаруживаются. В практике торможения окислительных процессов большое значение имеет явлениесинергизма — взаимного усиления эффективности антиоксидантов в смеси, либо в присутствии других веществ.
18.Особенности метаболизма в эритроцитах и лейкоцитах.
Эритроциты.
Главная функция - транспорт газов: перенос О2 и СО2. Он возможен благодаря большому содержанию гемоглобина и высокой активности фермента карбоангидразы.
Зрелые эритроциты не имеют ядер, рибосом, митохондрий, лизосом. Поэтому обмен эритроцитов имеет ряд особенностей.
В зрелых эритроцитах не идут реакции биосинтеза белков.
Образование энергии - только путем гликолиза, субстрат - только глюкоза.
В эритроцитах существуют механизмы предохранения гемоглобина от окисления.
Активно протекает ГМФ-путь распада глюкозы, дающий НАДФ.H2.
Высока концентрация глютатиона - пептида, содержащего SH-группы.
Лейкоциты.
Клетки, выполняющие защитные функции - способны к фагоцитозу. В лейкоцитах много активных протеаз, расщепляющих чужеродные белки. В момент фагоцитоза увеличивается выработка перекиси водорода и увеличивается активность пероксидазы, что способствует окислению чужеродных частиц (антибактериальное действие). Лейкоциты богаты внутриклеточными низкоспецифичными протеиназами - катепсинами, локализованными в лизосомах. Катепсины способны к практически тотальному протеолизу белковых молекул. В лизосомах лейкоцитов в значительных количествах содержатся и другие ферменты: например, рибонуклеазы и фосфатазы.
19.Механизмы гемостаза. Роль витамина К в свертывании крови.
Гемостаз
Система гемостаза – это совокупность функционально-морфологических и биохимических механизмов, обеспечивающих остановку кровотечения и, вместе с тем, поддерживающих кровь в жидком состоянии.
Значение системы гемостаза для сохранения жизнеспособности организма определяется тем, что она препятствует выведению крови из циркуляторного русла и тем самым способствует обеспечению нормального кровоснабжения органов, сохранению необходимого объема циркулирующей крови.
Механизмы гемостаза
Принято различать два механизма гемостаза:
сосудисто-тромбоцитарный – первичный, или микроциркуляторный;
коагуляционный – вторичный, или макроциркуляторный (процесс свертывания крови и фибринолиза).
Звенья гемостаза
Реализуется гемостаз в основном тремя взаимодействующими между собой функционально-структурными компонентами (звеньями):
стенками кровеносных сосудов (эндотелием),
клетками крови (преимущественно тромбоцитами),
плазменными ферментными системами.
Каждое из звеньев гемостаза имеет элементы системы, способствующие образованию сгустка (коагулянты, точнее - прокоагулянты) и препятствующие этому процессу (антисвертывающие и фибринолитические факторы):
факторы свертывания крови и фибринолиза эндотелия;
тромбоцитарные факторы свертывания крови и фибринолиза;
эритроцитарные факторы свертывания крови и фибринолиза;
лейкоцитарные факторы свертывания крови и фибринолиза;
плазменные факторы свертывания крови;
плазменные антикоагулянты;
плазменная фибринолитическая система крови.
Система гемостаза подчинена сложной нейро-гуморальной регуляции и в ней четко функционируют механизмы положительной и отрицательной обратной связи, вследствие чего клеточный гемостаз и свертывание крови вначале подвергаются самоактивации, а затем нарастает антитромботический потенциал крови. Эти механизмы создают условия для самоограничения процесса свертывания, вследствие чего локальная активация системы в местах тромбообразования не трансформируется (при правильном функционировании указанных механизмов) во всеобщее свертывание крови.
Нарушения гемостаза ведут к серьезным клиническим последствиям. Дисбаланс в одном направлении может сопровождаться чрезмерным кровотечением, в другом – образованием тромба.
Механизм свертывания крови
В современной схеме свертывания крови выделяют четыре фазы:
Протромбинообразование (контактно-калликреин-киниикаскадная активация) - 5..7 минут;
Тромбинообразование - 2..5 секунд;
Фибринообразование - 2..5 секунд;
Посткоагуляционная фаза (образование гемостатически полноценного сгустка) - 55..85 минут.
Факторы свертывания крови
Фактор: |
Название фактора |
Свойства и функции |
I |
Фибриноген |
Белок-гликопротеид, который вырабатывается пареихиматозными клетками печени, превращается под влиянием тромбина в фибрин. |
II |
Протромбин |
Белок-гликопротеид, неактивная форма фермента тромбина, синтезируется в печени при участии витамина К. |
III |
Тромбопластин |
Липопротеид (протеолитический фермент), участвующий в местном гемостазе, при контакте с плазменными факторами (VII и Ca) способен активировать фактор X (внешний путь формирования протромбиназы). Проще говоря: превращает протромбин в тромбин. |
IV |
Кальций |
Потенцирует большинство факторов свертывания крови - участвувет в активации протромбиназы и образовании тромбина, в процессе свертывания не расходуется. |
V |
Проакцелерин |
Ас-глобулин, образуется в печени, необходим для образования протромбиназы. |
VI |
Акцелерин |
Потенцирует превращение протромбина в тромбин. |
VII |
Проконвертин |
Синтезируется в печени при участии витамина К, в активной форме вместе с факторами III и IV активирует фактор X. |
VIII |
Антигемофильный глобулин А |
Сложный гликопротеид, место синтеза точно не установлено, активирует образование тромбопластина. |
IX |
Антигемофильный глобулин В (Фактор Кристмаса) |
Бета-глобулин, образуется в печени, участвует в образовании тромбина. |
X |
Тромботропин (Фактор Стюарта-Прауэра) |
Гликопротеид, вырабатывается в печени, участвует в образовании тромбина. |
XI |
Предшественник плазменного тромбопластина (Фактор Розенталя) |
Гликопротеид, активирует фактор X. |
XII |
Фактор контактной активации (Фактор Хагемана) |
Активатор пусковой реакции свертывания крови и кининовой системы. Проще говоря, начинает и локализует тромбообразование. |
XIII |
Фибринстабилизирующий фактор |
Фибриназа, стабилизирует фибрин в присутствии кальция, катализирует трансаминирование фибрина. Проще говоря, переводит нестабильный фибрин в стабильный. |
|
Фактор Флетчера |
Плазменный прекалликреин, активирует факторы VII, IX, переводит киинноген в кинин. |
|
Фактор Фитцжеральда |
Киинноген, в активной форме (кинин) активирует фактор XI. |
|
Фактор Виллебранда |
Компонент фактора VIII, вырабатывается в эндотелии, в кровотоке, соединяясь с коагуляционной частью, образует полиоценный фактор VIII (антигемофильный глобулин А). |
20.Система фибринолиза. Противосвертывающая система.
Фибринолиз (от Фибрин и греч. lýsis – разложение, растворение) - процесс растворения тромбов и сгустков крови, неотъемлемая часть системы гемостаза, всегда сопровождающая процесс свертывания крови и культивирующаяся факторами, принимающими участие в данном процессе. Является важной защитной реакцией организма и предотвращает закупоркукровеносных сосудов сгустками фибрина. Также фибринолиз способствует реканализации сосудов после прекращениякровотечения.
Включает в себя расщепление фибрина под воздействием плазмина, присутствующего в плазме крови в виде неактивного предшественника - плазминогена. Последний активируется одновременно с началом процесса свертывания крови.
[править]Внутренний и внешний путь активизации
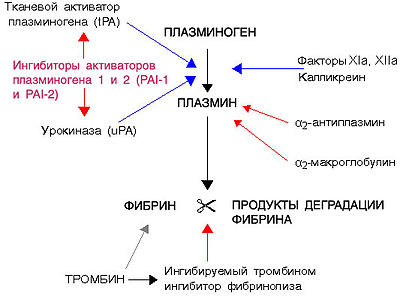
Схема фибринолиза. Синие стрелки - стимуляция; красные стрелки - подавление
Фибринолиз, как и процесс свертывания крови, протекает по внешнему или внутреннему механизму. Внешний путь активации осуществляется при неотъемлемом участии тканевых активаторов, синтезирующихся преимущественно в эндотелии сосудов. К данным активаторам относят тканевый активатор плазминогена(ТАП) и урокиназу.
Внутренний механизм активации осуществляется благодаря плазменным активаторам и активаторамиформенных элементов крови — лейкоцитов, тромбоцитов иэритроцитов. Внутренний механизм активации разделяют на на Хагеман-зависимый и Хагеман-независимый. Хагеман-зависимый фибринолиз происходит под влияниемфактора XIIа свертывания крови, калликреина, которые вызывают превращение плазминогена в плазмин. Хагеман-независимый фибринолиз происходит наиболее быстро. Его основным назначением является очищение сосудистого русла от нестабилизированного фибрина, который образуется в процессе внутрисосудистого свертывания крови.
ПРОТИВОСВЕРТЫВАЮЩАЯ СИСТЕМА КРОВИ Кровь в живом организме находится в жидком состоянии, несмотря на наличие очень мощной свертывающей системы. Многочисленные исследования, направленные на выяснение причин и механизмов поддержаниякрови в жидком состоянии во время циркуляции ее в кровяном русле, позволили в значительной степени выяснить природу противосвертывающей системы крови. Оказалось, что в образовании ее, так же как и в формировании системы свертывания крови, участвует ряд факторов плазмы крови, тромбоцитов и тканей. К ним относят различные антикоагулянты: анти-тромбопластины, антитромбины, а также фибринолитическую систему крови. Считается, что в организме существуют специфические ингибиторы для каждого факторасвертывания крови (антиакцелерин, антиконвертин и др.). Снижение активности этих ингибиторов повышает свертываемость крови и способствует образованию тромбов. Повышение активности ингибиторов, наоборот, затрудняет свертывание крови и может сопровождаться развитием геморрагии. Сочетание явлений рассеянного тромбоза и геморрагии может быть обусловлено нарушением регуляторных взаимоотношений свертывающей и противосвертывающей систем. В кровеносных сосудах имеются хеморецепторы, способные реагировать на появление в крови активноготромбина. Хеморецепторы связаны с ней-рогуморальным механизмом, регулирующим образованиеантикоагулянтов. Таким образом, если тромбин появляется в циркулирующей крови в условиях нормального нейрогуморального контроля, то в этом случае он не только не вызывает свертывания крови, но, напротив, рефлекторно стимулирует образование антикоагулянтов и тем самым выключает свертывающий механизм. Наиболее быстро действующими компонентами противосвертывающей системы являются антитромбины. Они относятся к так называемым прямым антикоагулянтам, так как находятся в активной форме, а не в видепредшественников. Предполагают, что в плазме крови существует около шести различных антитромбинов. Наибольшая антитромбиновая активность присуща антитромбину III; он сильно активируется в присутствиигепарина, обладающего большим отрицательным зарядом. Гепарин способен связываться со специфическим катионным участком антитромбина III, вызывая конформационные изменения его молекулы. В результате этого изменения антитромбин III приобретает возможность связываться со всеми сериновыми протеазами(большинство факторов свертывания крови представляют собой сериновые протеазы). В системе свертывания крови антитромбин III ингибирует активность тромбина, факторов IXa, Xa, XIa и ХIIа. Известно, что небольшое количество гепарина находится на стенках сосудов, вследствие этого снижается активация «внутреннего» пути свертывания крови. У лиц с наследственной недостаточностью антитромбина III наблюдается склонность к образованию тромбов. Гепарин часто используется в качестве препарата, предотвращающего свертывание крови. Действие гепаринав случае его передозировки можно устранить связыванием его рядом веществ – антагонистов гепарина. К ним относится прежде всего протамин (протамина сульфат). Протамин – сильно катионный полипептид, конкурирует с катионными участками антитромбина III за связывание с полианионным гепарином. Не менее важно применение так называемых искусственных антикоагулянтов. Например, витамин Кстимулирует синтез в печени протромбина, проакцелерина, проконвертина, фактора X; для сниженияактивности свертывающей системы крови назначают антикоагулянты типа антивитаминов К. Это прежде всегодикумарин, неодикумарин, пелентан, синкумар и др. Антивитамины К тормозят в клетках печени синтез перечисленных ранее факторов свертывания крови. Этот способ воздействия дает эффект не сразу; а спустя несколько часов или даже дней. |
21.Особенности химического состава, строения и обмена веществ соединительной ткани.
Разновидности соединительной ткани
Соединительная ткань составляет до 50 % массы человеческого организма. Это связующее звено между всеми тканями организма.
Различают 3 вида соединительной ткани:
собственно соединительная ткань;
хрящевая соединительная ткань;
костная соединительная ткань.
Соединительная ткань может выполнять как самостоятельные функции, так и входить в качестве прослоек в другие ткани.
Функции соединительной ткани
Структурная.
Обеспечение постоянства тканевой проницаемости.
Обеспечение водно-солевого равновесия.
Участие в иммунной защите организма.
Состав и строение соединительной ткани
В соединительной ткани различают:межклеточное (основное) вещество, клеточные элементы, волокнистые структуры (коллагеновые волокна). Особенность: межклеточного вещества гораздо больше, чем клеточных элементов.
Межклеточное (основное) вещество
Желеобразная консистенция основного вещества объясняется его составом. Основное вещество - это сильно гидратированный гель, который образован высокомолекулярными соединениями, составляющими до 30 % массы межклеточного вещества. Оставшиеся 70 % - это вода.
Высокомолекулярные компоненты представлены белками и углеводами. Углеводы по своему строению являются гетерополисахаридами - глюкозоаминогликаны (ГАГ). Эти гетерополисахариды построены из дисахаридных единиц, которые и являются их мономерами.
По строению мономеров различают 7 типов глюкозаминогликанов.
Гиалуроновая кислота.
Хондроитин-4-сульфат.
Хондроитин-6-сульфат.
Дерматансульфат.
Кератансульфат.
Гепарансульфат.
Гепарин.
Гиалуроновая кислота. Молекулярная масса этого полимера- до 1 000 000 Da. Мономер построен из глюкуроновой кислоты и N-ацетилглюкозамина. Внутри мономера - 1,3-бета-гликозидная связь, между мономерами - 1,4-бета-гликозидная связь. Гиалуроновая кислота может находиться и в свободном виде, и в составе сложных агрегатов. Это единственный представитель глюкозаминогликанов, который не сульфатирован.
Хондроитин-сульфаты. Два вида:хондроитин-4-сульфат и хондроитин-6-сульфат. Отличаются друг от друга местом расположения остатка серной кислоты. Все они содержат остаток серной кислоты. Мономер хондроитин-сульфата построен из глюкуроновой кислоты и N-ацетилгалактозаминсульфата. Встречаются в связках суставов и в ткани зуба.
Дерматан-сульфат. Его мономер построен из идуроновой кислоты и галактозамин-4-сульфата. Он является одним из структурных компонентов хрящевой ткани.
Кератан-сульфат. Мономер кератан-сульфата состоит из галактозы и N-ацетилглюкозамин-6-сульфата.
Гепатан-сульфат и гепарин. Они сильно сульфатированы (в мономере 2-3 остатка серной кислоты). В состав их входят глюкуронат-2-сульфат и N-ацетилглюкозамин-6-сульфат.
Длинные полисахаридные цепи складываются в глобулы.Однако эти глобулы рыхлые (не имеют компактной укладки) и занимают сравнительно большой объем. Глюкозаминогликаны являются гидрофильными соединениями, содержат много гидроксильных групп, имеют значительный отрицательный заряд (много карбоксильных и сульфогрупп). Значительный отрицательный заряд способствует присоединению к ним положительно заряженных катионов калия, натрия, кальция, магния. Это еще более увеличивает способность удерживать воду, а также способствует диссоциации молекул этих веществ в соединительной ткани.
Глюкозаминогликаны входят в состав сложных белков, которые называются протеогликанами. Глюкозаминогликаны составляют в протеогликанах 95 % их веса. Остальные 5 % веса - это белок. Белковый и небелковый компоненты в протеогликанах связаны прочными, ковалентными связями. Как построена молекула протеогликанов?
Белковый компонент- это особый COR-белок. К нему при помощи трисахаридов присоединяются глюкозаминогликаны. 1 молекула COR-белка может присоединить до 100 ГАГ.
В клетке протеогликаны связаны с гиалуроновой кислотой. Образуется сложный надмолекулярный комплекс. В его составе: гиалуроновая кислота, особые связующие белки, а также протеогликаны. Упругие цепи глюкозаминогликанов в составе протеогликанов образуют образуют макромолекулярные сетчатые структуры. Такое химическое строение обеспечивает выполнение функции молекулярного сита с определенными размерами пор при транспорте различных веществ и метаболитов. Размер пор определяется типом ГАГ, преобладающим в данной конкретной ткани. Например, соединительнотканая капсула почечного клубочка обеспечивает селективный транспорт веществ в процессе ультрафильтрации. За счет множества сульфо- и карбоксильных групп сетчатые структуры являются полианионами, способными депонировать воду, некоторые катионы (К+, Na+, Ca+2, Mg+2).
Кроме протеогликанов, основное вещество содержит гликопротеины.
Гликопротеины.
Их углеводный компонент- это олигосахарид, состоящий 10-15 мономерных единиц. Этими мономерными единицами могут быть в основном минорные моносахариды: манноза, метилпентозы рамноза и фукоза, арабиноза, ксилоза. На конце этого олигосахарида имеется еще одно производное моносахаридов: сиаловые кислоты (ацильные производные нейраминовой кислоты). Если в крови увеличивается концентрация сиаловых кислот - значит, идет распад межклеточного матрикса. Это бывает при воспалении.
Гликопротеины делят на 2 группы:
растворимые;
нерастворимые.
Углеводная часть гликопротеинов очень вариабельна. Важное значение имеет последовательность моносахаридов, как и последовательность аминокислот в белковой части.
Из гликопротеинов наиболее изучены растворимый фибронектин и нерастворимый ламинин.
Растворимые гликопротеины представлены особым белком - фибронектином. Молекулярная масса фибронектина - 440 kDa. Он состоит из двух полипептидных цепей, соединенных дисульфидным мостиком. Имеет центры связывания с протеогликанами, с волокнистыми структурами, гликолипидами клеточных мембран. Поэтому фибронектин называют "молекулярным клеем". Он обычно располагается на поверхности фибробластов и участвует в адгезии всех перечисленных клеточных структур, а, значит, и клеток. Известно, что при опухолевых заболеваниях количество фибронектина снижается, что способствует метастазированию опухоли.
К растворимым гликопротеинам также относятся COR-белок - компонент протеогликанов, связующие белки, а также целый ряд белков плазмы крови.
Нерастворимые гликопротеины образуют "каркас", "строму" межклеточного матрикса.
К нерастворимым гликопротеинам относится ламинин. Молекулярная масса этого белка - 10 000 kDa. Содержит такие же углеводные компоненты, как и ганглиозиды клеточных мембран.
Углеводные компоненты гликопротеинов также, как и углеводные компоненты гликопротеинов обладают свойствами тканевых антигенов.
Катаболизм компонентов основного вещества. Идет под действием некоторых гидролаз.
Например, нейраминидаза отщепляет от гликопротеинов N-ацетилнейраминовую (сиаловую) кислоту, и уже дестабилизированный гликопротеин поглощается макрофагами. Поэтому концентрация сиаловых кислот в крови - характеристика состояния соединительной ткани. При воспалительных процессах эта концентрация намного возрастает.
При недостаточности ферментов катаболизма основного вещества развиваются заболевания - мукополисахаридозы, при которых в тканях происходит накопление тех или иных ГАГ.
Волокна соединительной ткани
В межклеточном матриксе находятся 2 типа волокнистых структур:Коллагеновые и эластиновые волокна. Основным их компонентом является нерастворимый белок коллаген.
Коллаген- сложный белок, относится к группе гликопротеинов, имеет четвертичную структуру, его молекулярная масса составляет 300 kDa. Составляет 30 % от общего количества белка в организме человека. Его фибриллярная структура - это суперспираль, состоящая из 3-х -цепей. Нерастворим в воде, солевых растворах, в слабых растворах кислот и щелочей. Это связано с особенностями первичной структуры коллагена. В коллагене 70 % аминокислот являются гидрофобными. Аминокислоты по длине полипептидной цепи расположены группами (триадами), сходными друг с другом по строению, состоящими из трех аминокислот. Каждая третья аминокислота в первичной структуре коллагена - это глицин (триада (или группа): (гли-X-Y)n, где X - любая аминокислота или оксипролин, Y - любая аминокислота или оксипролин или оксилизин). Эти аминокислотные группы в полипептидной цепи многократно повторяются.
Необычна и вторичная структура коллагена:шаг одного витка спирали составляют только 3 аминокислоты (даже немного меньше, чем 3), а не 3.6 аминокислоты на 1 виток, как это наблюдается у других белков. Такая плотная упаковка спирали объясняется присутствием глицина. Эта особенность определяет высшие структуры коллагена. Молекула коллагена построена из 3-х цепей и представляет собой тройную спираль. Эта тройная спираль состоит из 2-х -1-цепей и одной -2-цепи. В каждой цепи 1000 аминокислотных остатков. Цепи параллельны и имеют необычную укладку в пространстве: снаружи расположены все радикалы гидрофобных аминокислот. Известно несколько типов коллагена, различающихся генетически.
Синтез коллагена. Существуют 8 этапов биосинтеза коллагена: 5 внутриклеточных и 3 внеклеточных.
1-й этап
Протекает на рибосомах, синтезируется молекула-предшественник: препроколлаген.
2-й этап
С помощью сигнального пептида "пре" транспорт молекулы в канальцы эндоплазматической сети. Здесь отщепляется "пре" - образуется "проколлаген".
3-й этап
Аминокислотные остатки лизина и пролина в составе молекулы коллагена подвергаются окислению под действием ферментов пролилгидроксилазы и лизилгидроксилазы (эти окислительные ферменты относятся к подподклассу монооксигеназ).
При недостатке витамина "С"- аскорбиновой кислоты наблюдается цинга, - заболевание, вызванное синтезом дефектного коллагена с пониженной механической прочностью, что вызывает, в частности, разрыхление сосудистой стенки и другие неблагоприятные явления.
4-й этап
Посттрасляционная модификация- гликозилирование проколлагена под действием фермента гликозил трансферазы. Этот фермент переносит глюкозу или галактозу на гидроксильные группы оксилизина.
5-й этап
Заключительный внутриклеточный этап- идет формирование тройной спирали - тропоколлагена (растворимый коллаген). В составе про-последовательности - аминокислота цистеин, который образует дисульфидные связи между цепями. Идет процесс спирализации.
6-й этап
Секретируется тропоколлаген во внеклеточную среду, где амино- и карбоксипротеиназы отщепляют (про-)-последовательность.
7-й этап
Ковалентное "сшивание" молекулы тропоколлагена по принципу "конец-в-конец" с образованием нерастворимого коллагена. В этом процессе принимает участие фермент лизилоксидаза (флавометаллопротеин, содержит ФАД и Cu). Происходит окисление и дезаминирование радикала лизина с образованием альдегидной группы. Затем между двумя радикалами лизина возникает альдегидная связь.
Только после многократного сшивания фибрилл коллаген приобретает свою уникальную прочность, становится нерастяжимым волокном.
Лизилоксидаза является Cu-зависимым ферментом, поэтому при недостатке меди в организме происходит уменьшение прочности соединительной ткани из-за значительного повышения количества растворимого коллагена (тропоколлагена).
8-й этап
Ассоциация молекул нерастворимого коллагена по принципу "бок-в-бок". Ассоциация фибрилл происходит таким образом, что каждая последующая цепочка сдвинута на 1/4 своей длины относительно предыдущей цепи.
Эластические волокна
Второй вид волокон - эластические.В основе строения - белок эластин. Эластин еще более гидрофобен, чем коллаген. В нем до 90 % гидрофобных аминокислот. Много лизина, есть участки со строго определенной последовательностью расположения аминокислот. Цепи укладываются в пространстве в виде глобул. Глобула из одной полипептидной цепи называется -эластин. За счет остатков лизина происходит взаимодействие между молекулами -эластина.
В образовании этой структуры принимают участие радикалы аминокислоты лизина. Это структура десмозина. Десмозин - это структура пиридина, которая образуется при взаимодействии лизина 4-х молекул -эластина.
Клеточные элементы соединительной ткани
Это фибробласты, тучные клетки и макрофаги.В них происходят процессы синтеза структурных компонентов, а также процесс распада соединительной ткани. Коллаген обновляется на 50 % за 10 лет. В фибробластах идут синтетические процессы: синтез коллагена, эластина.
22.Гликозаминогликаны и протеогликаны соединительной ткани.
Гликозаминогликаны — линейные отрицательно заряженные гетерополисахариды. Раньше их называли мукополисахариды, так как они обнаруживались в слизистых секретах (мукоза) и придавали этим секретам вязкие, смазочные свойства. Эти свойства обусловлены тем, что гликозаминогликаны могут связывать большие количества воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Протеогликаны — высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (90-95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани.
Белки в протегликанах представлены одной полипептидной цепью разной молекулярной массы. Полисахаридные компоненты у разных протеогликанов разные. Протеогликаны отличаются от большой группы белков, которые называются гликопротеинами. Эти белки тоже содержат олигосахаридные цепи разной длины, ковалентно присоединенные к полипептидной основе. Углеводный компонент гликопротеинов гораздо меньше по массе, чем у протеогликанов, и составляет не более 40% от общей массы. Гликопротеины выполняют в организме человека разные функции и присутствуют во всех классах белков — ферментах, гормонах, транспортных, структурных белках и др. Представители гликопротеинов — коллаген и эластин, иммуноглобулины, ангиотензиноген, трансферин, церулоплазмин, внутренний фактор Касла, тиреотропный гормон.
Гликозаминогликаны и протеогликаны, являясь обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Благодаря особенностям своей структуры и физико-химическим свойствам, протеогликаны и гликозаминогликаны могут выполнять в организме человека следующие свойства: 1. Они являются структурными компонентами межклеточного матрикса. 2. Гликозаминогликаны и протеогликаны специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса. 3. Все гликозаминогликаны и протеогликаны, являясь полианионами, могут присоединять, кроме воды, большое количества катионов и таким образом участвовать в формировании тургора различных тканей. 4. Гликозаминогликаны и протеогликаны играют роль молекулярного сита в межклеточном матриксе, они припятствуют распространению патогенных микроорганизмогв. 5. Гиалуроновая кислота и протеогликаны выполняют рессорную функцию в суставных хрещах. 6. Гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках. 7. Кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы. 8. Гепарин — антикоагулянт. 9. Гепаринсульфаты — компоненты плазматических мембран, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических и других пузырьков.
Классы гликозаминогликанов
Гиалуроновая кислота находится во многих органах и тканях. В хряще она связана с белком и участвует в образовании протеогликановых агрегатов, в некоторых органах (стекловидное тело глаза, пупочный канатик, суставочная жидкость) встречается и в свободном виде. Предполагается, что в суставной жидкости гиалуроновая кислота выполняет роль смазочного вещества, уменьшая трение между суставными поверхностями.
Хондроитинсульфаты — самые распространенные гликозаминогликаны в организме человека; они содержатся в хряще, коже, сухожилиях, связях, артериях, роговице глаза. Хондроитинсульфаты являются важным составным компонентом агрекана — основного протеогликана хрящевого матрикса.
Кератансульфаты — наиболее гетерогенные гликозаминогликаны; отличаются друг от друга по суммарному содержанию углеводов и распределению в разных тканях.
Дерматансульфаты широко распространен в тканях животных, особенно он характерен для кожи, кровеносных сосудов, сердечных клапаов. В составе малых протеогликанов (бигликана и дикорина) дерматансульфат содержится в межклеточном веществе хрящей, межпозвоночных дисков, менисков.
Гепарин — важный компонент противосвертывающей системы крови (его применяют как антикоагулянт при лечении тромбозов). Он синтезируется тучными клетками и находится в гранулах внутри этих клеток. Наибольшие количества гепарина обнаруживается в легких, речени и коже.
Гепарансульфат находится во многих органах и тканях. Он входит в состав протеогликанов базальных мембран. Гепарансульфат является постоянным компонентом клеточной поверхности
23.Коллаген: особенности аминокислотного состава, первичной и вторичной пространственной структуры. Биосинтез коллагена. Роль витамина С. Проявления недостаточности витамина С. Изменения соединительной ткани при старении, коллагенозах, заживлении ран. Оксипролинурия при коллагенозах.
Коллагены - семейство родственных фибриллярных белков, секретируемых клетками соединительной ткани. Коллагены - самые распространённые белки не только межклеточного матрикса, но и организма в целом, они составляют
56
около 1/4 всех белков организма человека. В межклеточном матриксе молекулы коллагена образуют полимеры, называемые фибриллами коллагена (более подробно это описано в разделе 15). Фибриллы коллагена обладают огромной прочностью и практически нерастяжимы. Они могут выдерживать нагрузку, в 10 000 раз превышающую их собственный вес. По прочности коллагеновые фибриллы превосходят прочность стальной проволоки того же сечения. Именно поэтому большое количество коллагеновых волокон, состоящих из коллагеновых фибрилл, входит в состав кожи, сухожилий, хрящей и костей.
Необычные механические свойства коллагенов связаны с их первичной и пространственной структурами. Молекулы коллагена состоят из трёх полипептидных цепей, называемых α-цепями. Идентифицировано более 20 α-цепей, большинство которых имеет в своём составе 1000 аминокислотных остатков, но цепи несколько отличаются аминокислотной последовательностью. В состав коллагенов могут входить три одинаковые или разные цепи.
Первичная структура α-цепей коллагена необычна, так как каждая третья аминокислота в полипептидной цепи представлена глицином, около 1/4 аминокислотных остатков составляют пролин или 4-гидроксипролин, около 11% - аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан, α гистидин, метионин и тирозин находятся лишь в очень небольшом количестве. В составе первичной структуры α-цепи коллагена содержится также необычная аминокислота - гидроксилизин. Полипептидную цепь коллагена можно представить как последовательность триплетов Гли-X-Y, где X и Y могут быть любыми аминокислотами, но чаще в положении X стоит пролин, а в положении Y - гидроксипролин или гидроксилизин. Каждая из этих аминокислот имеет большое значение для формирования коллагеновых фибрилл.
Пролин благодаря своей структуре вызывает изгибы в полипептидной цепи, стабилизируя ле-возакрученную спиральную конформацию. На один виток спирали приходится 3 аминокислотных остатка, а не 3,6, как это характерно для вторичной структуры глобулярных белков. Спираль пептидной цепи коллагена стабилизирована не за счёт водородных связей (так как пролин их не образует), а силами стерического отталкивания пирролидиновых колец в остатках пролина. В результате расстояние между аминокислотными остатками по оси спирали увеличивается, и она оказывается более развёрнутой по сравнению с туго закрученной α-спиралью глобулярных белков.
Спирализованные полипептидные цепи, перевиваясь друг около друга, образуют трёхце-почечную правозакрученную суперспиральную молекулу, часто называемую тропоколлагеном (рис. 1-41). Цепи удерживаются друг около друга за счёт водородных связей, возникающих между амино- и карбоксильными группами пептидного остова разных полипептидных цепей, входящих в состав трёхспиральной молекулы. "Жёсткие" аминокислоты - пролин и гидроксипролин - ограничивают вращение полипептидного стержня и увеличивают тем самым стабильность тройной спирали. Глицин, имеющий вместо радикала атом водорода, всегда находится в месте пересечения цепей; отсутствие радикала позволяет цепям плотно прилегать друг к другу.
В результате такого скручивания пептидных остовов полипептидных цепей и наличия удлинённой структуры два других радикала из триады аминокислот Гли-X-Y оказываются на наружной поверхности молекулы тропоколлагена. Некоторые комплементарные участки молекул тропоколлагена могут объединяться друг с другом, формируя коллагеновые фибриллы, причём эти участки расположены таким образом, что одна нить тропоколлагена сдвинута по отношению к другой примерно на 1/4 (рис. 1-42). Между радикалами аминокислот возникают ионные, водородные и гидрофобные связи.
Важную роль в формировании коллагеновых фибрилл играют модифицированные аминокислоты: гидроксипролин и гидроксилизин. Гидроксильные группы гидроксипролина соседних цепей тропоколлагена образуют водородные связи, укрепляющие структуру коллагеновых фибрилл. Радикалы лизина и гидроксилизина необходимы для образования прочных поперечных сшивок между молекулами тропоколлагена, ещё сильнее укрепляющие структуру коллагеновых фибрилл. Кроме того, к гидроксильной группе гидроксилизина могут присоединяться углеводные остатки (гликозилирование коллагена), функция которых пока неясна.
Таким образом, аминокислотная последовательность полипептидных цепей коллагена позволяет сформировать уникальную по своим механическим свойствам структуру, обладающую огромной прочностью. Изменение в первичной структуре коллагена может приводить к развитию наследственных болезней (см. раздел 15).
Биосинтез коллагена
Предшественник коллагена (препропептид) синтезируется на рибосомах на поверхности гранул ШЭР. Прежде чем превратиться в зрелую форму белок-предшественник подвергается значительной посттрансляционной модификации в эндоплазматическом ретикулуме и аппарате Гольджи (см. рис. 225). Отщепление сигнальногопептида (1) приводит к образованию проколлагена. Молекула проколлагена все еще несет на одном конце длинный пропептид. Далее следует гидроксилирование многих остатков пролина и ряда остатков лизина (2). Некоторые остатки гидроксилизина дополнительно гликозилируются (3). Окисление остатков цистеинаприводит к образованию внутри- и межмолекулярных дисульфидных связей (4), которые обеспечивают правильное скручивание полипептидных цепей в тройную спираль (5). Прежде чем секретироваться в межклеточное пространство, молекула проколлагена должна пройти стадии модификации и правильной сборки. В процессе транспорта через плазматическую мембрану отщепляются N- и С-концевые пропептиды (6). Коллаген выходит из клетки и в результате ступенчатой сборки образует микрофибриллы (7). Наконец, ε-аминогруппы некоторых остатков лизина подвергаются ферментативному окислению с образованием альдегидных групп (8). Последний этап — конденсация (9) с образованием внутри- и межмолекулярных поперечных связей, в результате чего фибриллы коллагена приобретают окончательную структуру, характеризующуюся прочностью на разрыв и высокой устойчивостъю к действию протеиназ.
В организме коллагены выполняют разнообразные биологические функции (см. с. 336). О важной роликоллагенов убедительно свидетельствует множество наследственных генетических дефектов, связанных смутациями в молекулах коллагенов или ферментов, принимающих участие в их биосинтезе. Такие дефектымогут оказывать влияние на структуру и функцию цитоскелета, связок, сухожилий, кожи, глаз, кровеносныхсосудов, волос и даже размеров тела (примером служит синдром Элера-Данлоса).
Гидроксилирование остатков пролина и лизина в молекуле проколлагена катализируется проколлаген-гидроксилазами, имеющими в активном центре атомы железа. В качестве кофермента используется аскорбат (витамин С, см. с. 356). Симптомы дефицита витамина С, такие, как выпадение зубов, кровоточивость десен или повреждения кожи (цинга), объясняются нарушением биосинтеза коллагенов.
Витамин С играет жизненно важную роль в формировании коллагена. Безвитамина С нарушается процесс образования коллагена, что приводит к возникновению многих расстройств в организме человека.
Врачи давно (тогда еще не было известно о существовании витаминов) заметили, что у больных цингой открываются старые раны, а новые плохо заживают. Теперь же известно, что причина цинги - авитаминоз, который нарушает образование важного для заживления ран белка - коллагена. Этот белок связывает отдельные клетки организма в единое целове.
Коллаген является тем соединительным веществом, которое соединяет отдельные части человеческого тела. Именно благодаря этой ткани мышцы крепятся к скелету, кожа – к мышцам, а все это держится вместе. Коллаген характеризуется высокой крепостью на разрыв и представляет собой негибкий волокнистый белок, который является основной составляющей соединительной ткани, включая кости, зубы, хрящи, сухожилия, связки суставов, кожу и кровеносные сосуды.
Целость самой структуры человеческого тела зависит от коллагена, а целость коллагена, в свою очередь, зависит от витамина С.
Человек является одним из трех видов млекопитающих, чей организм не способен сам вырабатывать витамин С. Витамин С является первым водорастворимым антиоксидантом человеческого организма. Он абсорбируется активной транспортной системой, которая находится в кишечнике, и выводится почками
Общим возрастным изменением, которое свойственно всем видам соединительной ткани, является уменьшение содержания воды и отношения основное вещество/волокна. Показатель этого соотношения уменьшается как за счет нарастания содержания коллагена, так и в результате снижения концентрациигликозаминогликанов. В первую очередь значительно снижается содержание гиалуроновой кислоты. Однако не только уменьшается общее количество кислых гликозаминогликанов, но изменяется и количественное соотношение отдельных гликанов. Одновременно происходит также изменение физико-химических свойствколлагена (увеличение числа и прочности внутри- и межмолекулярных поперечных связей, снижение эластичности и способности к набуханию, развитие резистентности к кол-лагеназе и т.д.), повышается структурная стабильность коллагеновых волокон (прогрессирование процесса «созревания» фибриллярных структур соединительной ткани). Следует помнить, что старение коллагена in vivo неравнозначно износу. Оно является своеобразным итогом протекающих в организме метаболических процессов, влияющих на молекулярную структуру коллагена.
Среди многих поражений соединительной ткани особое место занимают коллагенозы. Для них характерно повреждение всех структурных составных частей соединительной ткани: волокон, клеток и межклеточного основного вещества. К коллагенозам обычно относят ревматизм, ревматоидный артрит, системную красную волчанку, системную склеродермию, дерма-томиозит и узелковый периартериит. Каждое из этих заболеваний имеет своеобразное течение и сугубо индивидуальные проявления. Среди многочисленных теорий развитияколлагенозов наибольшее признание получила теория инфекционно-аллергического происхождения.
Наконец, необходимо отметить, что нарушение процесса гидроксили-рования коллагена – один из биохимических дефектов при цинге. Коллаген, синтезированный в отсутствие или при дефиците аскорбиновой кислоты, оказывается недогидроксилированным и, следовательно, имеет пониженную температуруплавления. Такой коллаген не может образовать нормальные по структуре волокна, что и приводит к поражению кожи и ломкости сосудов, столь четко выраженных при цинге.
24.Особенности химического состава и обмена веществ мышц. Химический состав поперечно-полосатых мышц. Саркоплазматические белки: миоглобин, его строение и функции. Важнейшие белки миофибрил: миозин, актин, актомиозин, тропомиозин, тропонин. Молекулярная структура миофибрил. Особенности энергетического обмена в мышцах. Роль градиента одновалентных ионов и ионов кальция в регуляции мышечного сокращения. Особенности химического состава миокарда и гладкой мускулатуры. Биохимические изменения при мышечных дистрофиях и денервации мышц
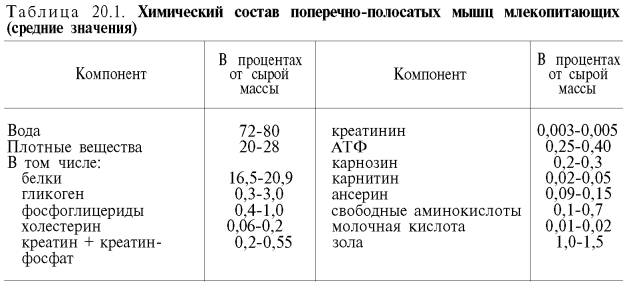
В мышечной ткани взрослых животных и человека содержится от 72 до 80% воды. Около 20–28% от массы мышцы приходится на долю сухого остатка, главным образом белков. Помимо белков, в состав сухого остатка входят гликоген и другие углеводы, различные липиды, экстрактивные азотсодержащие вещества, солиорганических и неорганических кислот и другие химические соединения (табл. 20.1).
Белки, входящие в состав саркоплазмы, относятся к протеинам, растворимым в солевых средах с низкой ионной силой. Принятое ранее подразделение саркоплазматических белков на миоген, глобулин X, миоальбумин и белки-пигменты в значительной мере утратило смысл, поскольку существование глобулина X и миогена как индивидуальных белков в настоящее время отрицается. Установлено, что глобулин X представляет собой смесь различных белковых веществ со свойствами глобулинов. Термин «миоген» также является собирательным понятием. В частности, в состав белков группы миогена входит ряд протеинов, наделенных ферментативной активностью: например, ферменты гликолиза. К числу саркоплазмати-ческихбелков относятся также дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обмена. Недавно была открыта группа саркоплазматических белков – пар-вальбумины, которые способны связывать ионы Са2+. Их физиологическая роль остается еще неясной.
Миоглоби́н — кислород-связывающий белок скелетных мышц и мышцы сердца.
Миоглобин скелетных мышц и миоглобин миокарда (сердечной мышцы) слегка различны по аминокислотнойпоследовательности. В практической медицине этот факт используется для определения диагноза инфаркта миокарда по появлению специфического «сердечного» изотипа миоглобина (равно как и «сердечных» изотипов некоторых мышечныхферментов) в крови.
В нормальных условиях, в отсутствие повреждения или воспаления мышечной ткани, миоглобин в кровь не попадает.
Подобно гемоглобину, миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию отдавания кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии.
Самоотравление организма свободным миоглобином и как следствие острая почечная недостаточность и тканевая гипоксия — одна из главных причин смерти при синдроме длительного сдавливания (крэш-синдром), встречающемся при тяжелых травмах со сдавлением или размозжением значительных количеств мышечной ткани.
К группе миофибриллярных белков относятся миозин, актин и актомио-зин – белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белкитесно связаны с сократительной функцией мышц.
Миозин составляет 50–55% от сухой массы миофибрилл. Представление о миозине как о главном белкемиофибрилл сложилось в результате работ А.Я. Данилевского, О. Фюрта, Э. Вебера и ряда других исследователей. Однако всеобщее внимание к миозину было привлечено лишь после опубликования работ В.А. Энгельгардта и М.Н. Любимовой (1939– 1942). В этих работах впервые было показано, что миозинобладает АТФазной активностью, т.е. способностью катализировать расщепление АТФ на АДФ и Н3РО4. Химическая энергия АТФ, освобождающаяся в ходе данной ферментативной реакции, превращается в механическую энергию сокращающейся мышцы. Молекулярная масса миозина скелетных мышц около 500000 (для миозина кролика 470000). Молекула миозина (рис. 20.3) имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи с мол. массой 205000–210000 и несколько коротких легких цепей, мол. масса которых около 20000. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы), способную соединяться с актином. Эти «головки» выдаются из основного стержня молекулы. Легкие цепи, находящиеся в «головке» миозиновоймолекулы и принимающие участие в проявлении АТФазной активности миозина, гетерогенны по своему составу. Количество легких цепей в молекуле миозина у различных видов животных и в разных типах мышц неодинаково.
Кратковременная обработка трипсином расщепляет молекулу миозина на два фрагмента. Из хвостового участка (С-концевой участок молекулы) образуется легкий меромиозин (ЛММ) - фрагмент длиной 90 нм, а из остальной части, включающей «головки»,- тяжелый меромиозин (ТММ). ЛММ, подобно миозину, образует нити, однако он не обладает АТФазной активностью и не связывает актин. ТММ катализирует гидролиз АТФ и связывает актин. ТММ можно расщепить далее путем более длительной обработки трипсином или папаином, в результате чего получается один S2-фрагмент длиной 40 нм с мол. массой 62000 и два S1-фрагмента с мол. массой 110000, представляющие собой «головки» миозина.
Толстые нити (толстые миофиламенты) в саркомере надо понимать как образование, полученное путем соединения большого числа определенным образом ориентированных в пространстве молекул миозина (рис. 20.4).
Актин, составляющий 20% от сухой массы миофибрилл, был открыт Ф. Штраубом в 1942 г. Известны две формы актина: глобулярный актин (G-актин) и фибриллярный актин (F-актин). Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в обра-зовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полиме-ризуется в F-актин (фибриллярная форма). На электронныхмикрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой (рис. 20.5).
Актомиозин образуется при соединении миозина с F-актином. Ак-томиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозиназначительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозинактивируется ионами Mg2+и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрациейАТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокойконцентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны.
Как отмечалось, кроме рассмотренных основных белков, в миофибрил-лах содержатся также тропомиозин, тропонин и некоторые другие ре-гуляторные белки.
Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня длиной 40 нм; его мол. масса 65000. На долю тропомиозина приходится около 4–7% всех белковмиофибрилл.
Тропонин – глобулярный белок, открытый С. Эбаси в 1963 г.; его мол. масса 80000. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазнуюактивность, ТН-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозин-связывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиози-ном. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+ (рис. 20.6).
Установлено, что тропонин (его субъединицы Тн-Т и Тн-I) способен фосфорилироваться при участии цАМФ-зависимых протеинкиназ. Вопрос о том, имеет ли отношение фосфорилирование тропонина in vitro к регуляции мышечного сокращения, остается пока открытым.
Белки стромы в поперечно-полосатой мускулатуре представлены в основном коллагеном и эластином. Известно, что строма скелетных мышц, остающаяся после исчерпывающей экстракции мышечной кашицы солевыми растворами с высокой ионной силой, состоит в значительной мере из соединительнотканных элементов стенок сосудов и нервов, а также сарколеммы и некоторых других структур.
Миофибриллы — органеллы клеток поперечнополосатых мышц, обеспечивающие их сокращение. Служат для сокращений мышечных волокон. Миофибрилла — нитевидная структура, состоящая изсаркомеров. Каждый саркомер имеет длину около 2 мкм и содержит два типа белковых филаментов: тонкие миофиламенты из актина и толстые филаменты из миозина. Границы между филаментами (Z-диски) состоят из особых белков, к которым крепятся ±концы актиновых филаментов. Миозиновые филаменты также крепятся к границам саркомера с помощью нитей из белка титина (тайтина). С актиновыми филаментами связаны вспомогательные белки — небулин и белки тропонин-тропомиозиновогокомплекса.
У человека толщина миофибрилл составляет 1-2 мкм, а их длина может достигать длины всей клетки (до нескольких сантиметров). Одна клетка содержит обычно несколько десятков миофибрилл, на их долю приходится до 2/3 сухой массы мышечных клеток.
Даже в условиях полного покоя человек расходует некоторое количество энергии: в организме непрерывно тратится энергия на физиологические процессы, которые не останавливаются ни на минуту. Минимальный для организма уровень обмена веществ и энергетических затрат называют основным обменом. Основной обмен определяют у человека в состоянии мышечного покоя – лежа, натощак, т. е. через 12–16 ч после еды, при температуре окружающей среды 18–20 °C (температура комфорта). У человека среднего возраста основной обмен составляет 4187 Дж на 1 кг массы в час. В среднем это 7 140 000-7 560 000 Дж в сутки. Для каждого человека величина основного обмена относительно постоянна.
Особенности основного обмена у детей. Поскольку на единицу массы у детей приходится относительно большая поверхность тела, чем у взрослого человека, основной обмен у них интенсивнее, чем у взрослых. У детей также значительно преобладание процессов ассимиляции над процессами диссимиляции. Энергетические затраты на рост тем больше, чем моложе ребенок. Так, расход энергии, связанный с ростом, в возрасте 3 месяцев составляет 36 %, в возрасте 6 месяцев – 26 %, 9 месяцев – 21 % общей энергетической ценности пищи.
Основной обмен на 1 кг массы у взрослого человека составляет 96 600 Дж. Таким образом, у детей 8-10 лет основной обмен в два или два с половиной раза выше, чем у взрослых.
Величина основного обмена у девочек несколько ниже, чем у мальчиков. Это различие начинает проявляться уже во второй половине первого года жизни. Выполняемая работа у мальчиков влечет более высокий расход энергии, чем у девочек.
Определение величины основного обмена часто имеет диагностическое значение. Повышается основной обмен при избыточной функции щитовидной железы и некоторых других заболеваниях. При недостаточности функции щитовидной железы, гипофиза, половых желез основной обмен снижается.
Расход энергии при мышечной деятельности. Чем тяжелее мышечная работа, тем больше энергии тратит человек. У школьников подготовка к уроку, урок в школе требуют энергии на 20–50 % выше энергии основного обмена.
При ходьбе затраты энергии на 150–170 % превышают основной обмен. При беге, подъеме по лестнице затраты энергии превышают основной обмен в 3–4 раза.
Тренировка организма значительно сокращает расход энергии на выполняемую работу. Это связано с уменьшением числа мышц, принимающих участие в работе, а также с изменением дыхания и кровообращения.
У людей разных профессий затраты энергии различны. При умственном труде энергетические затраты ниже, чем при физическом. У мальчиков общий суточный расход энергии больше, чем у девочек.
Ключевая роль в регуляции мышечного сокращения принадлежит ионам кальция (Са2+). Миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться лишь при наличии в среде определенных концентраций ионов кальция. В покоящейся мышце концентрация ионов Са2+ поддерживается ниже пороговой величины при участии Са2+-зависимой АТФазы. В состоянии покоя эта система активного транспорта накапливает кальций в цистернах саркоплазматического ретикулума и трубочках Т-системы. Мышечное сокращение инициируется приходом потенциала действия на концевую пластинку двигательного нерва. В синапс выделяется ацетилхолин, который связывается с постсинаптическими рецепторами мышечного волокна. Далее потенциал действия распространяется вдоль сарколеммы к поперечным трубочкам Т-системы и происходит передача сигнала на цистерны саркоплазматического ретикулума. Последние начинают освобождать находящийся в них кальций в саркоплазму. Концентрация Са2+ увеличивается с 10-7 до 10-5 ммоль/л. Кальций связывается с Тн-С, что вызывает конформационные сдвиги, передающиеся на тропомиозин и далее - на актин. Открываются закрытые ранее центры в актине для связывания с миозином. Актин взаимодействует с миозином, что инициирует сокращение мышечного волокна. После прекращения действия двигательного импульса кальций с помощью Са2+-зависимой АТФазы откачивается из цитоплазмы в цистерны саркоплазматического ретикулума. Уход кальция из комплекса с Тн-С приводит к смещению тропомиозина и закрытию активных центров актина. Миозиновая «головка» отсоединяется от актина. Мышца расслабляется. Кальций является аллостерическим модулятором мышечного сокращения. Деполяризация Т-трубочек Выброс Са2+ из цистерн саркоплазматического ретикулума Комплекс Тн-С + 4Са2+ Тропонин (активный) Тропомиозин (активный) F – актин Актин – Миозин АДФ, Фн сократительный цикл
Сердечная мышца по содержанию ряда химических соединений занимает промежуточное положение между скелетной мускулатурой и гладкими мышцами. Так, общее содержание белкового азота в скелетных мышцах кролика составляет 30–31 мг/г, а в гладкой мускулатуре (миометрий) – до 20,3 мг/г. В сердечной мышце и особенно в гладких мышцах значительно меньше миофибриллярных белков, чем в скелетной мышце. Общее содержание миофибриллярных белков в гладкоймышечной ткани желудка примерно в 2 раза ниже, чем в скелетных мышцах. Концентрация белков стромы в гладких мышцах и миокарде выше, чем в скелетной мускулатуре. Известно, что миозин, тропомиозин и тропонин сердечной мышцы и гладкой мускулатуры заметно отличаются по своим физико-химическим свойствам от соответствующих белков скелетной мускулатуры. Отмечены определенные особенности и во фракциях саркоплазматических белков. Саркоплазма гладкой мускулатуры и миокарда в процентном отношении содержит больше миоальбумина, чем саркоплазма скелетной мускулатуры. СодержаниеАТФ в сердечной мышце на 1 г ткани (2,60 мкмоль) ниже, чем в скелетной (4,43 мкмоль), и выше, чем в гладкой мускулатуре (1,38 мкмоль). По содержанию гликогена сердечная мышца также занимает промежуточное положение между скелетной и гладкой мускулатурой. По данным С.Е. Северина (1965), как в сердечной, так и в гладкой мускулатуре обнаруживаются лишь следы ансерина и карнозина (не более 0,1 г на 1 кг сырой массы).
Имеется определенная зависимость между характером работы мышц и содержанием фосфоглицеридов. Миокард по сравнению с другими мышечными тканями богаче фосфоглицеридами, при окислении которых, по-видимому, вырабатывается значительная часть энергии, необходимой для его сокращения.
Общими для большинства заболеваний мышц (прогрессирующие мышечные дистрофии, атрофия мышц в результате их денервации, тенотомия, полимиозит, некоторые авитаминозы и т.д.) являются резкое снижение в мышцах содержания миофибриллярных белков, возрастание концентрации белков стромы и некоторых саркоплазматических белков, в том числе миоальбумина. Наряду с изменениями фракционного состава мышечных белков при поражениях мышц наблюдается снижение уровня АТФ и креа-тинфосфата. Например, через 12 дней после денервации содержание АТФ в денервированной икроножной мышце кролика снижается более чем в 2 раза. Отмечаются также снижение АТФазной активности контрактиль-ных белков (миозина), уменьшение количества имидазолсодержащих ди-пептидов.
При прогрессирующих мышечных дистрофиях и других заболеваниях, связанных с распадом мышечной ткани, часто отмечаются сдвиги в фос-фолипидном составе мышц: значительно снижается уровень фосфатидил-холина и фосфатидилэтаноламина, концентрация сфингомиелина и лизо-фосфатидилхолина повышается. До сих пор истинные механизмы изменения фосфолипидного состава мышечной ткани при патологии не выяснены, неизвестна также роль этих сдвигов в патогенезе мышечных дистрофий.
Для многих форм патологии мышечной ткани характерны нарушение метаболизма креатина и его усиленное выделение с мочой (креатинурия). Несмотря на многочисленные исследования и обилие фактического материала, вопрос о причинах креатинурии при заболеваниях мышц не может считаться окончательно решенным.
Принято считать, что креатинурия у больных миопатией является результатом нарушения в скелетной мускулатуре процессов фиксации (удержания) креатина и его фосфорилирования. Если нарушен процесс синтеза креатинфосфата, то не образуется и креатинина; содержание последнего в моче резко снижается. В результате креатинурии и нарушения синтеза креатинина резко повышается креатиновый показатель (креа-тин/креатинин) мочи. Данный механизм представлен на рис. 20.9.
При патологии мышечной ткани можно наблюдать определенную закономерность в изменении активности ферментов в мышцах: уменьшается активность ферментов, локализованных в саркоплазме; незначительно изменяется активность ферментов, связанных с митохондриями; заметно возрастает активность лизосомальных ферментов. Наконец, показано, что при многих заболеваниях мышечной системы наступают сдвиги в системе цАМФ: снижается содержание цАМФ в мышечной ткани, повышается активность фосфодиэстеразы и нарушается способность аденилатциклазы активироваться под влиянием адреналина и фторида натрия.
Нарушение метаболизма сердечной мышцы при ишемической болезни сердца. Для ишемизированного миокарда характерны сниженное окислительное фосфорилирование и повышенный анаэробный обмен. Раннее увеличение гликогенолиза и гликолиза за счет имеющегося в сердечной мышце гликогена и глюкозы, усиленно поглощаемой миокардом в начальной стадии ишемии, происходит в результате повышения внутриклеточной концентрации катехоламинов и цАМФ, что в свою очередь стимулирует образование активной формы фосфорилазы – фосфорилазыа и активацию фосфофруктокиназы – ключевого фермента гликолиза. Однако даже максимально усиленный анаэробный метаболизм не способен длительно защищать уже поврежденный гипоксический миокард. Очень скоро запасы гликогена истощаются, гликолиз замедляется вследствие внутриклеточного ацидоза, который ингибирует фосфофруктокиназу.
Содержание АТФ и креатинфосфата в клетке резко снижается в результате нарушения окислительного фосфорилирования в митохондриях. Одно из первых проявлений этого состояния – нарушение мембранной проницаемости. Нарушение целостности мембран способствует выходу из клетки ионов, в том числе ионов К+, а также ферментов. Дефицит энергетических ресурсов и нарушение ионного состава, существенные изменения различных мембранных «резервуаров», обеспечивающих контроль за уровнем внутриклеточного кальция, обусловливают торможение функциональной активности мышечных клеток и их постепенную гибель. В этот же период выявляются изменения состава белков миокарда (резкое снижение содержания миофибриллярных белков и накопление белков стромы). Нарушение обмена углеводов, белков и липидов (свободные жирные кислоты не окисляются, а преимущественно включаются в триглицериды) при инфаркте миокарда находит отражение в жировой инфильтрации сердечной мышцы.
Размер повреждения миокарда при возникновении ишемии, снижение активности ферментов в сердечной мышце и возрастание активности соответствующих ферментов в сыворотке крови (например, креатинкиназы) в значительной мере коррелируют друг с другом. Следует признать, что в диагностике инфаркта миокарда определение активности креатинкиназы, АсАТ и ЛДГ в сыворотке крови – наиболее чувствительные тесты. Повышение активности указанных ферментов, особенно креатинкиназы, является постоянным и наиболее высоким. Важно также исследование в сыворотке крови изоферментных спектров креатинкиназы (повышение активности изофермента MB) и ЛДГ (увеличение активности изоферментов ЛДГ1 и ЛДГ2). В последние годы четко показано, что определение в сыворотке крови миокардиально специфичных белков (миоглобин, тропонин Т и др.) – весьма чувствительный ранний тест повреждения миокарда.
25.Биохимические механизмы мышечного сокращения и расслабления. Креатинурия
биохимический цикл мышечного сокращения состоит из 5 стадий (рис. 20.8):
1) миозиновая «головка» может гидролизовать АТФ до АДФ и Н3РО4 (Pi), но не обеспечивает освобождения продуктов гидролиза. Поэтому данный процесс носит скорее стехиометрический, чем каталитический, характер (см. рис. 20.8, а);
2) содержащая АДФ и Н3РО4 миозиновая «головка» может свободно вращаться под большим углом и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90° (см. рис. 22.8, б);
3) это взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из актин-миозинового комплекса. Актомиозиновая связь имеет наименьшую энергию при величине угла 45°, поэтому изменяется угол миозина с осью фибриллы с 90° на 45° (примерно) и происходит продвижение актина (на 10–15 нм) в направлении центра саркомера (см. рис. 20.8, в);
4) новая молекула АТФ связывается с комплексом миозин–F-актин (см. рис. 20.8, г);
5) комплекс миозин–АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой (АТФ) «головки» от F-актина. Последняя стадия и есть собственно расслабление, которое отчетливо зависит от связывания АТФ с актин-миозиновым комплексом (см. рис. 20.8, д). Затем цикл возобновляется.
Регуляция сокращения и расслабления мышц. Сокращение любых мышц происходит по общему механизму, описанному ранее. Мышечные волокна разных органов могут обладать различными молекулярными механизмами регуляции сокращения и расслабления, однако всегда ключевая регулятор-ная роль принадлежит ионам Са2+. Установлено, что миофибриллы обладают способностью взаимодействовать сАТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция . Наибольшая сократительная активность наблюдается при концентрации ионов Са2+ около 10–6–10–5 М. При понижении концентрации до 10–7 М или ниже мышечные волокна теряют способность к укорочению и развитию напряжения в присутствии АТФ.
По современным представлениям, в покоящейся мышце (в миофибрил-лах и межфибриллярном пространстве) концентрация ионов Са2+ поддерживается ниже пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2+-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур.
Связывание ионов Са2+ разветвленной сетью трубочек и цистерн сарко-плазматической сети не является простой адсорбцией. Это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2+-зависимой АТФазой саркоплазматической сети . При этом наблюдается весьма своеобразная картина: скорость выкачивания ионов Са2+ из межфибриллярного пространства стимулируется этими же ионами. В целом такой механизм получил название «кальциевая помпа» по аналогии с хорошо известным в физиологии натриевым насосом.
Возможность пребывания живой мышцы в расслабленном состоянии при наличии в ней достаточно высокойконцентрации АТФ объясняется снижением в результате действия кальциевой помпы концентрации ионовСа2+ в среде, окружающей миофибриллы, ниже того предела, при котором еще возможны проявление АТФазной активности и сократимость акто-миозиновых структур волокна. Быстрое сокращение мышечного волокна при его раздражении от нерва (или электрическим током) является результатом внезапного изменения проницаемости мембран и как следствие выхода из цистерн и трубочек саркоплазматической сети и Т-системы некоторого количества ионов Са2+ в саркоплазму.
Как отмечалось, «чувствительность» актомиозиновой системы к ионам Са2+ (т.е. потеря актомиозиномспособности расщеплять АТФ и сокращаться в присутствии АТФ при снижении концентрации ионов Са2+ до 10–7 М) обусловлена присутствием в контрактильной системе (на нитях F-акти-на) белка тропонина, связанного с тропомиозином. В тропонин-тропомио-зиновом комплексе ионы Са2+ связываются именно с тропонином. В молекуле тропонина при этом происходят конформационные изменения, которые, по-видимому, приводят к сдвигу всего тропонин-тропомиози-нового стержня и деблокировке активных центровактина, способных взаимодействовать с миозином с образованием сократительного комплекса и активной Mg2+-АТФазы.
В продвижении актиновых нитей вдоль миозиновых, по данным Э. Хаксли, важную роль играют временно замыкающиеся между нитями поперечные мостики, которые являются «головками» миозиновых молекул. Итак, чем большее число мостиков прикреплено в данный момент к акти-новым нитям, тем больше сила мышечного сокращения.
Наконец, если возбуждение прекращается, содержание ионов Са2+ в саркоплазме снижается (кальциевая помпа), то циклы прикрепление–освобождение прекращаются, т.е. «головки» миозиновых нитей перестают прикрепляться к актиновым нитям. В присутствии АТФ мышца расслабляется и ее длина достигает исходной. Если прекращается поступление АТФ (аноксия, отравление дыхательными ядами или смерть), то мышца переходит в состояние окоченения. Почти все поперечные мостики толстых (миозиновых) нитей присоединены при этом к тонким актиновым нитям, следствием чего и является полная неподвижность мышцы.
Креатинурия — повышенное выделение с мочой креатина (см.). Патологическая креатинурия наблюдается при поражениях мышц и состояниях, сопровождающихся повышенным распадом белка: голодании, ожогах, острых лихорадочных заболеваниях, диабете, гипертиреозе. Физиологическая креатинурия может наблюдаться у детей и у женщин в период беременности.
Креатинурия — выделение креатина с мочой; патологическая креатинурия наблюдается при прогрессирующей мышечной дистрофии, миастении, миозите, гипертиреозе, акромегалии, Аддисоновой болезни, сахарном диабете, кишечной непроходимости, тяжелой сердечно-сосудистой недостаточности, истощении, авитаминозе Е и С, глюкокортикоидами.
26.Особенности химического состава и обмена веществ костной ткани.
химического состава костной ткани сопряжено со значительными трудностями, поскольку для выделения органического матрикса требуется провести деминерализацию кости. Кроме того, содержание и состав органического матрикса подвержены значительным изменениям в зависимости от степениминерализации костной ткани.
Известно, что при продолжительной обработке кости в разведенных растворах кислот ее минеральные компоненты растворяются и остается гибкий мягкий органический остаток (органический матрикс), сохраняющий форму интактной кости. Межклеточный органический матрикс компактной кости составляет около 20%, неорганические вещества – 70% и вода – 10%. В губчатой кости преобладают органические компоненты, которые составляют более 50%, на долю неорганических соединений приходится 33–40%. Количество воды сохраняется в тех же пределах, что и в компактной кости (Ю.С. Касавина, В.П. Торбенко).
По данным А. Уайта и соавт., неорганические компоненты составляют около 1/4 объема кости; остальную часть занимает органический матрикс. Вследствие различий в относительной удельной массе органических и неорганических компонентов на долю нерастворимых минералов приходится половина массы кости.
Неорганический состав костной ткани. Более 100 лет назад было высказано предположение, что кристаллыкостной ткани имеют структуру апатита. В дальнейшем это в значительной мере подтвердилось. Действительно, кристаллы кости относятся к гидроксилапатитам, имеют форму пластин или палочек и следующий химический состав – Са10(РО4)6(ОН)2. Кристаллы гидроксилапатита составляют лишь часть минеральной фазы костной ткани, другая часть представлена аморфным фосфатом кальция Са3(РО4)2. Содержание аморфного фосфата кальция подвержено значительным колебаниям в зависимости от возраста. Аморфный фосфат кальция преобладает в раннем возрасте, в зрелой кости преобладающим становится кристаллический гидроксилапатит. Обычно аморфный фосфат кальция рассматривают как лабильный резервионов Са2+ и фосфата.
В организме взрослого человека содержится более 1 кг кальция, который почти целиком находится в костях и зубах, образуя вместе с фосфатом нерастворимый гидроксилапатит. Большая часть кальция в костях постоянно обновляется. Ежедневно кости скелета теряют и вновь восстанавливают примерно 700–800 мгкальция.
В состав минеральной фазы кости входит значительное количество ионов, которые обычно не содержатся в чистом гидроксилапатите, например ионы натрия, магния, калия, хлора и др. Высказано предположение, что в кристаллической решетке гидроксилапатита ионы Са2+ могут замещаться другими двухвалентнымикатионами, тогда как анионы, отличные от фосфата и гидроксила, либо адсорбируются на поверхностикристаллов, либо растворяются в гидратной оболочке кристаллической решетки.
Органический матрикс костной ткани. Приблизительно 95% органического матрикса приходится наколлаген. Вместе с минеральными компонентами коллаген является главным фактором, определяющиммеханические свойства кости. Коллагеновые фибриллы костного матрикса образованы коллагеном типа 1. Известно, что данный тип коллагена входит также в состав сухожилий и кожи, однако коллаген костной тканиобладает некоторыми особенностями. Есть данные, что в коллагене костной ткани несколько большеоксипролина, чем в коллагене сухожилий и кожи. Для костного коллагена характерно большое содержание свободных ε-амино-групп лизиновых и оксилизиновых остатков. Еще одна особенность костного коллагена – повышенное по сравнению с коллагеном других тканей содержание фосфата. Большая часть этого фосфатасвязана с остатками серина.
В сухом деминерализованном костном матриксе содержится около 17% неколлагеновых белков, среди которых находятся и белковые компоненты протеогликанов. В целом количество протеогликанов в сформировавшейся плотной кости невелико.
В состав органического матрикса костной ткани входят гликозамино-гликаны, основным представителем которых является хондроитин-4-суль-фат. Хондроитин-6-сульфат, кератансульфат и гиалуроновая кислотасодержатся в небольших количествах.
Принято считать, что гликозаминогликаны имеют непосредственное отношение к оссификации . Показано, что окостенение сопровождается изменением гликозаминогликанов: сульфатированные соединения уступают место несульфатированным. Костный матрикс содержит липиды, которые представляют собой непосредственный компонент костной ткани, а не являются примесью в результате недостаточно полного удаления богатого липидами костного мозга. Липиды принимают участие в процессе минерализации. Естьоснования полагать, что липиды могут играть существенную роль в образовании ядер кристаллизации приминерализации кости.
Биохимические и цитохимические исследования показали, что остеобласты – основные клетки костной ткани – богаты РНК . Высокое содержание РНК в костных клетках отражает их активность и постоянную биосинтетическую функцию (табл. 22.1).
Своеобразной особенностью костного матрикса является высокая концентрация цитрата: около 90% его общего количества в организме приходится на долю костной ткани. Принято считать, что цитрат необходим для минерализации костной ткани. Вероятно, цитрат образует комплексные соединения с солями кальция ифосфора, обеспечивая возможность повышения концентрации их в ткани до такого уровня, при котором могут начаться кристаллизация и минерализация.
Кроме цитрата, в костной ткани обнаружены сукцинат, фумарат, малат, лактат и другие органическиекислоты.
27.Химический состав нервной ткани. Физиологически активные пептиды и медиаторы мозга. Нарушение обмена биогенных аминов при психических заболеваниях. Химический состав и биологические функции спинномозговой жидкости (ликвор). Возрастные изменения состава ликвора. Изменения свойств и химического состава ликвора при патологии.
3. Особенности химического состава и метаболизма нервной ткани Специфику нервной ткани определяет гематоэнцефалический барьер (ГЭБ). Гематоэнцефалический барьер имеет избирательную проницаемость для различных метаболитов, а также способствует накоплению некоторых веществ в нервной ткани. Например, в нервной ткани на долю глутамата и аспартата приходится примерно 70-75 % от общего количества аминокислот. Таким образом, внутренняя среда нервной ткани намного отличается по химическому составу от других тканей. 4. Липиды нервной ткани Функции липидов нервной ткани следующие. 1. Структурная: входят в состав клеточных мембран нейронов. 2. Функция диэлектриков (обеспечивают надежную электрическую изоляцию). 3. Защитная. Ганглиозиды являются очень активными антиоксидантами - ингибиторами перекисного окисления липидов (ПОЛ). При повреждении ткани мозга ганглиозиды способствуют ее заживлению. 4. Регуляторная. Фосфатидилинозиты являются предшественниками биологически активных веществ. Большая часть липидов нервной ткани находится в составе плазматических и субклеточных мембран нейронов и в миелиновых оболочках. В нервной ткани по сравнению с другими тканями организма содержание липидов очень высокое. Особенность липидного состава нервной ткани: есть фосфолипиды (ФЛ), гликолипиды (ГЛ) и холестерин (ХС), нет нейтральных жиров. Эфиры холестерина можно встретить только в участках активной миелинизации. Сам холестерин синтезируется интенсивно только в развивающемся мозге. В мозге взрослого человека низка активность ОМГ-КоА-редуктазы - ключевого фермента синтеза холестерина. Содержание свободных жирных кислот в мозге очень низкое. Некоторые нейромедиаторы после взаимодействия со специфическими рецепторами изменяют свою конформацию и изменяют конформацию фермента фосфолипазы С, которая катализирует расщепление связи в фосфатидилинозите между глицерином и остатком фосфата, в результате чего образуется фосфоинозитол и диацилглицерин. Эти вещества являются регуляторами внутриклеточного метаболизма. Диацилглицерин активирует протеинкиназу С, а фосфоинозитол вызывает повышение концентрации Са2+. Ионы кальция влияют на активность внутриклеточных ферментов и участвуют в работе сократительных элементов нервных клеток: микрофиламентов, что обеспечивает передвижение различных веществ в теле нервной клетки, аксоне и растущем кончике аксона. Протеинкиназа С участвует в реакциях фосфорилирования белков внутри нервных клеток. Если это белки-ферменты, то меняется их активность, если это рибосомальные или ядерные белки, то изменяется скорость биосинтеза белков. Липиды постоянно обновляются. Скорость их обновления различна, но в целом низка. Некоторые липиды(например: холестерин, цереброзиды, фосфатидилэтаноламины, сфингомиелины) обмениваются медленно - в течение месяцев и даже лет. Исключение составляют фосфатидилхолин и, особенно, фосфатидилинозиты (содержат глицерин, фосфат, спирт (инозит), жирные кислоты) - они обмениваются очень быстро (сутки, недели). Синтез цереброзидов и ганглиозидов протекает с большой скоростью в развивающемся мозге в период миелинизации. У взрослых почти все цереброзиды (до 90 %) находятся в миелиновых оболочках, а ганглиозиды - в нейронах. Нуклеиновые кислоты. Нервные клетки не делятся, значит, не происходит синтез ДНК. Однако, содержание РНК в них самое высокое по сравнению с клетками остальных тканей организма. Скорость синтеза РНК тоже очень велика. В клетках нервной ткани не могут синтезироваться пиримидины (в нервной ткани отсутствует фермент карбамоилфосфатсинтаза). Пиримидины обязательно должны поступать из крови - гематоэнцефалический барьер для них проницаем. Гематоэнцефалический барьер легко проницаем и для пуриновых мононуклеотидов, но, в отличие от пиримидиновых, они могут синтезироваться в нервной ткани. В нервной ткани, так же, как и в других, нуклеиновые кислоты обеспечивают хранение и передачу генетической информации и ее реализацию при синтезе клеточных белков. Например, сильные раздражители: громкие звуки, сильные зрительные стимулы и эмоции приводят к повышению скорости синтеза и РНК, и белка в определенных участках мозга. Это указывает на то, что изменения в нервной системе, отражающие индивидуальный опыт организма, кодируются в виде синтезированных макромолекул. Информация, благодаря которой нейроны устанавливают только определенные связи с определенными нейронами, кодируется в структуре полисахаридных веточек мембранных гликопротеинов. Образование таких связей, не заложенных в период эмбрионального развития, является результатом опыта индивидуального организма и составляет материальную основу для хранения информации, определяющей особенности поведения данного организма. птидные медиаторы — вещества, состоящие из цепочек аминокислот. Первым из них было открыто вещество Р (от powder — порошок), выделенное из сухого порошка спинного мозга. Этот пептид состоит из 11 аминокислот (рис. 3.39). Его введение в кровь в очень малых дозах вызывает расширение кровеносных сосудов и спазм кишечника (рецепторы находятся на гладких мышечных клетках).
Вещество Р вырабатывается нейронами спинномозговых ганглиев, связанными с восприятием болевой чувствительности. Пептид обнаруживается как в пресинаптических окончаниях их аксонов (задние рога спинного мозга), так и в чувствительных нервных окончаниях кожи
Рефлективность нервной системы
НС организует бионт индивида в единое целое, согласовывает и координирует функции всех органов и совокупностей, поддерживает статичность внутренней системы человека (гомеостаз), утверждает взаимосвязи человеческого организма с внешней обстановкой.
Для НС свойственны точная координированность нервные всплески, крупная стремительность передачи информации, быстрая адаптируемость к изменяющимся требованиям внешней обстановки. У субъекта нервная структура формирует базу психической деятельности, оценки и обобщения идущей в систему данных (понимания, слов, непростых форм социального образа действия).
Эти очень сложные и жизненно важные задания решаются с помощью нервных клеток, производящих роль апперцепции, трансляции, исправления и содержания сведений. Сообщения (электрические всплески) от отделов и эпителиальных тканей человека и из внешней обстановки, работающей на эпителий человека и органы чувств, поступают по вазомоторам в спинной и головной мозг. В ЦНС индивида происходят непростые процедуры обработки сведений. После этого из мозга также по фибрам к отделам и эпителиальным тканям идут встречные сигналы, вызывающие отзыв человеческого организма, которая вырисовывается в виде мышечной или выделительной активности. Отвечая на пришедшие из центральной нервной системы всплески проявляется сжатие структурных мышц или мускулатуры в стенках внутренних органов, артерий, а также секреция различных органов, производящим биологически активные вещества - слюновыделительных, пищеварительных, двенадцатиперстных, выделительных и других (выделение слюны, гастрического вместимого, желчи, адреналина выделительными железами).
Из центральной нервной системы к функционирующим отделам (экстензорам, железам) электрические стимулы тоже следуют по звеньям единиц нервной системы. Ответную реакцию системы органов на воздействия внешней обстановки или модулирования его внутреннего состояния, осуществляемую с участием нервной системы, называют ответом (от лат. tratum - изображение, встречная реакция). Маршрут, состоящий из звеньев нейронов, по какому нервный импульс передвигается от восприимчивых нервных клеток до функционирующего места, зовут рефлективной аркой. У любой рефлективной дуги можно указать на первый нервный узел - осязательный, либо дающий, каковой получает воздействия, организует нервный всплеск и приносит его в центральную нервную систему. Дальнейшие нервные клетки (одиночный или пара) есть вводимыми, соединительными единицами нервной системы, рассосредоточенными в головном мозге. Добавочные нервные клетки проводят электрические импульсы от приносящего, восприимчивого нейроцита к финальному, уносящему, передающему нервному звену. Заключительный нейрон относит нервный всплеск из мозга человека к действующему органу (экстензору, железе), вводит данный объект в работу, формирует впечатление, поэтому называется также эффекторным невроном.
Спинномозгова́я жидкость, цереброспина́льная жидкость (лат. liquor cerebrospinalis), ли́квор — жидкость, постоянно циркулирующая в желудочках головного мозга, ликворопроводящих путях, субарахноидальном (подпаутинном) пространстве головного и спинного мозга.
[править]Функции
Предохраняет головной и спинной мозг от механических воздействий, обеспечивает поддержание постоянного внутричерепного давления и водно-электролитного гомеостаза. Поддерживает трофические и обменные процессы между кровью и мозгом, выделение продуктов его метаболизма. Флуктуация ликвора оказывает влияние на вегетативную нервную систему.
до 14 дня |
0,5-3 месяца |
4-6 месяц |
0,5 - 60 лет |
|
|
Вид |
часто ксан-тохромная, прозрачная |
бесцветная, прозрачная |
бесцветная, прозрачная |
бесцветная, прозрачная |
|
Общее число клеток в 1мкл: в среднем, максимально |
3,3 7,0 |
2,5 5,0 |
1,3 3,3 |
1,0 2,7 |
|
Общий белок, г/л |
0,4 - 0,8 |
0,2 - 0,5 |
0,18 - 0,36 |
0,22 - 0,33 |
|
Альбумин, г/л |
0,26 - 0,56 |
0,14 - 0,38 |
0,12 - 0,30 |
0,12 - 0,20 |
|
Глобулин, г/л |
0,14 - 0,30 |
0,04 - 0,18 |
0,02 - 0,10 |
0,02 - 0,06 |
|
Глоб./Альбум. |
0,4 - 0,6 |
0,2 - 0,55 |
0,15 - 0,4 |
0,15 - 0,3 |
|
Глюкоза, ммоль/л |
1,6 - 3,9 |
2,2 - 3,9 |
2,2 - 4,4 |
2,2 - 4,4 |
|
Глюк.ликвора/глюкоза крови |
|
|
|
0,54 - 0,56 |
|
Помутнение ликвора наблюдается при существенном увеличении количества клеточных элементов (эритроцитов, лейкоцитов), бактерий и грибов, повышении содержания общего белка. Помутнение, вызванное клетками и грибами, уменьшается или исчезает после центрифугирования. Помутнение, связанное с бактериями, после центрифугирования не исчезает.
осмолярность
Относительная плотность ликвора (удельный вес) люмбального ликвора составляет 1,005 - 1,009 г/мл, соответственно осмоляльность 200 - 350 ммоль/кг, с
Повышение осмоляльности (относительной плотности) наблюдается при менингитах, уремии, сахарном диабете и др.
Осмоляльность ликвора определяется с помощью диагностических полосок «Уриосм».
КСАНТОХРОМИЯ (ГЕМОГЛОБИН И БИЛИРУБИН )
Механизмы возникновения.
Ксантохромия - желтая или желто-коричневая окраска ликвора. Такой цвет обусловлен присутствием оксигемоглобина, метгемоглобина и билирубина. Все три пигмента являются производными гемоглобина эритроцитов.
Красный гемоглобин, освободившись из лизированных эритроцитов, разбавляется ликвором и придает ему оранжевую окраску. Желтый билирубин образуется из гемоглобина. Ответственен за это превращение фермент гемоксидаза, находящийся в клетках сосудистого сплетения мозга, паутинной оболочки и коры головного мозга. Под влиянием этого фермента глобин отделяется от гема и гем превращается в билирубин. Активность гемоксидазы при патологии как правило увеличивается. Это является причиной активного появления билирубина в ликворе сразу за гемоглобином.
Метгемоглобин и метальбумин придают ликвору окраску от коричневой до темно-желтой. Эти продукты редукции появляются в ликворе при наличии инкапсулированных гематом и геморрагии.
При окислении билирубина в биливердин наблюдается зеленая окраска ликвора.
Возможна ложная ксантохромия при наличии в ликворе липохромов и пенициллина (макроскопически желтая окраска ликвора и отрицательная реакция на билирубин).
Зеленую окраску ликвора и резкое помутнение вызывает примесь гноя при гнойном менингите, прорыве абсцесса мозга в субарахноидальное пространство или желудочки.
Клинические аспекты.
Физиологическая ксантохромия наблюдается у новорожденных из-за несостоятельности гематоэнцефалического барьера; исчезает в конце 1 недели и обусловлена проникновением билирубина плазмы крови в ликвор. У недоношенных ксантохромия выражена больше, исчезает в конце 1 месяца жизни. У новорожденных с гемолитической анемией - массивная ксантохромия.
Застойная ксантохромия появляется в результате застоя крови в сосудах мозга и нарушения проницаемости их стенок. В этих условиях билирубин плазмы и в меньшей степени оксигемоглобин проникают в ликвор, окрашивая его в желтый цвет. Эта ксантохромия сопровождается значительным увеличением содержания белка в ликворе. Застойная ксантохромия наблюдается при опухолях центральной нервной системы и зависит от гистологии опухоли (все сосудистые опухоли сопровождаются ксантохромией), при блокаде субарахноидальных пространств, компрессии, туберкулезном менингите, арахноидитах.
Геморрагическая ксантохромия развивается при попадании крови в ликворное пространство, при этом до появления ксантохромии должно пройти определенное время. Вначале возникает оранжевая ксантохромия, вызванная гемоглобином, которая развивается после разрушения эритроцитов и наступает через 2 час в 70 % случаев, через 6 час в 90 %, через 12 час в 100 % случаев. Полностью исчезает она через 4-8 дней. Желтая ксантохромия появляется через 2-4 дня, исчезает через 12-40 дней, в среднем продолжается 22 дня. Геморрагическая ксантохромия характерна при травмах центральной нервной системы, геморрагических инсультах, субарахноидальных кровоизлияниях. Наличие ксантохромии при содержании белка в ликворе ниже 1,5 г/л и при отсутствии желтухи является показателем предшествующего кровоизлияния в головной или спинной мозг.
ЭРИТРОАРХИЯ (ЭРИТРОЦИТЫ)
Эритроархия (кровавый ликвор). Различают "путевую" эритроархию, вызванную попаданием в ликвор крови из травмированных во время пункции кровеносных сосудов, и истинную эритроархию, возникающую вследствие кровоизлияния в ликворные пространства при разрыве кровеносного сосуда во время геморрагического инсульта, опухоли мозга, черепно-мозговой травмы и др. При содержании эритроцитов менее 0,1-0,15 х 109/л ликвор не имеет окраски. Большее количество эритроцитов придает ликвору сероватый, розовый, розовато-красный, кровянистый, кровавый цвет.
Для оценки эритроархии можно использовать диагностические полоски «Уригем».
ПРОТЕИНАРХИЯ (БЕЛОК)
В нормальном ликворе присутствует белок (протеинархия). Содержание белка в люмбальной ликворе - 0,22-0,33 г/л, желудочковом ликворе 0,12-0,20 г/л, цистернальной ликворе 0,10-0,22 г/л. При этом показатель 0,33 г/л рассматривается как величина, граничащая с патологией, а количество белка 0,22 г/л как гидроцефальный люмбальный ликвор. Качественный состав белка ликвора подобен составу белка сыворотки крови, однако количество белка ликвора существенно меньше из-за гематоэнцефалического барьера. В отличие от белковых фракций сыворотки в ликворе при электрофорезе выявляется фракция преальбумина. В таблице № 13 представлены белковые фракции ликвора.
Основную массу общего ликворного белка составляет альбумин. Возраст почти не влияет на его содержание. Как правило имеется прямая зависимость между общим белком и альбумином, что свидетельствует о большей лабильности альбумина по сравнению с глобулинами.
Ликворный альбумин происходит из альбумина плазмы путем везикулярного транспорта через эндотелиальные клетки, выстилающие сосудистые и ликворные пространства. Альбумин считается важнейшим показателем доказательства нарушений функции гематоэнцефалического барьера. Почти всякое нарушение гематоэнцефалического барьера ведет к увеличению абсолютной концентрации альбумина в ликворе. Соотношение альбумин/глобулин в ликворе регулирует осмотическое давление в центральной нервной системе. Нормальное содержание общего белка в ликворе еще не свидетельствует об отсутствии патологии в ЦНС, на ее органическое поражение указывает изменение соотношений белковых фракций, которое определяется электрофорезом белка ликвора, сконцентрированного диализом (таблица № 13).
Клинические аспекты.
Гипопротеинархия - снижение уровня белка в люмбальном ликворе, ниже 0,22 г/л рассматривается как гидроцефильный ликвор.
Гиперпротеинархия - увеличение уровня белка в ликворе, служит показателем патологического процесса. Повышение белка в спино-мозговой жидкости при разных патологических процессах (воспаление, травма, опухоль) зависят от нарушения гемодинамики в сосудах мозга,
приводящей к увеличению проницаемости их стенок и поступлению белковых молекул плазмы крови в ликвор. Поступление крови в ликворные пространства при разрыве сосудов мозга или продуктов распада опухоли мозга усугубляют степень протеинархии.
\
ГЛИКОАРХИЯ (ГЛЮКОЗА)
В ликворе содержится глюкоза (таблица № 9). В субокципитальном и вентрикулярном ликворе концентрация глюкозы на 12-15 % выше, чем в люмбальном ликворе. Содержание глюкозы в ликворе у новорожденных и недоношенных несколько выше, что обусловлено недостаточностью гематоэнцефалического барьера.
Определение глюкозы в ликворе желательно проводить одновременно с исследованием ее в крови через 4-6 час после приема пищи. При нормальном уровне глюкозы в крови, в люмбальном ликворе концентрация глюкозы составляет примерно 60 % уровня в плазме. При гипергликемии разница между ликвором и кровью возрастает значительно, в ликворе глюкоза достигает только 30 - 35 % уровня плазмы.
Концентрация глюкозы в ликворе является результатом активного транспорта через гематоэнцефалический барьер, утилизации клетками паутинной оболочки, эпендимы, глии, нейронами и выхода в венозную систему. Уровень глюкозы в ликворе является одним из важных индикаторов функции гематоэнцефалического барьера и широко используется для его оценки. Глюкоза является основным субстратом для нейронов. Несмотря на то. что большинство нейронов получают глюкозу из кровотока, тем не менее у части из них, прилегающих к желудочкам мозга, может нарушаться трофика при изменении концентрации глюкозы в ликворе.
