
-Термодинами́ческая фу́нкция состоя́ния — в термодинамике некая функция, зависящая от нескольких независимых параметров, которые однозначно определяют состояние термодинамической системы. Значение термодинамической функции состояния зависит только от состояния термодинамической системы и не зависит от того, как система пришла в это состояние.
-функции состояния ( температура, объём, давление)
U, H, F, G, S
1) внутренняя энергия U(S,V),
2) энтальпия H(S,p) = U + pV,
3) энергия Гельмгольца F(T,V) = U - TS,
4) энергия Гиббса G(T,p) = H - TS = F + pV.
(Энтропия S)
- Потенциал Гиббса G
![]()
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность химической реакции
Уравнения связи
![]() ,
,
![]() ,
,
![]() .
.
![]()
![]()
![]()
![]()
3. ??? dU < 0 самопроизвольность
4. ??? dH < 0 самопроизвольность
5. З.Гесса: если данную систему можно различными путями (способами) превращать в другую, то суммарные тепловые эффекты по каждому пути равны между собой при условии, что по любому пути система переходит из одного и того же начального в одно и то же конечное состояние.
(Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции).
6.
Хими́ческий потенциа́л μ — один из
термодинамических параметров системы,
а именно энергия добавления одной
частицы в систему без совершения работы.
![]()
7. T1+T2=T,
8.уравнение клапейрона-клаузиуса
![]()
9. Электроотрицаемость характеризует стремление данного атома к присоединению электронов при образовании химической связи. Однако следует знать, пользуясь электроотрицательностью как величиной, характеризующей способность атома к притяжению валентных электронов, что элементу, строго говоря, нельзя приписать постоянную электроотрицательность. Ее величинаи зависит от того, в составе какого конкретного соединения рассматривается атом (т.е. в окружении атомов каких элементов он находится).
10. уравнение Борна для ионной связи

11.

равновесное состояние (при r=r0)
12.- возможные типы взаимодействия молекул друг с другом
1. Молекулы имеют нескомпенсированный заряд (ионы)
2. Одна молекула имеет нескомпенсированный заряд, а вторая –
постоянный дипольный момент.
3. Молекулы валентно насыщенные (не имеющие заряда) взаимодействуют друг с другом (взаимодействия Ван-дер-Ваальса)
- Дисперсное взаимодействие (эффект Лондона)
Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на миг могут оказаться окажется сосредоточенными с одной стороны молекулы, то есть неполярная частица станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, и между ними устанавливаются кратковременные связи:
Ориентационные и индукционные взаимодействия можно понять на основе электростатики. Дисперсионное взаимодействие можно объяснить только на основе квантовой механики.
Согласно квантовомеханическим представлениям осциллятор даже при температуре абсолютного нуля совершает колебания с нулевой энергией
При сближении двух осцилляторов происходит нечто подобное соединению двух маятников упругой нитью:
из
двух колебаний осцилляторов с частотами
![]() возникает
два колебания, близких к ним с частотами
возникает
два колебания, близких к ним с частотами
![]() и
и
![]() .
.
13. Ориентационное взаимодействие (эффект Кеезома )
Возможны два случая



Пусть
R >>l
e - заряд диполя
Энергию ориентационного взаимодействия можно представить как сумму кулоновского притяжения и отталкивания зарядов полюсов диполей:

![]()

Для
случая Б

--- Индукционное взаимодействие (эффект Дебая )
Молекула, обладающая
постоянным дипольным моментом
![]() ,
создаёт электрическое поле, которое
поляризует молекулу с электрическими
зарядами, равномерно распределёнными
по объёму.
,
создаёт электрическое поле, которое
поляризует молекулу с электрическими
зарядами, равномерно распределёнными
по объёму.
Положительные заряды смещаются по направлению электрического поля, а отрицательные — против.
В результате у
неполярной молекулы индуцируется
дипольный момент
![]() .
.
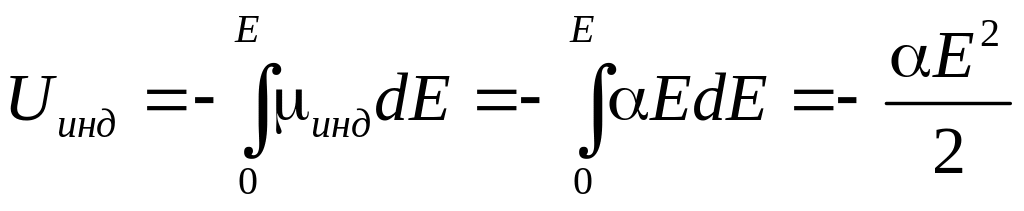
14. Высокие теплоты испарения не могут быть объяснены лишь Ван-дер-Ваальсовым взаимодействием, энергия которого на порядок меньше
(теплота ~40 кДж/моль, В-д-В ~1-5 кДж/моль).
В ассоциированных жидкостях помимо универсального Ван-дер-Ваальсового взаимодействия между молекулами существуют еще специфическое взаимодействие, называемое водородной связью (Н-связь).
Для образования Н-связи необходимо:
Наличие атома водорода (или его изотопов)
Элемент А должен обладать высокой электроотрицательностью (F, O, Cl, N)
Элемент В должен иметь неподеленную пару электронов (F, O, Cl, N)
Определенная геометрия взаимодействия
15. Энергия водородной связи: 8 ÷ 100 кДж/моль
![]()
Энергия ковалентной связи 100 ÷ 1000 кДж/моль. , около 100 пм
Для
межмолекулярного
![]()
![]()
16. Дисперсионное взаимодействие существенно для всех без исключения молекул.
дисперсное взаимодействие является аддитивным
Если имеем 3 частицы, то общая энергия их взаимодействия
![]()
Эти взаимодействия позволяют объяснить возможность существования конденсированных фаз (жидкой и твердой) для совершенно неполярных атомов и молекул, например для гелия.
Uпр = Uop + Uинд + Uдисп ~ r-6
Ориентационная энергия значительна только для сильно полярных молекул,
индукционная энергия обычно очень мала, и наиболее важным слагаемым является дисперсионная энергия.
(Жидкости и твердые тела практически не сжимаемы, силы отталкивания очень быстро возрастают при уменьшении межмолекулярного расстояния.)
Энергию отталкивания аппроксимируют выражением

где B и n – константы, определяемые при исследовании столкновений атомов инертных газов и простейших молекул.
(Рассчитать с достаточной точностью U(r) на основе квантовой механики при огромном разнообразии пар взаимодействующих молекул практически нельзя. Не удаётся пока и экспериментально измерить силу взаимодействия на межмолекулярных расстояниях).
обычно подбирают такую формулу для U(r), чтобы проделанные с её помощью расчёты хорошо бы согласовались с экспериментом.
Наиболее часто используют эмпирическое уравнение межмолекулярного взаимодействия при постоянной температуре
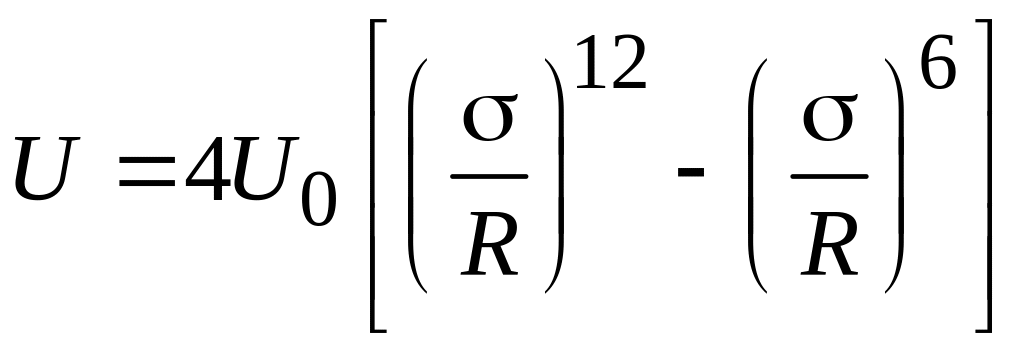
потенциал Леннарда-Джонса ("потенциал 6-12")
где σ - равна значению R, при котором U=0
![]() -
максимальное значение энергии притяжения
(глубина потенциальной ямы)
-
максимальное значение энергии притяжения
(глубина потенциальной ямы)

17. Жидкое состояние вещества является промежуточным между твердым и газообразным
жидкость принимает форму сосуда
молекулы жидкости и газа совершают хаотические перемещения, сталкиваясь друг с другом.
Различия между газообразным и жидким состоянием вещества:
расстояние между молекулами в газовой фазе обычно (для невысоких давлений) много больше размера молекулы, в то время как для жидкого состояния - они сопоставимы.
средняя кинетическая энергия частиц в газовой фазе много больше энергии их межмолекулярного взаимодействия, в жидкой - потенциальная энергия взаимодействия молекул больше средней кинетической энергии их движения
C другой стороны, жидкое состояние по ряду показателей близко к твердому:
межмолекулярные расстояния в жидкости близки к таковым в твердом теле, так как при плавлении последнего объем вещества изменяется незначительно (обычно он увеличивается не более чем на 10%).
энергия межмолекулярного взаимодействия в жидкости и в твердом теле отличается незначительно (теплота плавления много меньше теплоты испарения. Например, для воды Hпл= 6 кДж/моль, а Hисп= 45 кДж/моль; для бензола Hпл= 11 кДж/моль, а Hисп = 48 кДж/моль).
теплоемкость вещества при плавлении меняется очень слабо, т.е. она близка для этих обоих состояний (характер движения частиц в жидкости близок к таковому в твердом теле)
Различие между жидкостью и твердым телом:
твердое тело сохраняет свою форму, жидкость даже под влиянием небольшого усилия легко ее меняет.
18. Физический смысл функции радиального распределения W(R) - функция представляет собой относительную вероятность нахождения частиц на расстоянии R от фиксированной частицы.

Для жидкости
непрерывный вид функции с экстремумами в виде затухающих колебаний.
частицы могут находиться на любом расстоянии от выбранной для R > 2r, но, чаще всего, на некотором определенном, соответствующем максимуму на кривой W(R).
19) Жи́дкость — одно из агрегатных состояний вещества. Основным свойством жидкости, отличающим её от других агрегатных состояний, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём.
Жидкое состояние обычно считают промежуточным между твёрдым телом и газом: газ не сохраняет ни объём, ни форму, а твёрдое тело сохраняет и то, и другое.
Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Так, вода может собираться в капли. Но жидкость способна течь даже под своей неподвижной поверхностью, и это тоже означает несохранение формы (внутренних частей жидкого тела).
Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии.
Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твердое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше — в газообразное (происходит испарение). Границы этого интервала зависят от давления.
Как правило, вещество в жидком состоянии имеет только одну модификацию. (Наиболее важные исключения — это квантовые жидкости и жидкие кристаллы.) Поэтому в большинстве случаев жидкость является не только агрегатным состоянием, но итермодинамической фазой (жидкая фаза).
Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь,морская вода и др. Жидкости могут выполнять функцию растворителей.
В технической гидромеханике под жидкостью понимают физическое тело, обладающее: а) в отличие от твёрдого тела текучестью; и б) в отличие от газа весьма малой изменяемостью своего объёма. Иногда жидкостью в широком смысле этого слова называют и газ; при этом жидкость в узком смысле слова, удовлетворяющую условиям а) и б) называют капельной жидкостью.
Жидкая частица — это часть жидкости, малая по сравнению с объёмом рассматриваемой жидкости, и в то же время содержащая макроскопически большое количество молекул жидкости.
20. Лёд - молекулярный кристалл (в узлах кристаллической решетки находятся молекулы)
Во льду все молекулы связаны между собой водородными связями.
21.--- Жидкие кристаллы
Вещества способные сочетать одновременно свойства жидкостей (текучесть) и свойства кристаллических тел (анизотропия) называются жидкими кристаллами или жидкокристаллическими.
Характерной особенностью всех ЖК-соединений является асимметричная форма молекул
стержнеобразной формы - каламитики (от греч. "каламис" — тростник
дискообразной формы – дискотики
планкообразной формы - санидики (от греч. "санидис" — планка).
---Лиотропные жидкие кристаллы
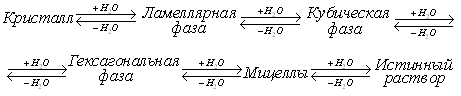
22. Термотропные
три основных типа:
нематики
смектики
холестерики
Нематики (от греч. "нема" — нить) характеризуется наличием одномерного ориентационного порядка длинных или коротких осей молекул.
При этом центры тяжести молекул расположены в пространстве хаотично, что свидетельствует об отсутствии трансляционного порядка. Смектики – (от греч. слова "смегма" – мыло). Молекулы располагаются в слоях, и их центры тяжести подвижны в смектической плоскости. При этом длинные оси молекул в каждом слое могут располагаться как перпендикулярно плоскости слоя, так и под некоторым углом.
Холестерики
(образуются хиральными (оптически активными) молекулами)
Иногда холестерик называют закрученным нематиком.
Соседние молекулярные слои в холестерическом жидком кристалле немного повернуты друг относительно друга, благодаря чему стопка подобных слоев описывает в пространстве спираль.
23) При переменных давлении и температуре правило фаз сводится к выражению:
![]()
24) В случае однокомпонентной системы оно упрощается до:
![]() ,
,
Отсюда видно, например, что в однокомпонентной системе три фазы (j=3) могут сосуществовать при числе степеней свободы v, равном нулю, то есть при фиксированных давлении и температуре, что соответствует тройной точке на фазовой диаграмме. Две фазы (j=2) сосуществуют при произвольном измененнии либо давления, либо температуры, когда вторая из этих переменных не является независимой (v=1), то есть двухфазному равновесию на фазовой диаграмме соответствует линия. Если фаза одна (j=1), число степеней свободы системы равно двум, то есть температура и давление могут менятся независимо в пределах некоторой области на фазовой диаграмме — пока система не окажется на одной из линий двухфазного равновесия.
25. Тройная точка в термодинамике, точка на диаграмме состояния, соответствующая равновесному сосуществованию трёх фаз в-ва. Из Гиббса правила фаз следует, что химически индивидуальное в-во (однокомпонентная система) в равновесии не может иметь больше трёх фаз. Эти три фазы (напр., твёрдая, жидкая и газообразная или, как у серы, жидкая и две аллотропные разновидности кристаллической) могут совместно сосуществовать только при значениях темп-ры Тт и давления рт, определяющих на диаграмме р — Т координаты Т.
26.

Система состоит из одного вещества – воды, т.е. C = 1.
Вода может существовать в трех фазах: твердой, жидкой и газообразной.
Число фаз, которые могут сосуществовать в состоянии равновесия, зависит от давления (P) и температуры (T).
Линия АВ представляет собой кривую кипения.
Кривая АС - кривая сублимации (равновесие «твердое тело-пар»).
Линия AD - кривая плавления (равновесие «твердое тело-жидкость»).
27. В - критическая точка, При температурах выше критической различие между жидкостью и паром исчезает.
28)
Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Скорость химической реакции изменяется во времени по мере взаимодействия исходных веществ.
Истинная
скорость реакции
![]() в данный момент времени
в данный момент времени

Зависимость концентрации реагентов от времени - кинетика реакции
Кривые зависимостей концентрации реагентов от времени - кинетические кривые
Математические уравнения, которые описывают кинетические кривые, - уравнения кинетики.
Рассмотрим химическую реакцию
![]()
Кинетические кривые для исходных веществ (А) и продуктов реакции (В)

Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой.
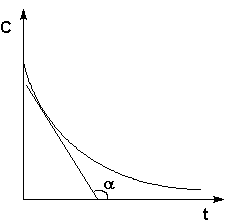
Истинная скорость реакции в данный момент времени равна по абсолютной величине тангенсу угла наклона касательной:
![]()
