
- •Контролируемая самостоятельная работа
- •Содержание
- •Структура простых веществ в подгруппе, периоде
- •2. Закономерности изменения химических свойств веществ по группе, периоду.
- •3. Структура и физические свойства кадмия.
- •4. Взаимодействие кадмия с простыми окислителями. Кадмий взаимодействует с кислородом при горении:
- •5. Взаимодействие кадмия со сложными окислителями.
- •6. Двухэлементные соединения кадмия.
- •7. Трехэлементные соединения кадмия. Цианид кадмия,Cd(cn)2, получают в виде белого осадка обработкой растворов солей кадмия стехиометрически необходимым количеством цианида щелочного металла:
- •8. Комплексные соединения кадмия.
- •9. Список использованной литературы.
- •Дж. Эмсли. Элементы. М.: 1990.
Федеральное агентство по образованию
Уфимский государственный авиационный технический университет
Кафедра химии
Контролируемая самостоятельная работа
по теме:
«Химия металлов»
Выполнил:
Проверил:
Уфа-2007
Содержание
Структура простых веществ в подгруппе, периоде 3
Закономерности изменения химических свойств веществ по группе, периоду 3
Структура и физические свойства кадмия 4
Взаимодействие кадмия с простыми окислителями 7
Взаимодействие кадмия со сложными окислителями 7
Двухэлементные соединения кадмия 7
Трехэлементные соединения кадмия 9
Комплексные соединения кадмия 9
Список использованной литературы 10
Схема «Свойство — порядковый номер элемента»
Зависимость
физических свойств по периоду и
подгруппе, к которым относится кадмий


Закономерности
изменения химических свойств веществ
по группе, периодуСтруктура простых веществ в подгруппе, периоде



Структура
и физические свойства кадмия Взаимодействие
кадмия с простыми окислителями



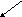
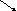
Двухэлементные
соединения кадмия Взаимодействие
кадмия со сложными окислителями




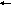
Трехэлементные
соединения кадмия
Нестехиометрические
соединения элемента

Комплексные
соединения элемента

1. Структура простых веществ в подгруппе, периоде.
Все элементы подгруппы кадмия — металлы. Структура простых веществ в подгруппе отличается только добавлением дополнительного электронного слоя от цинка к ртути. Электронная конфигурация цинка – 3d104s2, кадмия – 4d105s2, ртути – 5d106s2. В периоде кадмия всеs-элементы,p-элементы до теллура и всеd-элементы — металлы, теллур и следующие элементы — неметаллы. По периоду кадмия у каждого следующего элемента начиная с рубидия на внешний уровень добавляется один электрон согласно правилу Клечковского.
2. Закономерности изменения химических свойств веществ по группе, периоду.
По химической активности кадмий и металлы его подгруппы уступают щелочно-земельным металлам. При этом в противоположность подгруппе кальция в подгруппе кадмия с ростом атомной массы химическая активность металлов понижается. Об этом, в частности, свидетельствуют ΔG˚f дихлоридов и характер изменения их значений в зависимости от порядкого номера элементов. Об этом же свидетельствуют значения электродных потенциалов металлов: цинк и кадмий в электрохимическом ряду напряжений расположены до водорода, ртуть — после. Цинк — химически активный металл, легко растворяется в кислотах и при нагревании в щелочах:
Zn + 2OH3++ 2H2O = H2 + [Zn(OH2)4]2+
Zn + 2H2O + 2OH– = H2 + [Zn(OH2)4]2–
Кадмий в щелочах практически не растворяется, а в кислотах — менее энергично чем цинк; ртуть же растворяется только в кислотах, являющихся достаточно сильными окислителями за счет своих анионов. При этом могут получиться производные как Hg(II), так иHg(I). Например, при действии наHgконцентрированной азотной кислоты получаетсяHg(NO3)2:
Hg + 4HNO3 = Hg(NO3)2 + 2NO2 + 2H2O
При действии на избыток HgразбавленнойHNO3получаетсяHg2(NO3)2:
6Hg + 8HNO3 = 3Hg2(NO3)2 + 2NO + 4H2O
Цинк и кадмий по отношению к HNO3и концентрированнойH2SO4ведут себя значительно активнее. Цинк, например, очень разбавленнуюHNO3 восстанавливает до иона аммония:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
При нагревании кадмий и металлы его подгруппы весьма энергично взаимодействуют с активными неметаллами. Интересно, что ртуть взаимодействует с серой и йодом даже в обычных условиях.
