
- •Триозофосфат-
- •В анаэробных условиях конечным акцептором водорода может быть ацетальдегид.
- •В аэробных условиях пвк окончательно окисляется Цепь реакций аэробного распада глюкозы можно расчленить на 3 основных этапа:
- •Окислительное декарбоксилирование пирувата
- •Регуляция активности пируватдегидрогеназы.
- •Цикл Кребса – центральный путь обмена веществ.
- •3 Реакция – дегидрирование и прямое декарбоксилирование изолимонной кислоты.
- •4 Реакция – окислительное декарбоксилирование α-кетоглутаровой кислоты.
- •5 Реакция – субстратное фосфорилирование.
- •6 Реакция – дегидрирование янтарной кислоты сукцинатдегидрогеназой.
- •7 Реакция – образование яблочной кислоты ферментом фумаразой.
- •8 Реакция – образование оксалацетата.
- •Функции цикла трикарбоновых кислот многообразны
- •Скорость реакция цикла Кребса определяется энергетическими потребностями клетки.
Введение. Глюкоза является главным клеточным « топливом» при анаэробном получении энергии. Наиболее важную роль при сбраживании глюкозы играют два пути: молочнокислое и спиртовое брожение.
Анаэробное дыхание – гликолиз.
Цепь реакций гликолиза можно условно разделить на 2 звена: в первом осуществляется осуществляется распад глюкозы на 2 триозы (подготовительная стадия), во втором – окисление триоз в пируват с восстановлением последнего в лактат (стадия гликолитической оксидоредукции).
1-я реакция:
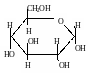

Глюкоза Глюкозо-6-фосфат
Фосфорилирование глюкозы гексокиназой и глюкокиназой (о значении этих ферментов см. выше) – первая регулируемая реакция процесса гликолиза. Образующийся глюкозо-6-фосфат считается аллостерическим ингибитором гексокиназы (но не глюкокиназы).
Так как глюкокиназная реакция является инсулинзависимой, можно вместо глюкозы больным диабетом назначать фруктозу (фруктоза фосфорилируется гексокиназой сразу во фруктозо-6-фосфат).
2-я реакция:

Г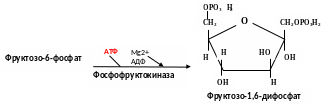 люкозо-6-фосфат
обратимо изомеризуется во фруктозо-6-фосфат
ферментом фосфогексоизомеразой.
люкозо-6-фосфат
обратимо изомеризуется во фруктозо-6-фосфат
ферментом фосфогексоизомеразой.
3-я реакция:
Здесь, как и в первой реакции, происходит значительное падение свободной энергии, поэтому она необратима.
Эта реакция является главной регулируемой реакцией гликолиза. Она катализируется аллостерическим ферментом – фосфофруктокиназой, имеющим сложную четвертичную структуру. Аллостерическими активаторами фосфо-фруктокиназы служат АМФ, АДФ, фруктозо-6-фосфат; аллостерическими ингибиторами – АТФ и цитрат. Следует отметить двоякую роль АТФ – вначале эта молекула используется как субстрат реакции, а затем, связываясь с аллостерическим центром фермента, – как аллостерический ингибитор. Увеличение соотношения АТФ/АМФ приводит к угнетению активности фосфофруктокиназы. Так, в неработающей мышце концентрация АТФ относительно высока и гликолиз заторможен. Во время работы АТФ расходуется и активность фосфофруктокиназы повышается, следовательно, процесс гликолиза активируется.
Как было установлено позже, важнейшим аллостерическим регулятором фосфофруктокиназы является фруктозо-2,6-дифосфат.
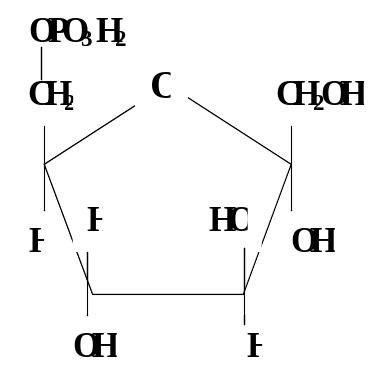
4-я реакция:
Фруктозо-1,6-дифосфат
Альдолаза





СН2―О―РО3Н2
│
С ═ О
│
СН2―ОН
Диоксиацетон
фосфат
H
С ═ О
Триозофосфат-
изомераза
│HСОH
│
СН2―О―РО3Н2
3-фосфоглицериновый
альдегид (3-ФГА)
4-я реакция обратима. Катализирующий её фермент называется альдолазой, так как расщепляется альдол – фруктозо-1,6-дифосфат. Равновесие реакции сдвинуто в сторону распада фруктозо-1,6-дифосфата, поскольку образующийся 3-ФГА расходуется в дальнейших реакциях гликолиза. Именно в силу последнего обратимая триозофосфатизомеразная реакция также смещается в сторону образования 3-ФГА.
Определение активности альдолазы используют в энзимодиагностике при заболеваниях, связанных с повреждением или гибелью клеток: так, при остром гепатите активность этого фермента может увеличиваться в 5-20 раз, при инфаркте миокарда – в 3-10 раз, при миодистрофии – в 4-10 раз.
Таким образом, в подготовительной стадии гликолиза фактически образуется 2 молекулы 3-ФГА.
Следующая стадия гликолиза – гликолитическая оксидоредукция – является более сложной.
5-я реакция.
В этой реакции 3-ФГА окисляется дегидрогеназой 3-фосфоглице-ринового альдегида. Фермент состоит из 4-х одинаковых субъединиц, в состав его активного центра входит SH-группа. Дегидрогеназа 3-ФГА нуждается также в коферменте НАД+.
Фермент окисляет свой субстрат (3-ФГА), перенося водород альдегидной группы 3-фосфоглицеринового альдегида на кофермент НАД+, который при этом восстанавливается в НАДН∙Н+ в присутствии неорганического фосфата. Выделяющейся при окислении 3-ФГА энергии достаточно для образования высокоэргического (т.е. заключающего в себе м а к р о э р г и ч е с к у ю связь) соединения – 1,3-дифосфоглицериновой кислоты (1,3-ДФГК).
Образование НАДН∙Н+ из окисленной формы этого кофермента осуществляется в ходе реакции связывания 3-ФГА с SH-группой активного центра фермента – дегидрогеназы 3-фосфоглицеринового альдегида:
CH2O℗ CH2O℗ CH2O℗ CH2O℗
│ │ НАД+
НАДН∙Н+
│
│
│ НАД+
НАДН∙Н+
│
│
CHOH CHOH CHOH CHOH
│ 1 │ 2 │ 3 │
H―C═O H―C―OH C═O C═O
3-ФГА │ │ │
S S O
1,3-ДФГК
SH
6-я реакция.
Эта реакция получила название реакции субстратного фосфорилирования – фосфорилирование АДФ за счёт энергии макроэргического субстрата. Реакция сопровождается выделением значительного количества свободной энергии, поэтому её равновесие сдвину вправо. Она может стать обратимой при избытке 3-фосфоглицерата.
СН2О―РО3Н2 Mg2+ СН2О―РО3Н2
| фосфоглицераткиназа |

 Н―С―ОН
+ АДФ АТФ
+ Н―С―ОН
Н―С―ОН
+ АДФ АТФ
+ Н―С―ОН
| |

 С═О
С═О
С═О
С═О
О~ РО3Н2 ОН
1,3-ДФКГ 3-фосфоглицерат
7-я реакция.
Изомеризация 3-фосфоглицерата в 2-фосфоглицерат:
СН2О―РО3Н2 СООН
| фосфоглицеромутаза |
Н―С―ОН + АДФ АТФ + Н―С―О―РО3Н2
| |
С═О СН2ОН
ОН
3-фосфоглицерат 2-фосфоглицерат
8-я реакция.
Образование макроэргического субстрата – фосфоенолпирувата (фосфоенолПВК). Реакция катализируется енолазой. Фермент отщепляет молекулу воды от 2-фосфоглицерата и перераспределяет внутримолекулярную энергию субстрата таким образом, что фосфат во втором положении переходит в макроэргическое состояние.
СООН СООН
| |
Н―С―О―РО3Н2 енолаза С―О~ РО3Н2

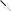 |
║
|
║
СН2ОН Н2О СН2
2-фосфоглицерат фосфоенолопируват
9-я реакция.
Это реакция субстратного фосфорилирования (аналогично 6-й реакции): осуществляется фосфорилирование АДФ за счёт энергии макроэргического субстрата – фосфоэнолпирувата.
СООН COOH
| |
С―О~ РО3Н2 +АДФ пируваткиназа (Mg2+ ) C═O + ATФ
║ |
СН2 CH3
Фосфоенолопируват ПВК
Реакция образования ПВК (пировиноградной кислоты) необратима, так как протекает со значительным падением свободной энергиию.
10-я реакция.
Заключительная реакция гликолиза – образование лактата. Реакция обратима. Молочная кислота образуется при восстановлении пирувата ферментом лактатдегидрогеназой (ЛДГ), коферментом которого является НАДН∙Н+ (образование этого кофермента см. в 5 –й реакции).
СООН СН3
| |
С═O + НАДН∙Н+ Лактатдегидрогеназа Н―С―ОН + НАД+
 |
|
|
|
СН3 СН3
ПВК Лактат
Итак, гликолиз завершается образованием лактата. В мышцах молочная кислота не используется – она поступает с током крови в печень, где вновь превращается (благодаря обратимости ЛДГ-азной реакции) в пируват. Изоферменты лактатдегидрогеназы принимают участие в контроле гликолиза: так, в сердечной мышце преобладает ЛДГ1, который ингибируется даже небольшими концентрациями пирувата, что затрудняет образование молочной кислоты в кардиомиоцитах и способствует дальнейшему окислению (а не восстановлению) пирувата; в скелетных мышцах преобладает изофермент ЛДГ5, активно превращающий ПВК в лактат в анаэробных условиях.
Гликолиз протекает в цитоплазме клетки, он не нуждается в участии кислорода для получения клеткой энергии. В ходе гликолиза в 2-х реакциях субстратного фосфорилирования (реакции 6-я и 9-я) образуется 4 молекулы АТФ --(напоминаем, что в реакцию вступают 2 триозы), однако в подготовительной стадии 2 молекулы АТФ расходуются (реакции 1-я и 3-я), таким образом, полезный энергетический выход гликолиза составляет 2 молекулы АТФ.
Мебрана митохондрий непроницаема для образующегося оксалацетата (ЩУК). Однако, превращаясь в яблочную кислоту при участии митохондриальной НАД+-зависимой малатдегидрогеназы, малат легко покидает митохондрию и в цитозоле клетки окисляется в ЩУК при участии цитоплазматической НАД+-зависимой малатдегидрогеназы. Дальнейшее превращение ЩУК в фосфоенолПВК происходит в цитозоле клетки.
