
Спирты
.docСПИРТЫ
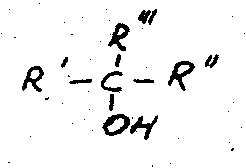
![]()
![]()
первичный вторичный третичный
Спирты с гидроксильной группой при атоме углерода с двойной связью или с несколькими группами, связанными с одним и тем же атомом углерода, не существуют. Если при химических реакция, возможно образование подобных соединений, то они подвергаются или изомеризации; или дегидратации соответственно.
Спирты обычно называют по радикалу, связанному с гидроксильной группой:
СН3 —ОН— метиловый спирт
СН3—СН2 —ОН — этиловый спирт
СН2 =СН—СН2—ОН — аллиловый спирт
С6Н5—СН2—ОН — бензиловый спирт
Иногда спирты рассматривают как производные простейшего метилового спирта — карбинола СНЗОН
Ф
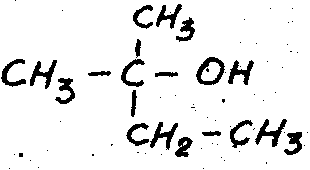
—диметилэтилкарбинол
По номенклатуре ИЮПАК название спирта составляется из названия соответствующего углеводорода с добавлением суффикса – ОЛ и указания номера углеродного атома в цепи, который связан с гидроксильной группой:
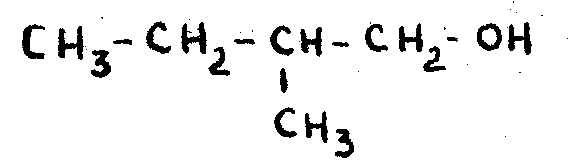
При названии многоатомных спиртов используют умножающие пристав- ки ди- три- и т.д.
![]()
Получение спиртов
I. Гидролиз галогенопроизводных углеводородов
![]()
2. Гидратация (присоединение воды) этиленовых углеводородов. Присоединение воды происходит в присутствии серной кислоты
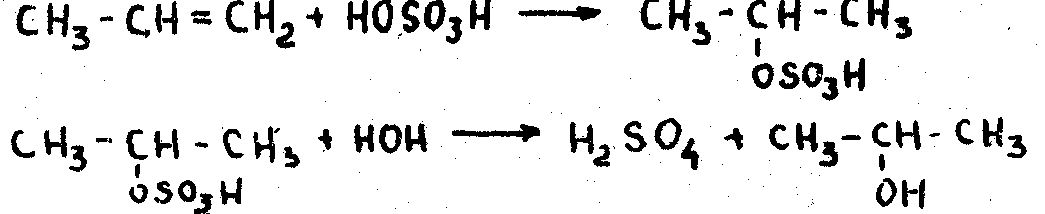
Реакция идет по правилу Марковникова.
3. Каталитическое восстановление альдегидов и кетонов. При восстановлении альдегидов получаются первичные спирты, н при восстановлении кетонов - вторичные.
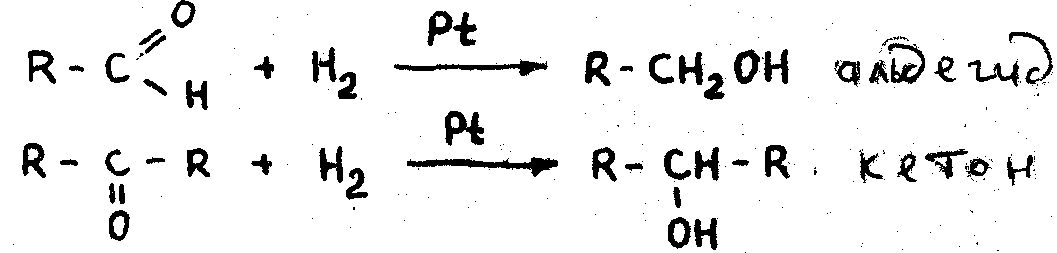
Химические свойства спиртов
Химические свойства спиртов обусловлены наличием гидроксиль- ной группы, причем при химических реакциях может разрываться связь С-О или О-Н.
1. Взаимодействие с активными металлами.
Спирты — практически нейтральные вещества: они не изменяют окраску индикаторов, не вступают в реакции ни с водными растворами щелочей, ни с разбавленными кислотами. Однако спирт, подобно воде, могут взаимодействовать с активными металлами, кото- рые вытесняют водород из гидроксильной группы, в результа- те чего образуются алкоголяты
![]()
Алкоголяты необратимо гидролизуются водой.
![]()
2. Дегидратация (отщепление воды) спиртов.
а) межмолекулярная дегидратация приводит к образованию простых эфиров
![]()
б) внутримолекулярную дегидратацию проводят при более высокой температуре. В результате реакции образуются алкены
![]()
Отщепление воды происходит по правилу Зайцева.
![]()
Для смещения равновесия в сторону образования сложного эфира реакцию проводят в присутствии водоотнимающих средств.
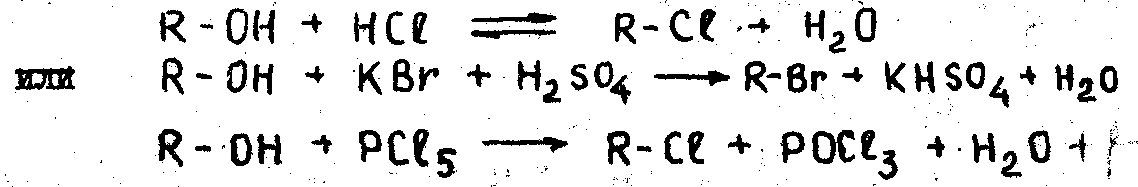
4. Замещение гидроксильной группы, на галоген под действием галогеноводородных кислот или галогенидов фосфора
5. Окисление спиртов. Окисление спиртов проводят или кислородом воздуха на мед- ном катализаторе, или бихроматом калия, или перманганатом калия.
Первичные спирты превращаются в альдегиды, вторичные — в ке- тоны. Окисление третичных спиртов происходит с трудом и сопровож- дается разрывом углеродного скелета, в результате чего образуется смесь органически кислот и кетонов
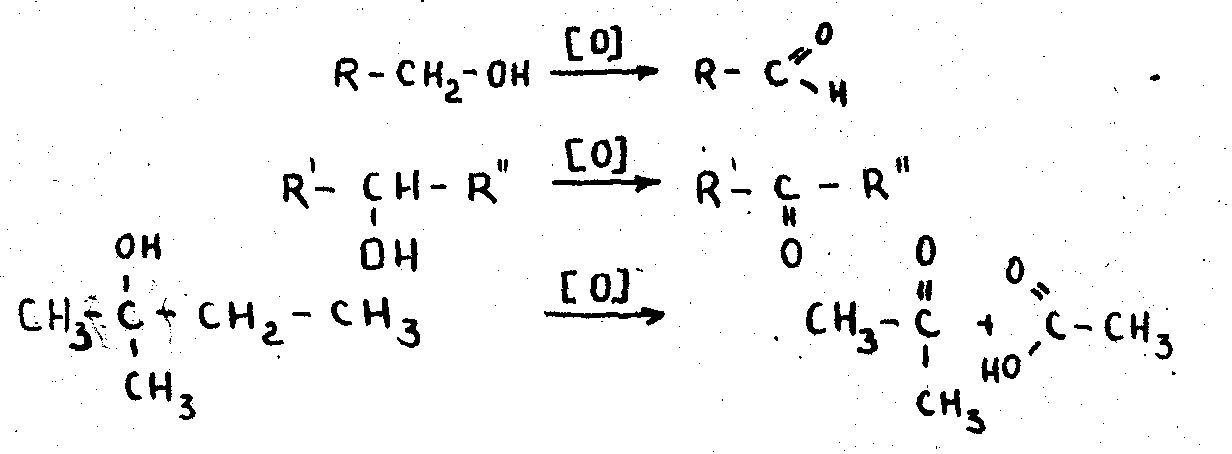
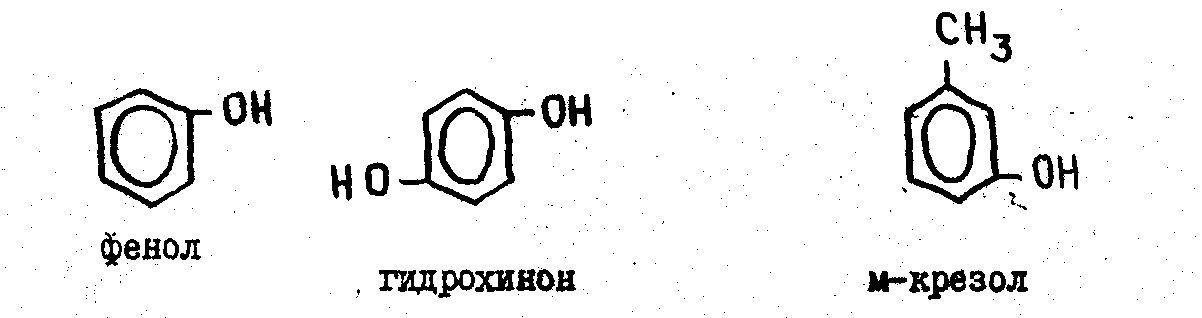
ФЕНОЛЫ
В отличие от ароматических спиртов в фенолах гидроксильная группа непосредственно связана с бензольным кольцом.
Обычно. используются тривиальные названия
I. Сплавление солей судьфокислот со щелочами
![]()
2. Гидролиз галогенопроизводных ароматических углеводородов
![]()
3.Кумольный способ
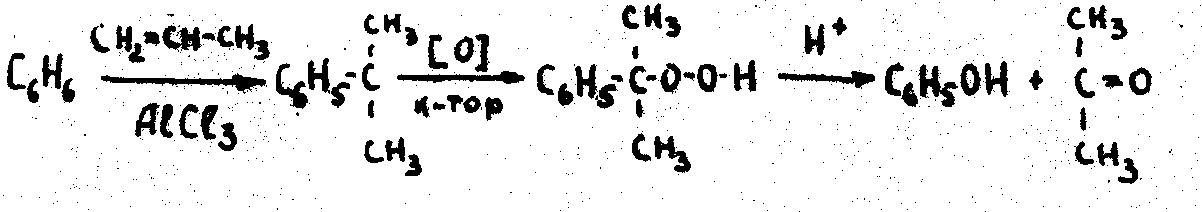
Химические свойства
Факелы в отличие от спиртов обладают кислотными свойствами
![]()
Поэтому они реагируют с едкими щелочами с образованием фенолятов
![]()
Фенолы с хлоридом железа образуют окрашенные комплексные соли. Это используют для качественного открытия фенолов. Для фено- лов возможны такие реакции, характерные как для спиртов, так и для
ароматических углеводородов, причем реакции галогенирования, суль- фирования и нитрования идут более энергично, чем для ароматических углеводородов.
Простые эфиры можно рассматривать как продукты замещения атомов водорода в воде на радикалы
![]()
Получают их обычно межмолекулярной дегидратацией спиртов
![]()
другой способ получения заключается в реакции галогенопроизводных углеводородов с алкоголятами:
![]()
Это малореакционные вещества, разлагающиеся под действием концентрированной йодистоводородной кислоты, в результате чего образуютсяя в общем случае четыре вещества;
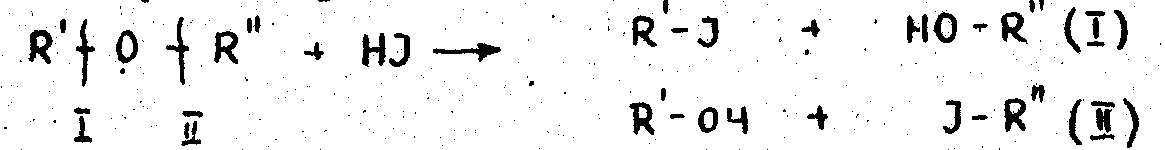
При избытке кислоты образовавшиеся вещества восстанавливаютсяя до углеводородов, имеющих состав R' - H и R" – Н.
