
Ответы на 1 и 2 вопросы экзамена за 1 курс. Все билеты
..doc1-1.Электролиз – это окислительно-восстановительная реакция, протекающая при прохождении постоянного электрического тока через раствор или расплав электролита. Законы Фарадея:1)Массы веществ, выделившиеся на электродах, пропорциональны количеству прошедшего электричества через раствор или расплав электролита и химическому эквиваленту.2)Для разных электродных процессов при одинаковом количестве электричества, пропущенного через электролит, массы образовавшихся веществ пропорциональны их химическим эквивалентам. При прохождении через раствор или расплав электролита 96500 Кл на электродах выделяется один моль эквивалентов вещества. M=Э*I*t/96500.Ряд напряжений, последовательность расположения электродов в порядке возрастания их стандартных электродных потенциалов.
Электролиз расплава хлорида натрия на инертных электродах.
NaCl ⇄ Na+ + Cl-.
Катод (-): Na+ + 1ē = Na.
Анод (+): 2Cl- - 2ē = Cl2↑.
Электролиз раствора сульфата меди с медными электродами.
CuSO4
⇄ Cu2+
+
SO![]() .
.
Катод (-): Cu2+ + 2ē = Cu.
Анод (+): Cu - 2ē = Cu2+.
В химической промышленности электролизом получают хлор и фтор, щелочи. Электролиз в гидрометаллургии является одной из стадий переработки металлсодержащего сырья, обеспечивающей получение товарных металлов. В цветной металлургии электролиз используется для извлечения металлов из руд и их очистки. Электролизом расплавленных сред получают алюминий, магний, титан, цирконий, уран, бериллий и др. Гальванотехника - область прикладной электрохимии, занимающаяся процессами нанесения металлических покрытий на поверхность как металлических, так и неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника подразделяется на гальваностегию и гальванопластику.
1-2.Гидролиз – это ионно-обменная реакция между водой и растворенным в ней веществом. Гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой; слабым основанием и сильной кислотой; слабой кислотой и слабым основанием. Соли, образованные многоосновными кислотами или многоатомными основаниями гидролизуются ступенчато, образуя на первой ступени кислые или основные соли. Вторая ступень идет в гораздо меньшей степени, чем первая. Гидролиз соли, образованной сильным основанием и слабой кислотой (I ступень):
Na2CO3 + HOH ⇄ NaHCO3 + NaOH;
2Na+
+ C![]() + HOH ⇄ HCO3-
+ 2Na+
+ OH-;
+ HOH ⇄ HCO3-
+ 2Na+
+ OH-;
C![]() + HOH ⇄ HCO3-
+
OH-.
+ HOH ⇄ HCO3-
+
OH-.
В результате гидролиза образуется избыток гидроксид-ионов, поэтому раствор карбоната натрия имеет щелочную реакцию со значением рН > 7.
2. Гидролиз соли, образованной слабым основанием и сильной кислотой (I ступень):
ZnCL2 + HOH ⇄ ZnOHCl + HCl;
Zn2+ + 2Cl- + HOH ⇄ ZnOH+ + 2Cl- + H+;
Zn2+ + HOH ⇄ ZnOH+.
В этом случае происходит гидролиз по катиону. В результате гидролиза образуется избыток ионов водорода, поэтому раствор соли имеет кислую реакцию со значением рН < 7.
Гидролиз соли, образованной слабым основанием и слабой кислотой:
CH3COONH4 + HOH ⇄ CH3COOH + NH4OH;
CH3COO- + NH4+ + HOH ⇄ CH3COOH + NH4OH.
Вэтом случае гидролиз происходт как по аниону,так и по катиону. Реакция раствора практически нейтральна и значение рН близко к 7.
Количественной характеристикой протекания реакции гидролиза является константа равновесия (Кp). Для реакции гидролиза карбоната натрия по первой ступени можно написать выражение константы равновесия
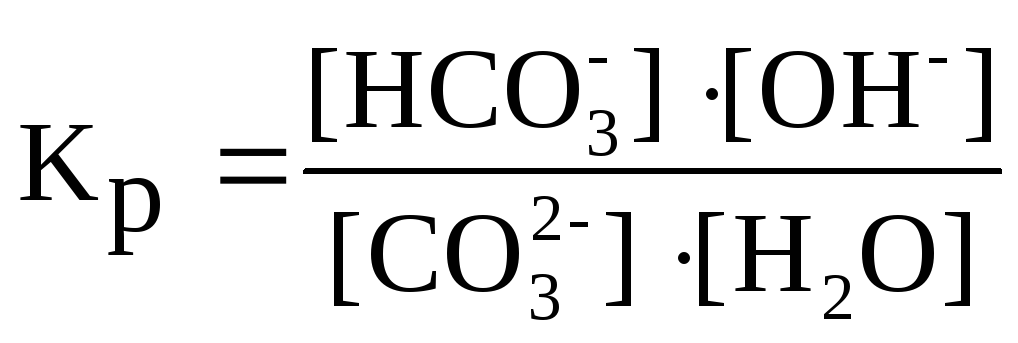 .
Концентрация воды в разбавленных
растворах представляет собой практически
постоянную величину. Обозначая K·[H2O]
=
.
Концентрация воды в разбавленных
растворах представляет собой практически
постоянную величину. Обозначая K·[H2O]
=
![]() .,
получим выражение для константы
гидролиза:
.,
получим выражение для константы
гидролиза: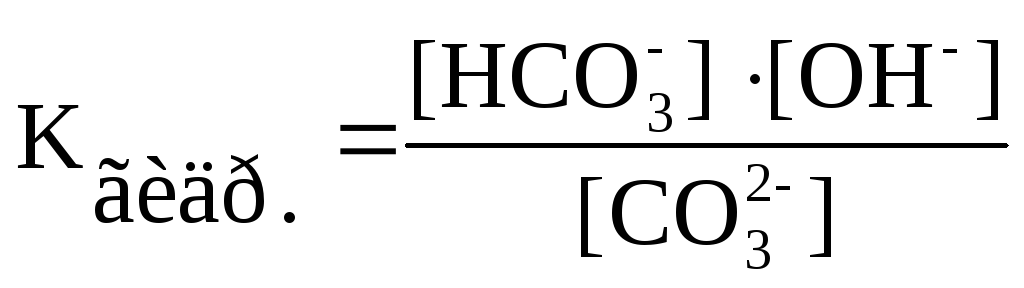 Степень
гидролиза, т. е. отношение числа молекул,
подвергшихся гидролизу, к общему числу
молекул, как правило, невелика. Причиной
этого является то, что вода – очень
слабый электролит, поэтому равновесие
реакции гидролиза смещено в сторону
исходных веществ. В разбавленных
растворах соли гидролизуются сильнее.
При повышении температуры степень
гидролиза увеличивается. Для подавления
гидролиза нужно использовать
концентрированные растворы при низких
температурах, а также добавлять к
раствору один из продуктов гидролиза:
кислоту или щелочь.
Степень
гидролиза, т. е. отношение числа молекул,
подвергшихся гидролизу, к общему числу
молекул, как правило, невелика. Причиной
этого является то, что вода – очень
слабый электролит, поэтому равновесие
реакции гидролиза смещено в сторону
исходных веществ. В разбавленных
растворах соли гидролизуются сильнее.
При повышении температуры степень
гидролиза увеличивается. Для подавления
гидролиза нужно использовать
концентрированные растворы при низких
температурах, а также добавлять к
раствору один из продуктов гидролиза:
кислоту или щелочь.
2-1. Растворы состоят из растворителя и одного (или более) растворенных веществ. Наиболее распространенными являются водные растворы (растворитель вода). В неводных растворах, которые в последнее время находят все большее применение, могут быть использованы другие растворители (бензол, спирт, жидкий аммиак и т.д.).Растворенное вещество в растворах находится в виде изолированных молекул или ионов. В процессе образования раствора большую роль играет взаимодействие частиц растворенного вещества (молекул или ионов) с молекулами растворителя, т.е. сольватация (гидратация, если растворителем является вода). Энергетический эффект, наблюдаемый при растворении 1 моля вещества, называется энтальпией растворения (кДж/моль). Процесс растворения может быть экзотермическим (например, КОН) или эндотермическим (например, КNO3). Сольватация (гидратация) играет решающую роль и в процессах электролитической диссоциации молекул растворенного вещества на ионы. В соответствии с теорией электролитической диссоциации в растворах некоторых веществ происходит обратимый распад молекул на ионы. Поэтому в растворах таких веществ одновременно присутствуют молекулы и ионы. Количественно способность молекул вещества к электролитической диссоциации описывается степенью электролитической диссоциации ( % = 100 %) и константой электролитической диссоциации Kдис., т.е. константой равновесия, записанной для обратимого процесса электролитической диссоциации. Способность к электролитической диссоциации зависит от природы растворенного вещества, природы растворителя, от температуры, концентрации раствора и наличия в растворе одноименных ионов. Закон разбавления (разведения) Оствальда устанавливает взаимосвязь между , Kдис и молярной концентрацией растворенного вещества в растворе СМ
Kдис. = CM 2.
По величине степени диссоциации электролиты условно делят на слабые ( 3 %), сильные ( 30 %) и средней силы ( = 3-30 %). В растворах сильных электролитов (особенно при малых концентрациях См 0,1 моль/л) можно принять, что все молекулы растворенного вещества полностью распадаются на ионы, а недиссоциированные молекулы отсутствуют. Вода относится к очень слабым электролитам (Kдис. = 1,8 10-16). Произведение [Н+] [ОН-] = 10-14 при t = 22 oC постоянно для чистой воды и водных растворов различных веществ. Возможность и скорость протекания реакций в водных растворах в большей степени зависит от концентрации [Н+], поэтому эта величина имеет большое значение. Для удобства используют не величину [Н+], а водородный показатель рН = -lg[Н+].
Ионное произведение воды, произведение концентраций (точнее активностей) ионов водорода Н+ и ионов гидроксила OH— в воде или в водных растворах: KB = [Н+] [ОН—]. КH2O = 1.10-4 Данная константа для воды называется ионным произведением воды, которое зависит только от температуры.При диссоциации воды на каждый ион Н+ образуется один ион ОН-, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН-]. Используя значение ионного произведения воды, находим:
[H+] = [ОН-] = моль/л.
Таковы концентрации ионов Н+ и ОН- в чистой воде. Рассмотрим, как изменится концентрация при добавлении других веществ, например, соляной кислоты, которая диссоциирует в воде на ионы Н+ и Сl-. Концентрация ионов Н+ в растворе станет увеличиваться, но ионное произведение воды от концентрации не зависит - в таком случае уменьшается концентрация [ОН-].
Напротив, если к воде добавить щелочь, то концентрация [ОН-] увеличится, а [Н+] уменьшится. Концентрации [Н+] и [ОН-] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+] > 10-7 моль/л, в нейтральных [Н+] = 10-7 моль/л, в щелочных [Н+] < 10-7 моль/л. Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным ателем и обозначая ее рН:
pН = -lg[Н+]. В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных pH > 7.
2-2.Скорость химической
реакции, величина, характеризующая
интенсивность реакции химической.
Скоростью образования продукта реакции
называется количество этого продукта,
возникающее в результате реакции за
единицу времени в единице объёма (если
реакция гомогенна) или на единице площади
поверхности (если реакция гетерогенна).
Для исходных веществ аналогичным образом
определяется скорость их расходования.
Количества веществ выражают в молях.
Тогда скорости образования продуктов
и расходования исходных веществ относятся
как стехиометрия, коэффициенты этих
веществ в уравнении реакции.
Скорость химических реакций в гомогенных
системах
равна изменению молярной концентрации
одного из веществ, участвующих в процессе,
за единицу времени.![]() (моль/лс).
Скорость
химической реакции зависит от природы
реагирующих веществ, их концентраций,
от температуры и присутствия катализатора.
Зависимость скорости химической реакции
от концентрации определяется законом
действующих масс:
скорость химической реакции пропорциональна
произведению молярных концентраций
реагирующих веществ, взятых в степенях,
соответствующих коэффициентам для этих
веществ в уравнении химической реакции.
Если уравнение реакции имеет вид
(моль/лс).
Скорость
химической реакции зависит от природы
реагирующих веществ, их концентраций,
от температуры и присутствия катализатора.
Зависимость скорости химической реакции
от концентрации определяется законом
действующих масс:
скорость химической реакции пропорциональна
произведению молярных концентраций
реагирующих веществ, взятых в степенях,
соответствующих коэффициентам для этих
веществ в уравнении химической реакции.
Если уравнение реакции имеет вид![]() то
для этой реакции выражение скорости
определяется уравнением
то
для этой реакции выражение скорости
определяется уравнением![]() ,где
v
- скорость реакции; a
и b
– стехиометрические коэффициенты в
уравнении реакции; k
– константа скорости; [A]
и [B]
– молярные концентрации веществ A
и B
соответственно.
Влияние температуры на скорость
химической реакции.
Зависимость скорости реакции от
температуры приближенно может быть
выражена правилом Вант-Гоффа, согласно
которому при увеличении температуры
на каждые 10 градусов скорость химической
реакции возрастает в 2-4 раза. Если
известна скорость химической реакции
v1
при температуре T1,
то скорость этой реакции при температуре
T2
может быть вычислена по формуле
,где
v
- скорость реакции; a
и b
– стехиометрические коэффициенты в
уравнении реакции; k
– константа скорости; [A]
и [B]
– молярные концентрации веществ A
и B
соответственно.
Влияние температуры на скорость
химической реакции.
Зависимость скорости реакции от
температуры приближенно может быть
выражена правилом Вант-Гоффа, согласно
которому при увеличении температуры
на каждые 10 градусов скорость химической
реакции возрастает в 2-4 раза. Если
известна скорость химической реакции
v1
при температуре T1,
то скорость этой реакции при температуре
T2
может быть вычислена по формуле![]() ,где
- температурный коэффициент скорости
химической реакции, равный 2-4.
Скорость реакции в гетерогенных системах.
Гетерогенная реакция протекает на
поверхности раздела фаз, поэтому, чем
больше поверхность соприкосновения,
тем выше скорость реакции. Вот почему
твердые вещества значительно быстрее
реагируют в измельченном состоянии.
,где
- температурный коэффициент скорости
химической реакции, равный 2-4.
Скорость реакции в гетерогенных системах.
Гетерогенная реакция протекает на
поверхности раздела фаз, поэтому, чем
больше поверхность соприкосновения,
тем выше скорость реакции. Вот почему
твердые вещества значительно быстрее
реагируют в измельченном состоянии.
3-1.Главное квантовое число n=1,2,3 характеризует энергию е и размер электронного облака. Показывает кол-во подуровней. Орбитальное (побочное) квантовое число характеризует форму электронной орбитали .l=0 – s, l=1 – p, l=2 – d, l=3 – f. Магнитное квантовое число m – хар-ка орбитали и положения е облака в пространстве. Энергетический подуровень — совокупность орбиталей с одинаковыми значениями главного и орбитального квантовых чисел. Энергетический подуровень обозначается латинскими буквами: s, p, d, f .S-орбитали – круглые, p-гантелеобразные. Магнитное квантовое число – это целое число, обозначающее номер уровня и характеризующее расположение орбитали в пространстве. Количество орбиталей в s-0, в p-1, в d-2, в f-3.
3-2. Химические
реакции протекают с выделением или
поглощением энергии, чаще всего в виде
теплоты. Реакции, при которых теплота
выделяется, называются экзотермическими,
поглощается – эндотермическими.
Количество теплоты, выделяющееся или
поглощающееся при химической реакции,
протекающей при постоянной температуре,
называется тепловым эффектом реакции.
При постоянном давлении тепловой эффект
реакции равен изменению энтальпии (ΔН).
Тепловой эффект экзотермической реакции
считают отрицательным (ΔН<0), а
эндотермической – положительным
(ΔН>0).Тепловой эффект реакции выражается
в единицах энергии – килоджоулях (кДж)
или килокалориях (ккал) (1ккал = 4,1868кДж).
Тепловой эффект реакции (ΔН) зависит от
природы реагирующих веществ, от количества
этих веществ и их агрегатного состояния,
от температуры.Для сопоставления
энергетических эффектов различных
реакций и для проведения термохимических
расчетов используют стандартные тепловые
эффекты (обозначаются
![]() ).
).
Под стандартным понимается тепловой эффект реакции, осуществляемой в условиях, когда все участвующие в реакции вещества находятся в заданных стандартных состояниях (давление 101 кПа). В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН) записывать отдельно, через запятую.
Например,
термохимическое уравнение![]() кДж,
кДж,
показывает, что данная химическая реакция сопровождается выделением 1531кДж теплоты, если давление 101кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции.Важнейшей величиной в термохимии является стандартная теплота образования (стандартная энтальпия образования). Стандартной теплотой (энтальпией) образования сложного вещества называется тепловой эффект (изменение стандартной энтальпии) реакции образования одного моля этого вещества из простых веществ в стандартном состоянии. Стандартная энтальпия образования простых веществ в этом случае принята равной нулю. В основе термохимических расчетов лежит закон Гесса. Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) не зависит от пути ее протекания, а зависит от природы и физического состояния исходных веществ и продуктов реакции.Следствия из закона Гесса1.Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.
2.Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ, взятых с учетом коэффициентов в уравнении реакции.
4-1.Дипольный момент связи (m) - векторная величина, характеризующая полярность связи: |m| = l·q, где l - длина связи, q - эффективный заряд, который приобретают атомы при смещении электронной плотности. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы. Молекулы с отличным от нуля дипольным моментом называются полярными. Величина дипольного момента сильно влияет на свойства полярных молекул и веществ, построенных из таких молекул. Полярные молекулы поляризуются в
электрическом поле, устанавливаясь по силовым линиям поля, ориентируются вэлектических полях, создаваемых ионами в растворах, взаимодействуют между собой, замыкая свои электрические поля. Дипольный момент образуется за счет смещения центров положительного и отрицательного зарядов на некоторую величину l, называемую длиной диполя. Чем более полярны молекулы, чем значительнее смещены валентные электронные пары к одному из атомов, тем больше ?. И наоборот, если электрическая ассиметрия молекул незначительна, то величина ? невлика ..Для системы из двух частиц дипольный момент ? равен: ? = el. Где e- величина заряда;l- расстояние между центрами. Однако, определяя разу величину дипольного момента, мы не знаем ни величины заряда e, локализованного в полярной молекуле, ни расстояния между центрами. Полярные: NH3, PCl3, HCl. Неполярные: BCl3,CH4.
Потомушто увеличивается электроотрицательность атома.А это способность притягивать к ебе общую электронную пару. Она увеличивается в периоде слва-направо, в группе снизу-вверх. HF более полярна.
4-2. Электродный потенциал, разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом.
Практическое значение имеют относительные Электродный потенциал, обычно называемые просто Электродный потенциал, представляющие собой разность Электродный потенциал рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, Электродный потенциал которого условно принимается равным нулю. Водородный электрод, платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода. Потенциал Водородный электрод возникает за счёт обратимо протекающей реакции . Стандартный э. п. – это потенциал данного электродного процесса, при концетрации учавствующих в нём веществ, равных единицы. Вывод из ряда напряжений: Ме, расположенные между Магнием и Водородом, вытесняют водород из кислот. Ме способны вытеснять друг друга из растворов солей.
5-1. S-30, p-14, d-37, f-11. S-элементами наз. элементы, у которых в последнюю очередь заполняется s-подуровень внешнего уровня. P-элементам наз. Элементы, у которых в последнюю очередь заполняется p-подуровень внешнего уровня. D-элементами наз. Элементы, у которых в последнюю очередь заполняется d-подуровень предпоследнего уровня. F-элеменентами наз элементы, у которых в последнюю очередь заполняется f-подуровень третьего от конца уровня.
5-2. Электродный потенциал – это потенциал данного электродного процесса при концентрациях всех активных веществ, равных единице. Элемент Даниэля-Якоби – медно-цинковый гальванический элемент. Состоит из медной пластины, погруженной в раствор сульфата меди, и цинковой пластины, погруженной в раствор сульфата цинка. Растворы соприкасаются друг с другом, но разделены перегородкой из пористого материала. Цинк окисляется, освобождаются его е и идут к медному электроду. Там восстанавливаются ионы. Таким образом в растворе наблюдается направленное движение ионов. ЭДС гальванического элемента – максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции.
6-1. Магнитное квантовое число – это целое число, обозначающее номер уровня и характеризующее расположение орбитали в пространстве. Количество орбиталей в s-0, в p-1, в d-2, в f-3. Спиновое квантовое число отражает наличие у е собственного момента движения. Принимает два значения: ½ И – ½ . Правило Паули: в каждой орбитали может находиться не больше двух электронов. Максимальное число е на уровнях: 1-2, 2-8, 3-18, 4-32; на подуровнях: s-2, p-6, d-10, f-14; на орбиталях l=0-2, l=1-2, l=2-2, l=3-2.
6-2. Произведение растворимости - когда в насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Условие образования осадка: осадок образуется в том случае, если произведение концентраций ионов в растворе, полученном после смешения двух растворов, больше или равно произведению растворимости.
7-1. Электролиты – вещества, проводящие эл ток своими ионами. Неэлектролиты – вещества, нераспадающиеся на ионы в растворах или расплавах, ток не проводят. Электролитическая диссоциация – процесс распада электролита на ионы в растворе под влиянием полярных молекул растворителя или в расплаве под влиянием температуры. Степень эл. Дис. Зависит от природы электролита и растворителя. Это отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе. Константа дис. – это константа равновесия, записанная для раствора слабого электролита. Зависит от природы электролита, растворителя, от температуры, но не зависит от концентрации раствора. Сильные – щёлочи, сильные кислоты.
7-2. Периодический закон – свойства простых веществ, а также формулы и свойства элементов, находящихся в периодической зависимости от заряда и ядра элемента. Энергия ионизации – энергия, необходимая для отрыва валентного е от атома. Наименьший потенциал ионизации у щелочей, наибольший – у инертных газов. Радиус атома сверху вниз увеличивается, слева-направо – уменьшается. Слево-направо: Энергия ионизации растёт, энергия сродства растёт, восст свойства уменьшаются, Электроотрицательность растёт.
8-1. Состояние атома с минимально возможной энергией электронов в нем называется основным, или невозбужденным, состоянием. Однако, если атомы получают энергию извне (например, при облучении, нагревания), то электроны внешнего электронного слоя могут ``распариваться'' и переходить на свободные орбитали, характеризующиеся большей энергией. Такое состояние атома называется возбужденным. sp –Гибридизация (дигональная), при которой взаимодействуют 1 s и 1 p орбитали. Возникают 2 одинаковых электронных орбитали, расположенные линейно под углом 180о, они имеют форму объемной восьмерки, одна из лопастей которой значительно больше другой. Оставшаяся негибридизованные орбитали взаимно перпендикулярны и перпендикулярны плоскости, в которой лежат sp-гибридные орбитали. sp2 –Гибридизация (тригональная), при которой взаимодействуют 1 s и 2 p орбитали. Возникают 3 одинаковых электронных орбитали, с осями расположенными в одной плоскости и направленными из центра треугольника к его вершинам под углом 120о. sp2-Гибридные орбитали имеют форму объемной восьмерки, одна из лопастей которой значительно больше другой. Оставшаяся негибридизованная р-орбиталь перпендикулярна плоскости, в которой лежат гибридные орбитали. sp3 –Гибридизация (тетраэдрическая), при которой взаимодействуют 1 s и 3 p орбитали. Возникают 4 одинаковых электоронных орбитали, направленные к вершинам тетраэдра, в центре которого находится ядро атома углерода. Угол между нами 109о28’, они имеют форму объемной восьмерки, одна из лопастей которой значительно больше другой.
8-2. Растворимость газов в оде – процесс экзотермический. Поэтому растворимость газов с повышением температуры уменьшается. Закон Генри констатирует достаточно простой факт: чем выше давление газа над поверхностью жидкости, тем труднее растворенному в ней газу высвободиться. Масса газа растворяющегося при постоянной температуре, в данном объеме жидкости, прямо пропорциональна парциальному давлению газа. В общем, повышение давления увеличивает растворимость газа. W=k*p –массовая доля газа в насыщенном растворе равна произведению константы пропорциональности на парциальное давление. Процесс растворения подчиняется принципу Ле Шателье (1884): если на систему, находящуюся в равновесии, оказывается какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится. Растворение газов в жидкостях обычно сопровождается выделением тепла. При этом, в соответствии с принципом Ле-Шателье, растворимость газов уменьшается.
9-1.Квантование
это поглощение или выделение одного
кванта энергии электроном при переходе
его с одного энергетического уровня на
другой. В 1900 г. немецкий физик М. Планк,
изучавший тепловое излучение твердых
тел, пришел к выводу, что электромагнитное
излучение испускается в виде отдельных
порций - квантов - энергии. Значение
одного кванта энергии равно ΔE = hν, где
ΔE - энергия кванта, Дж; ν - частота, с-1; h
- постоянная Планка (одна из фундаментальных
постоянных природы), равная 6,626·10−34
Дж·с. Кванты энергии впоследствии
назвали фотонами. Главное
квантовое число n
характеризует энергию атомной орбитали.
Оно может принимать любые положительные
целочисленные значения. Чем больше
значение n,
тем выше энергия и больше размер орбитали.
Совокупность состояний электрона в
атоме с одним и тем же значением n
называют энергетическим
уровнем.
Число уровней, на которых находятся
электроны в основном состоянии атома,
совпадает с номером периода, в котором
располагается элемент. Номера этих
уровней обозначают цифрами: 1, 2, 3,...
Спектральные
линии, узкие
участки в спектрах
оптических,
каждый из которых можно охарактеризовать
определённой длиной волны l (или частотой
![]() ,
где с —
скорость света). СПЕКТРАЛЬНЫЕ
ЛИНИИ
линии в спектрах электромагнитного
излучения атомов, молекул и др. квантовых
систем. Излучение, соответствующее
данной спектральной линии, характеризуется
определенной длиной волны (и, следовательно,
частоты). Каждая спектральная линия
отвечает определенному квантовому
переходу. В соответствии с направлением
перехода различают спектральные линии
поглощения и испускания.
,
где с —
скорость света). СПЕКТРАЛЬНЫЕ
ЛИНИИ
линии в спектрах электромагнитного
излучения атомов, молекул и др. квантовых
систем. Излучение, соответствующее
данной спектральной линии, характеризуется
определенной длиной волны (и, следовательно,
частоты). Каждая спектральная линия
отвечает определенному квантовому
переходу. В соответствии с направлением
перехода различают спектральные линии
поглощения и испускания.
9-2. Процесс распада
электролитов на ионы под влиянием
растворителя называется электролитической
диссоциацией.
Вещества, растворы или расплавы которых
проводят электрический ток, называются
электролитами. К ним относится подавляющее
большинство кислот, оснований и солей.
При попадании этих веществ в полярный
растворитель происходит электролитическая
диссоциация, сопровождающаяся образованием
сольватированных заряженных частиц
положительно заряженных катионов и
отрицательно заряженных анионов.
Электролитическая диссоциация вызывается
взаимодействием полярных молекул
растворителя с частицами растворяемого
вещества. Количественной характеристикой
электролитической диссоциации служит
степень
диссоциации
,
равная отношению числа диссоциированных
молекул Nдисс
к общему числу молекул электролита в
растворе Nобщ:
=
![]() .
По способности к электролитической
диссоциации электролиты условно
подразделяют на сильные и слабые. К
сильным
электролитам
обычно относят вещества, которые в
растворе практически полностью
диссоциированы на ионы (
1). Слабыми
электролитами считают
вещества, степень диссоциации которых
1. В водных растворах сильными электролитами
являются большинство солей, такие
кислоты, как HClO4,
HMnO4,
H2SO4,
HNO3,
HCl,
HBr,
HI,
а также гидроксиды щелочных и
щелочно-земельных металлов: LiOH, NaOH, KOH,
RbOH, CsOH, Ca(OH)2,
Sr(OH)2,
Ba(OH)2.
Степень
диссоциации кислоты равна .
Тогда при достижении равновесия
концентрации ионов Н+
и А
составят С,
а концентрация недиссоциированных
молекул кислоты
(С –
С)
= С(1–
).
Используя уравнение (1), получаем: Kд,
с
=
.
По способности к электролитической
диссоциации электролиты условно
подразделяют на сильные и слабые. К
сильным
электролитам
обычно относят вещества, которые в
растворе практически полностью
диссоциированы на ионы (
1). Слабыми
электролитами считают
вещества, степень диссоциации которых
1. В водных растворах сильными электролитами
являются большинство солей, такие
кислоты, как HClO4,
HMnO4,
H2SO4,
HNO3,
HCl,
HBr,
HI,
а также гидроксиды щелочных и
щелочно-земельных металлов: LiOH, NaOH, KOH,
RbOH, CsOH, Ca(OH)2,
Sr(OH)2,
Ba(OH)2.
Степень
диссоциации кислоты равна .
Тогда при достижении равновесия
концентрации ионов Н+
и А
составят С,
а концентрация недиссоциированных
молекул кислоты
(С –
С)
= С(1–
).
Используя уравнение (1), получаем: Kд,
с
=![]() =
=
![]() или Kд,
с
=
или Kд,
с
=
![]() Это
выражение носит название закона
разбавления (илиразведения)Оствальда.
В случае, когда степень диссоциации
электролита
1, величиной
по сравнению с 1 можно пренебречь и закон
разбавления Оствальда записать в
упрощенном виде:
Kд,
с
2С.
Константа
диссоциации не зависит от концентрации
электролита и при постоянной температуре
Kд,с
= const, а
степень диссоциации слабого электролита
тем больше, чем ниже концентрация, то
есть чем больше разбавлен раствор. При
введении в равновесный раствор ионов
Н+
или А
произойдет сдвиг равновесия диссоциации
влево в соответствии с принципом
Ле-Шателье и установится новое равновесие
с другими концентрациями [H+],
[А]
и [HА]недисс,
но с той же Kд,с.
Константа диссоциации будет меняться
только при варьировании температуры.
Многоосновные кислоты и многокислотные
основания диссоциируют ступенчато.
Например, процесс диссоциации щавелевой
кислоты протекает следующим образом:
Это
выражение носит название закона
разбавления (илиразведения)Оствальда.
В случае, когда степень диссоциации
электролита
1, величиной
по сравнению с 1 можно пренебречь и закон
разбавления Оствальда записать в
упрощенном виде:
Kд,
с
2С.
Константа
диссоциации не зависит от концентрации
электролита и при постоянной температуре
Kд,с
= const, а
степень диссоциации слабого электролита
тем больше, чем ниже концентрация, то
есть чем больше разбавлен раствор. При
введении в равновесный раствор ионов
Н+
или А
произойдет сдвиг равновесия диссоциации
влево в соответствии с принципом
Ле-Шателье и установится новое равновесие
с другими концентрациями [H+],
[А]
и [HА]недисс,
но с той же Kд,с.
Константа диссоциации будет меняться
только при варьировании температуры.
Многоосновные кислоты и многокислотные
основания диссоциируют ступенчато.
Например, процесс диссоциации щавелевой
кислоты протекает следующим образом:
