
Топливные химические источники тока
.doc
Федеральное агентство по образованию РФ
Государственное Образовательное Учреждение
Высшего Профессионального Образования
Уфимский Государственный Авиационный Технический Университет
Кафедра общей химии
Контрольная самостоятельная работа студента
На тему: Топливные химические источники тока
Выполнил: Кадыров И. Р.
Проверил: Попов В. И.
Уфа 2009
Содержание Топливные химические источники тока……………………………………………………3
История развития топливных химических источников тока……………………………...3
Устройство и процессы в источнике тока…………………………………………………..5
Электроды в ТЭ……………………………………………………………………………….8 Катализаторы ТЭ……………………………………………………………………………...9
Виды топливных элементов……………………………………………………………….....10
Элементы с газообразным топливом………………………………………………………...11
Элементы с жидким топливом…………………………………………………………….....11
Элементы с твердым топливом………………………………………………………………12
Элементы с непрерывным возобновлением реагентов (регенеративный топливный элемент)………………………………………………………………………………………...14
Окислительно-восстановительный элемен…...……………………………………………...15
Термодинамика………………………………………………………………………………...15 Элемент Бэкона………………………………………………………………………………...18
Перспективы развития топливных химических источников тока………………………….20
Топливные химические источники тока
Топливный элемент- это гальванический элемент, в котором химическая энергия топлива преобразуется электрохимическим путем в электрическую энергию. Топливо и окислитель при этом непрерывно и раздельно подводятся к ячейке, в которой они реагируют на двух электродах.
Топливный элемент это первичный элемент, который в принципе производит ток, пока к нему подводятся активные вещества. В отличие от этого обычные первичные элементы получают электрическую энергию из “активной массы” электродных пластин и поэтому обладают ограниченной емкостью. То же самое можно сказать и обо всех вторичных элементах, так называемых аккумуляторах, которые после заряда активной массы должна снова заряжаться от внешнего источника тока.
К топливам, которые можно использовать для подобных элементов, относятся наряду с природными видами топлива такими, как уголь и углеводороды, также и вещества, которые могут быть из них получены простым путем: спирты, альдегиды, окись углерода и водород.
Эти новые источники энергии обладают рядом преимуществ. К ним относятся: относительно малые удельный объем и вес, отсутствие движущихся частей, бесшумность и хорошая способность к перегрузке. Коэффициент полезного действия лежит между 30 и 75% и растет с уменьшением нагрузки в противоположность теплосиловым установкам и двигателям внутреннего сгорания. Наряду со многими нерешенными технологическими проблемами существенный недостаток таких элементов состоит в том, что дешевые топлива, например уголь или природный газ, особенно трудно преобразуются электрохимическим путем.
Преимущество этих новых элементов делают их пригодными для ряда интересных областей применения, например в качестве стационарных и транспортабельных источников энергии, аккумуляторов энергии, а также для экономии электроэнергии при техническом электролизе.
История развития топливных химических источников тока
Эксперимент Грове в 1839 году можно рассматривать как первый опыт электрохимического взаимодействия топлива с кислородом в гальваническом элементе. Грове проводил электролиз серной кислоты с помощью двух платиновых электродов и обнаружил, что выделяющиеся водород и кислород элетрохимическии активны и что на электродах устанавливаются стационарное напряжение=1.Однако плотность тока, снимаемого элемента, была так мала, что он не мог иметь никакого технического значения. Первым толчком для развития экономических топливных элементов послужила идея Оствальда (1894 г) о замене тепловых электростанции, топливными элементами, в которых уголь электрохимическии реагирует с кислородом с образованием CO2 .При этом за счет устранения ограничения цикла Карно низкий к.п.д. преобразования энергии сжигания угля в электрическую (он достигал в то время только 10%) должен существенно увиличиться и поэтому будут лучше преобразоваться сырьевые запасы угля.В дальнейшем осуществлением этой идеи трудились Нернст, Габер, Баур и Прайса прямого преобразования угля с воздухом при температуре 11000 .
На рисунке угольно-кислородный элемент с твердым электролитом Баура и Прайса. Напряжение 0,7 В при нагрузке 150мАчерез рабочее сопротивление W-около 0,4 В, 1-магнетит, 2-твердый электролит, 3-угольный порошок, 4-угольный стержень.
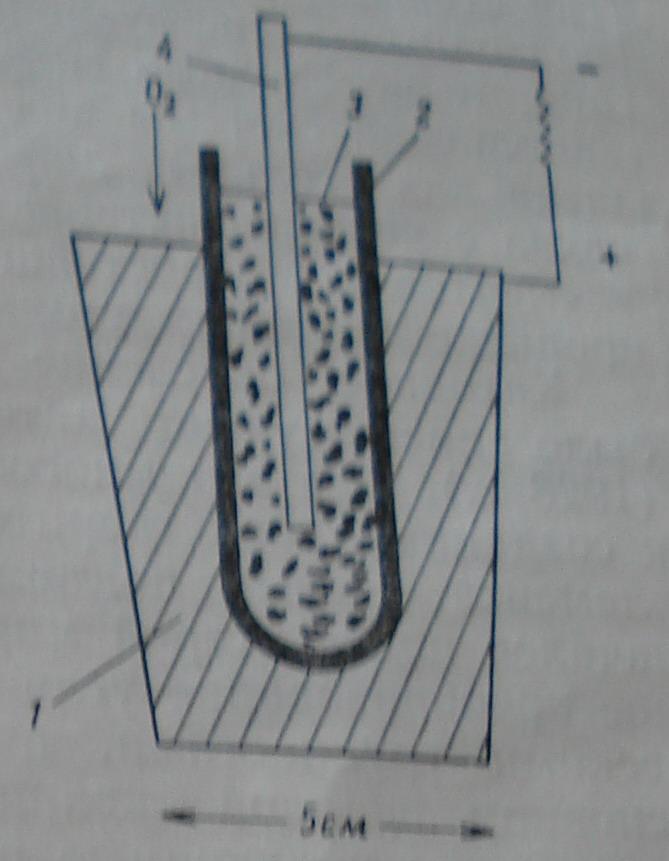
Вследствие инертности угля потребовались высокие температуры. Однако полученные плотности тока были умеренными, но самым большим недостатком был коротки срок службы этого элемента. Наряду с элементами с твердым электролитом многими исследователями, в частности Бауром и Тоблером (1933 г), были изучены различные системы с расплавами солей и водными электролитами. В качестве топлива, кроме угля, применялись водород, окись углерода, ацетилен, светильный газ, газ и нефть. В качестве перспективной авторами производится элемент, работающий при температуре окружающей среды на щелочном электролите и металлическим электродом (для газообразного или жидкого топлива ), потенциал которого лежит вблизи водородного потенциала. Это положение действительно и сегодня.
Хорошие газовые электроды были известны уже до 1933 г. Шмид разработал в 1623 г. Так называемый диффузионный электрод для водорода. Этот электрод был выполнен из угля с тонкопористым поверхностным слоем из благородного металла. Основная идея заключалось в том, что газ подводится у одной стороне пластинчатого или трубчатого электрода, а другая его сторона находиться в контакте с электролитом. Если газ подводиться к диффузионному электроду без избыточного давления, то необходимо гидрофобизировать электрод во избежание заполнения системы под электролитом .Это проблема была решена для угольных диффузионных электродов уже 1933году в связи с усовершенствованием при создании воздушно-цинковых элементов. Простейший способ гидрофобизации состоит в пропитке пористых угольных электродов парафином.
Катодное окисление растворенных в электролите топлива было ранее изучено Тайтельбаумом (1910 г) и Мюллером (1928 г).Все эти многосторонние усилия, однако, не привели к созданию удовлетворительного с точки зрения элемента. Новый подъем исследования элементов начался после второй мировой войны. Было осознано, что прямое преобразование угля связано со слишком большими техническими трудностями , и поэтому исследователи занялись в основном группой “непрямых” топливных элементов, которые потребляют получаемые из вещества, такие, как водород, окись углерода и спирты. Электрохимические реакции этих веществ протекают с приемлемыми скоростями (плотность тока >10 ма/см2 ) уже при комнатной температуре.
Применение активных топлив, а также новые знания в области электродной кинетики и гетерогенного катализа привели в последние 10 лет к созданию элементов, представляющих технически интерес. Большинство этих элементов объединяет то, что они прямо или косвенно потребляют водород; это означает, что потенциалопределяющая реакция на топливном электроде заключается в ионизации атомарного водорода.
Устройство и процессы в источнике тока
В топливных
элементах содержащаяся в топливе энергия
при электрохимическом производстве
энергии непосредственно преобразуются
в электрическую. Исключая окольный,
связанный с потерями путь через тепловую
и механическую энергии. Свободная
энергия реакции окисления топлива
![]() G=
G=![]() H-T
H-T![]() S
определяет э.д.с. элемента Eo=
S
определяет э.д.с. элемента Eo=![]() .
.
Устройство H2-O2 элемента
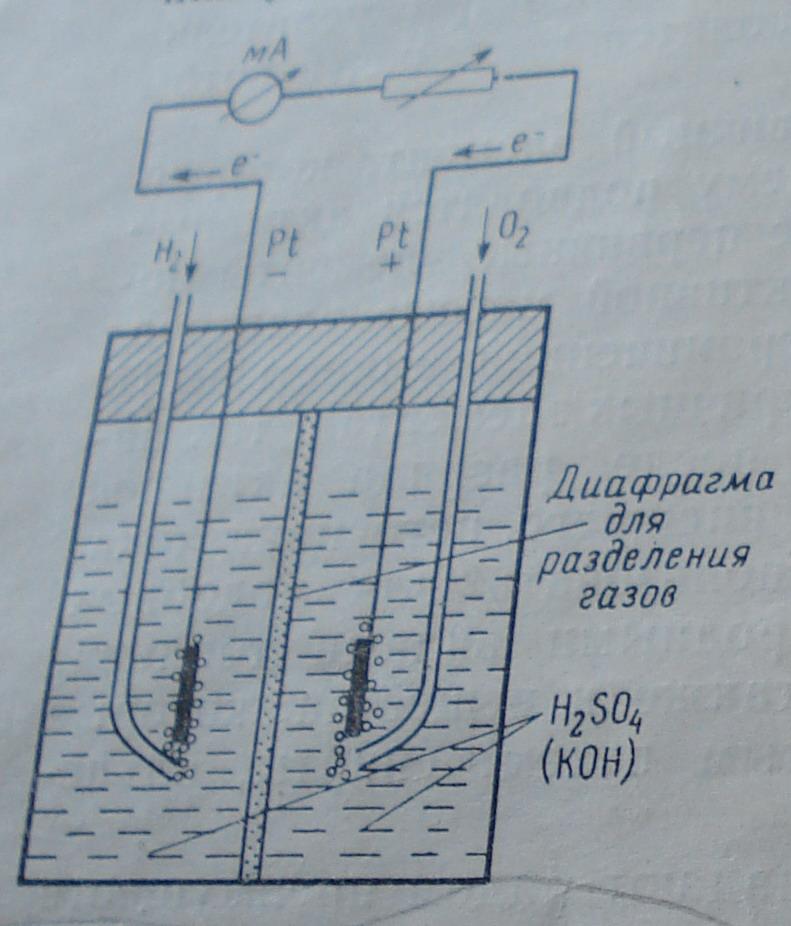
Топливо и окислитель подводятся к соответствующим электродам. Благодаря электрохимической активности реагентов на них устанавливается определенный потенциал: топливный электрод становится отрицательным, а кислородный электрод- положительным полюсом элемента. При соединении обоих полюсов через нагрузочное сопротивление реагенты электрохимически преобразуются, причем освобождающиеся на топливном электроде электроны течет через внешнюю цепь к противоположному электроду. Принцип работы топливного элемента можно пояснить на примере H2-O2 элемента. В электролит с ионной проводимостью (например, серная кислота или калийная щелочь) погружены два платиновых электрода. Один электрод омывается водородом(отрицательный полюс), другой- кислородом (положительный полюс). Между двумя полюсами элемента возникает стационарное напряжение 0,9-1,2В.При соединении обоих полюсов через нагрузочное сопротивление на каждую электрохимически прореагировавшую молекулу водорода от отрицательного полюса элемента текут два электрона к положительному полюсу, на которую электроны реагируют с адсорбированным кислородом. В отличие от обычного сгорания водорода и кислорода электрохимическое взаимодействие (“холодное горение”) происходит на двух отделенных друг от друга местах реакции. В H2-O2 – элементе с кислым электролитом под действием каталитических свойств электрода молекула H2 на поверхности электрода распадается на два атома. Атомы переходят в раствор в виде протонов, оставляя два электрона, которые текут через амперметр и нагрузочное сопротивление к положительному полюсу. На положительном полюсе кислород реагирует с протонами электролита и с двумя электронами с образованием воды.

Отрицательный
полюс: 2HАДС![]() 2H++2e
2H++2e
Положительный
полюс:
![]() O2+2H++2e-
O2+2H++2e-![]() H2O
H2O
Эти формулы отображают идеальный суммарный процесс электрохимического восстановления кислорода. Фактически реакция усложняется с образованием H2O2 и окислов металла кислородного электрода. Потребляемые на кислородном электроде ионы H+ вновь образуется на водородном электроде.
Суммарная реакция
:
![]() O2+
+2e-
O2+
+2e-![]() H2O
H2O
Электрохимическая реакция H2 и O2 обратна электролизу воды, при котором благодаря приложению напряжения от внешнего источника тока вызывается процесс разложения воды на H2 и O2. Как и в любом элементе для преобразования химической энергии в электрическую, э.д.с. H2 - O2 элемента определяется свободной энергией реакции. При низких температурах (<150о) теоретическое значение э.д.с. не достигается, так как ионизация кислорода протекает через промежуточную стадию образования H2O2.
Э.д.с. топливных элементов, как правило, имеет порядок 1 В. Отдача по току электрохимического процесса зависит от количества зарядов, участвующих в элементарном акте реакции. При взаимодействии 1 моль водорода с 0,5 моль кислорода получается 2 фарадей, или 53,6 А*ч.
Реакции с несколькими ступенями разряда в зависимости от рабочей температуры и от типа электролита могут протекать полностью или останавливаться на промежуточных продуктах; в последнем случае получается меньший ток, чем ожидаемый теоретически. Решающим для отдачи энергии является скорость реакции в элементе, которая определяется не только обратимостью процесса разряда, но также и транспортом вещества к зоне реакции и от неё. Транспорт вещества усложняется ещё и потому, что зона реакции часто находится внутри разветвленной мелкопористой структуры катализатора. В ходе реакции, особенно в случае двухфазных систем (электрод-топливо, растворенное в электролите), в порах легко образуются значительные градиенты концентрации. Если продукты реакции плохо растворяются в электролите, то это приводит к их осаждению и к закупорке пор электрода.
В пористых диффузионных электродах для электрохимического использования газообразных реагентов (трехфазная система: электрод-электролит-газ ) транспорт к зоне реакции (трехфазной зоне), даже при больших температурах (>100ма/см2) вполне обеспечен. В этом случае важную роль играет отвод инертных составляющих и газообразных продуктов реакции.
Выбор каталитически активного материала электрода является решающим для достижения высоких плотностей тока. Состав электролита может ускорить или замедлить электродные реакции.
Электроды в ТЭ
Работа ТЭ во многом зависит от используемых электродов. Не всякий материал пригоден для их изготовления. Ускорить реакции в ТЭ можно только с помощью электродов, обладающих высокими каталитическими свойствами. Электроды должны обладать высокой электронной проводимостью, способностью адсорбировать и в той или иной степени активировать газ, химической инертностью по отношению к горючему и окислителю (а также электролиту). Материалом для таких электродов могут служить специально обработанные никель, кобальт, металлы группы платины, угли с сильно развитой поверхностью, на которую наносят катализаторы, - мелкодисперсные порошки платины, родия и т.п. На таких электродах уже при температуре 298-398К удается достичь высоких скоростей восстановления кислорода и окисления таких видов топлива, как водород, гидразин (N2H4) и метанол (CH3OH), при относительно невысоких поляризациях. Оказалось, что некоторые высокоактивные электроды весьма чувствительны к каталитическим ядам, поэтому особенно необходима предварительная очистка топлива.
Различают три типа устройства трехфазной границы (газ – электрод - электролит): газодиффузионный электрод, в который газ «вдавливается» под высоким давлением; гидрофобизированный пористый диффузионный электрод, к которому активный газ подводится под атмосферным давлением; активный газ или газовая смесь находятся в контакте с пористым слоем катализатора, который связан с губкообразным носителем электролита или с твердым электролитом.
Одной из проблем, встречающихся при разработке электродов с газообразными реагентами, является создание трехфазной зоны. Газовый электрод должен контактировать с раствором электролита, но не полностью затопляться последним. Но электрод должен иметь контакт с газообразным реагентом, который не должен поступать в межэлектродное пространство. Решение этой проблемы обычно находят на основе законов капиллярного равновесия. В пористом электроде, в который подается газ, распределение пор между электролитом и газом определяется соотношением давления газа и капиллярного давления жидкости.
Все поры, у которых капиллярное давление равно или больше давления газа, будут затоплены раствором электролита. Поры, у которых капиллярное давление меньше давления газа, будут заняты газом. Для создания границы между газом и электролитом внутри электрода обычно используют электроды с различными размерами пор или различными углами смачивания. Рабочая зона в электроде находится в районе мало- и крупнопористых слоев. Различный угол смачивания электролитом обеспечивается применением гидрофобизации слоя электрода, обращенного к газу. В качестве гидрофобизаторов, т.е. веществ, не смачиваемых раствором электролита, обычно используют фторпласт. Если в качестве электролита применяется капиллярная или ионообменная мембрана, необходимость в двухслойных электродах отпадает, но возникает задача обеспечения хорошего контакта между электродом и электролитом.
Катализаторы ТЭ
Для создания совершенных электродов очень важна их каталитическая активность. В частности, для получения обратимого водородного потенциала пригодны только металлы, которые могут хемосорбировать водород. Этой способностью обладают металлы с незаполненным d-уровнем электронной оболочки, следовательно, прежде всего переходные металлы VIII группы.
По каталитической активности окисления водорода в растворе NaOH при температуре 300 К металлы VIII и IA групп можно расположить в следующий ряд:
Au<Ag<Cu<Fe<Co<Ni<Pd<Pt<Ir<Rh<Os<Ru
При обычной температуре на платиновых металлах, в особенности в тонко раздробленной форме (платиновая чернь, палладиевая чернь), обратимый водородный потенциал устанавливается во всей области значений pH, а в щелочных растворах – также на специально обработанном никеле (никель Ренея). При повышенных температурах (323 К) достаточна уже активность простого никеля или железа.
Для всех указанных систем металл-водород общим является кинетическое торможение достижения равновесия при температуре ниже 473 К. Однозначная причина этого заключается в замедленном переходе водорода через металлическую поверхность. Давно известный способ улучшения заключается в покрытии поверхности компактного палладиевого образца палладиевой чернью, которая ускоряет поглощение водорода. Электрохимическое поведение кислорода в водных растворах на электродах из платины, серебра или угле значительно сложнее, чем других газов, например, водорода. Потенциал покоя кислородного электрода во всей области значений pH устанавливается очень медленно и плохо воспроизводим. Как правило, он устанавливается более чем на 100мВ ниже теоретического кислородного потенциала. Причина такого поведения заключается в большой энергии связи кислородной молекулы. Разрушить молекулярную связь при температуре 323 К удается лишь окольным путем через образования перекиси водорода Н2О2. Протекание реакции еще больше усложняется из-за появления радикалов НО2- и ОН-. Катализаторы для выделения и восстановления кислорода изучены еще не так основательно, как соответствующие катализаторы для водорода. Во всей области рН пригодны металлы платиновой группы и хром. В щелочах оказываются пригодными наряду с серебром и различными сортами угля также железо, кобальт и никель. Использование серебра и платины объясняется хорошими каталитическими свойствами этих металлов в отношении разложения перекиси водорода.
По каталитической активности восстановления кислорода предлагают следующую последовательность:
графит<Cu<Fe<Pt<Ag<уголь<Ni
Металл-катализатор целесообразно использовать нанесенным в тонкодисперсном виде на какой-нибудь пористый носитель (например, уголь).
В высокотемпературных ТЭ для окисления СО применяется двухскелетный электрод на основе вольфрама или молибдена. В ТЭ с расплавленными электролитами материалами для электродов служат металлы семейства железа и платиновой группы, серебро, окись цинка, окись меди, смесь окиси никеля и лития.
Для кислородного электрода высокотемпературных ТЭ можно использовать жаростойкие материалы: никель, окись никеля, содержащая 1-2% лития, нержавеющая сталь и серебро.
К катализатору предъявляются следующие основные требования: слабая адсорбция реагента; низкая энергия активации, следствием чего является высокая плотность тока обмена; большая удельная поверхность, т.е. малый размер частиц; электронная проводимость; коррозионная стойкость; малый расход катализатора для обеспечения низкой стоимости при высокой эффективности.
Для катализаторного материала большинство из этих материалов являются и частично противоречивыми.
Виды топливных элементов
Топливные элементы классифицируются по агрегатному состоянию реагирующих веществ, так как конструктивные признаки и принцип действия при таком делении различаются особенно четко. Затем следует классификация по типы электролита.
К трем основным группам элементов для газообразного, жидкого и твердого топлива добавлено описание некоторых специальных типов топливных элементов и комбинации.
Элементы с газообразным топливом
Этот тип элементов
можно разделить по типу окислителя на
газообразный окислитель (H2+![]() O2
O2
![]() H2O)
и окислитель в жидкой форме (H2+H2O2
H2O)
и окислитель в жидкой форме (H2+H2O2
![]() H2O)
H2O)
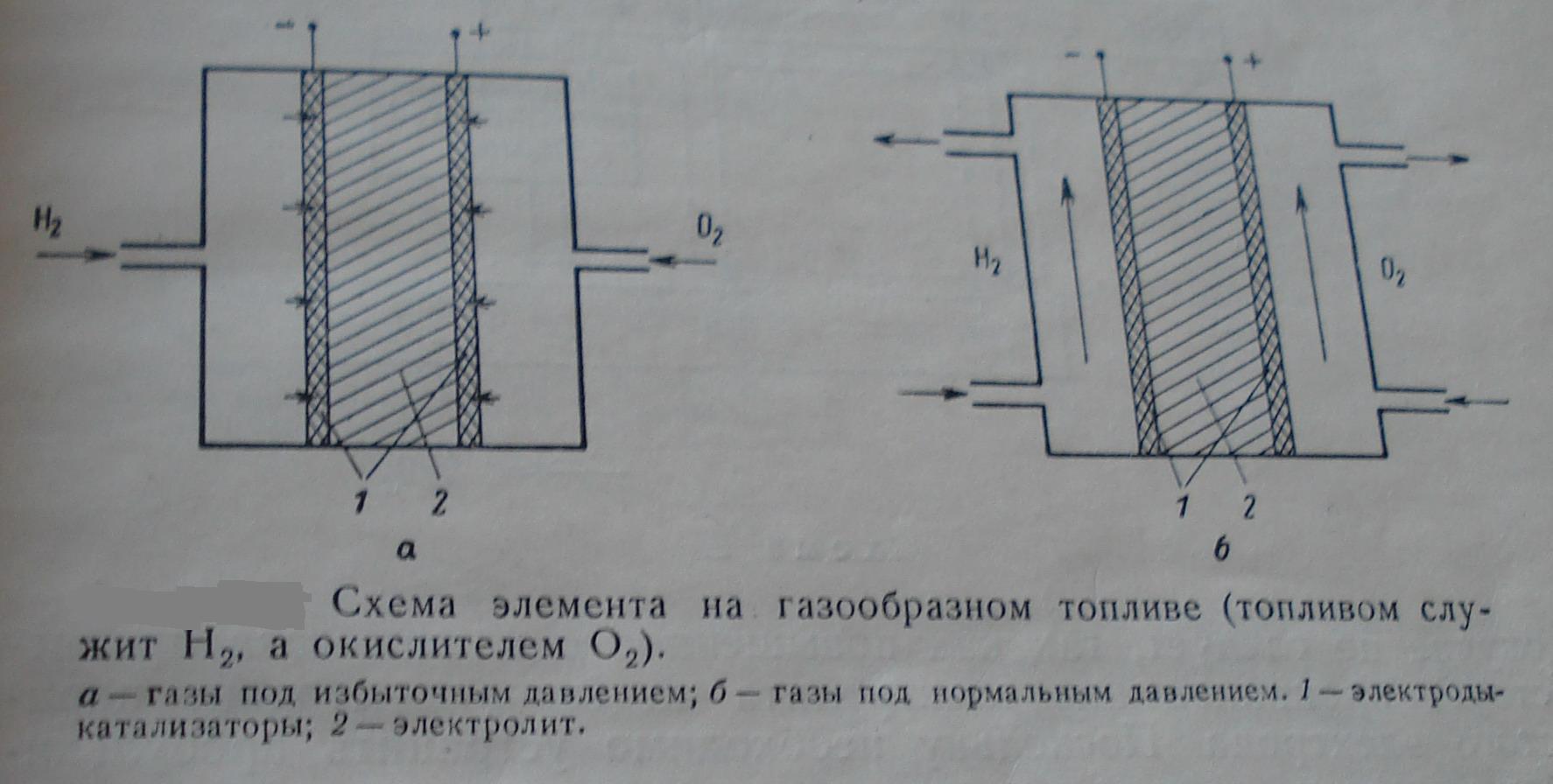
Элементы с жидким топливом
Например:
CH3OH+3H2O2![]() CO2+5H2O
CO2+5H2O
Жидкое топливо, как и жидкий окислитель (H2O2) , преимущественно применяется растворенным в электролите. Если в составе кислородного электрода содержится металл, который катализируется также и реакцию топлива, то необходимо отделить оба электролитных пространств друг от друга диафрагмой. Окислитель в этом случае можно использовать или в газообразном виде, или в растворенным в электролите.
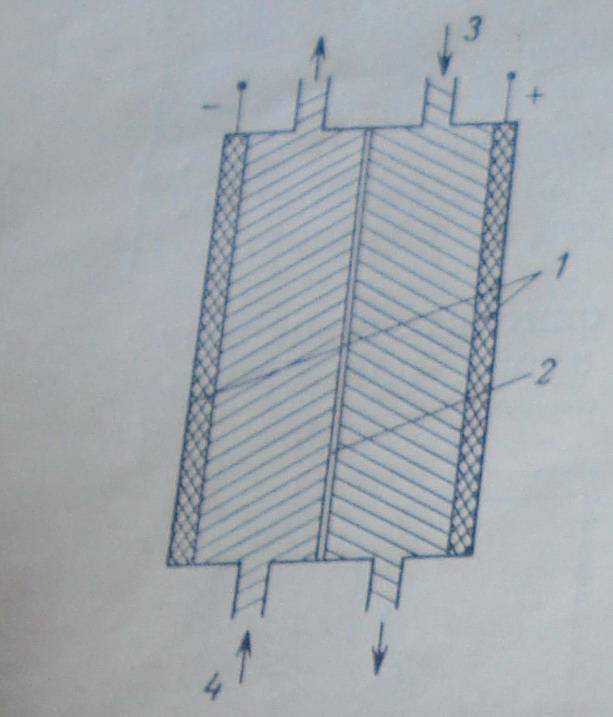
Схема элемента с жидкими реагентами
Окислитель растворен в электролите (в качестве топлива используется спирт).
1- электроды, 2-мембрана, 3-электролит+ H2O2, 7-электролит+топливо.
Элементы с твердым топливом
Пример:
С2+O2![]() CO2
. Твердое топливо (уголь или металл)
одновременно служит электродом.
Электрохимическое окисление металла,
например цинка или алюминия, осуществимо
при комнатной температуре и в водном
электролите. В данном случае расходуемые
электроды должны периодически заменяться
новыми.
CO2
. Твердое топливо (уголь или металл)
одновременно служит электродом.
Электрохимическое окисление металла,
например цинка или алюминия, осуществимо
при комнатной температуре и в водном
электролите. В данном случае расходуемые
электроды должны периодически заменяться
новыми.
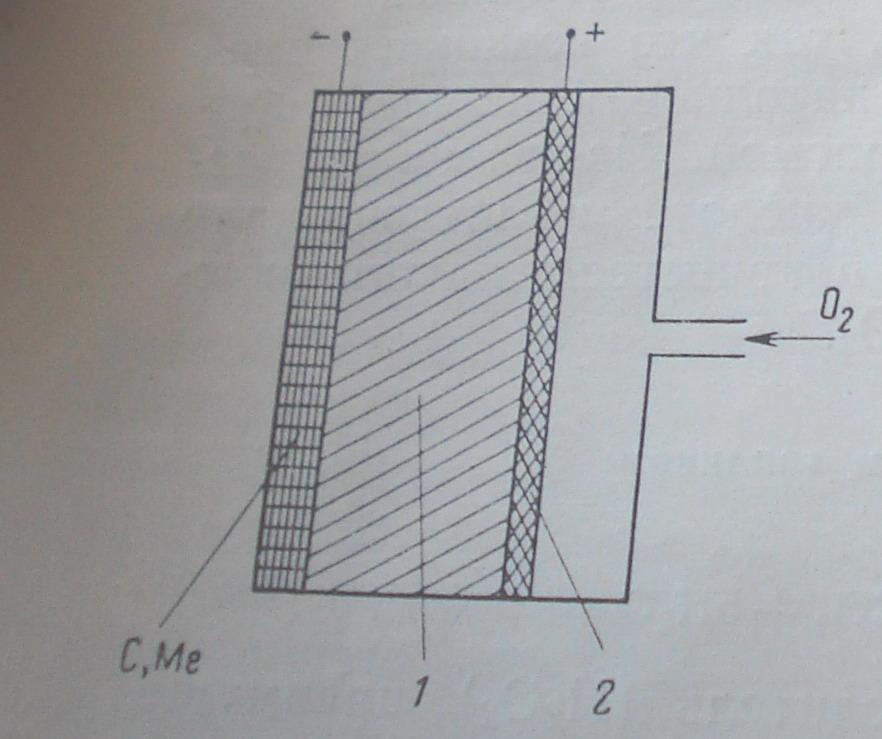
Элемент с твердым топливом
1-электролит, 2-кислородный электрод-катализатор
Особое положение занимает амальгамно –кислородный элемент. По вертикальной металлической пластине стекает тонкая пленка амальгамы. Между пленкой амальгамы и пористым кислородным диффузионным электродам в противоположном направлении течет свежая вода. К использованной ртути добавляется топливо, например, натрий, а образующаяся щелочь отводится.
Схема амальгамно –кислородного элемента Егера для электрохимического преобразования щелочных металлов (натрия). 1-амальгаматор, 2-теплообменник, 3-металлическии анод с пленкой амальгамы, 4-пористый диффузионный кислородный электрод, 5-насос.

Элементы с непрерывным возобновлением реагентов
(регенеративный топливный элемент)
Под регенеративным топливным элементом понимается элемент, в котором реагенты непрерывно восстанавливаются из образовавшихся в ходе реакции продуктов. Этот вид топливных элементов отличается от других тем, что он дополнительно скомбинирован с источником энергии для разложения продуктов реакции. Возможные источники энергии: тепло, свет, излучение, химическая энергия.
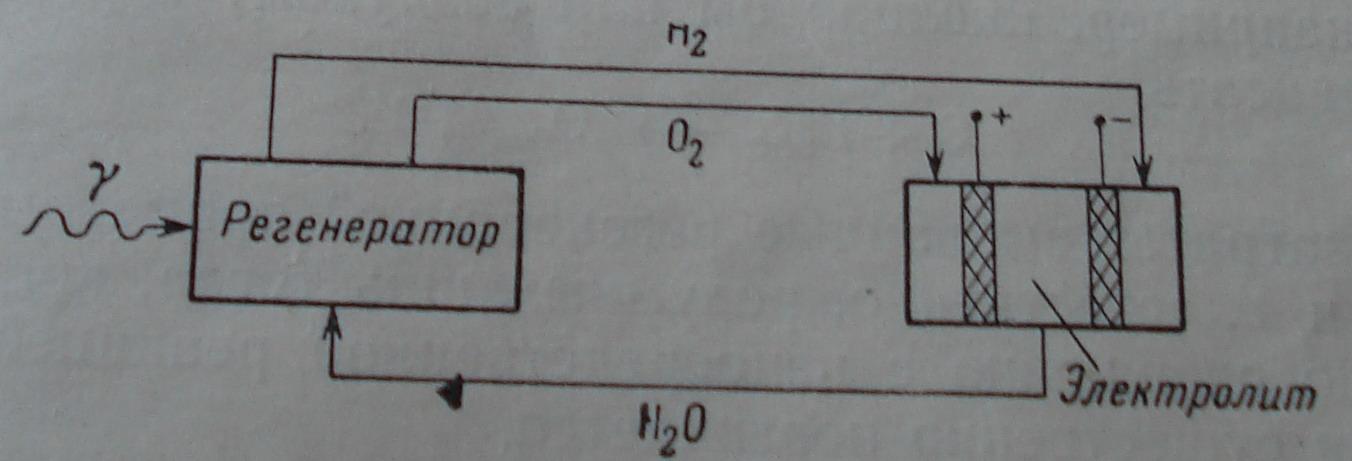
Реагенты H2-O2
элемента
могут быть восстановлены из продукта
реакции- воды под воздействием излучения
(нейтронного,
![]() -излучения,
электронного) и снова подводиться к
элементу. H2+
-излучения,
электронного) и снова подводиться к
элементу. H2+![]() O2
O2![]()
![]()
![]() H2O.
H2O.
Регенерация может быть осуществлена также химическим путем. Этот тип элемента называется окислительно-восстановительным элементом.
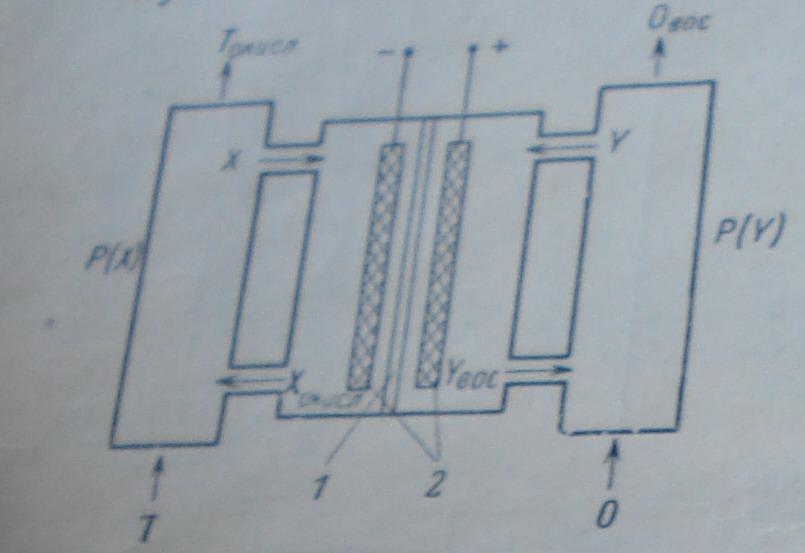
Схема редокс-элемента
Т- первичное топливо, О – первичный окислитель, X.Y – электрохимическии активные вещества, P(X) и P(Y) – регенераторы. 1- мембрана, 2- электрод- катализатор.
Термодинамика
В случае прямого преобразования химической энергии в электрическую с помощью электрохимических топливных элементов можно достичь к.п.д. около 100% и более. Этот способ относится к “высокоэффективным способам преобразования энергии”
Максимальная энергия химического превращения вещества, получаемая в виде работы, соответствует свободной энергии реакции
![]() =
=![]() -T
-T![]()
![]() =-nFEo
Eo
=
=-nFEo
Eo
=
![]()
![]()
Из этих уравнении
следует, что э.д.с. увеличивается с ростом
температуры, если энтропия продуктов
реакции больше, чем у исходных веществ.
Это означает, что в зависимости от знака
![]() можно получить электрохимическим путем
больше так и меньше энергии, чем это
соответствует максимальному тепловому
эффекту реакции окисления топлива.
можно получить электрохимическим путем
больше так и меньше энергии, чем это
соответствует максимальному тепловому
эффекту реакции окисления топлива.
