шпоры по общей химии
.doc
|
1.предмет химия. Значение химии. Химия наука которая изучает вещества и процессы их превращ, сопровожд изменением состава и строения веществ. Значения химии: 1) создание материалов с заданными свойствами.(этинол). 2)создание новых хим технологий( в медецине лекарств, биохимия). 3) методы защиты от коррозии(нефте- и трубопроводы). 4) в быту использов полимеров. 5) создание синтетич материалов. Основные понятия химии: химич элемент- вид атомов с одинаковым зарядом ядер . атом- наим частица хим элемента. Сохраняющ все его хим св-ва. Молекула- наим частица индив вещества способная к существованию, характер основн хим и физ св-ва. Молекула сост из одинаковых или разноатомных . одноатомные: He; двухатомные : O2, H2, HJ; многоатомные:H2O. Вещества: простые (атомы один в молекул), сложн (атомы разные в молекуле). Количественные вещества: число структурных элементов в системе(число атомов).моль- количество вещества системы, содержащее столько структурных элементов, сколько атомов содержится в 0.012 кг. Молярная масса- масса одного моля веществ, единица измерения г/моль или кг/моль. Атомная масса- молярная масса атома отнесена 1/12 молярной массе С. Молекул масса- молярная масса соед отнесенная к 1\12 молярной массе С. |
2.основные законы химии. Закон постоянства состава: каждое молекулярное химически чистое соединение всегда имеет один и тот же количественный состав независимо от способа его получения. Соединения переменного состава –бертоллиды, соединения постоянного состава- дальтониды. Закон эквивалентов: все вещества реагируют в эквивалентных отношениях. Эквивалентом называют реальную или условную частицу вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или обменных реакциях. Моль эквивалентов одного вещества реагирует с одним молем эквивалентов другого вещества, или массы участвующих в реакции веществ пропорциональны молярным массам их эквивалентов. Закон кратных отношений :если два элемента образуют между собой несколько различных соединений, то на одну и ту же массу одного из них приходятся простые целые числа. Закон сохранения массы и энергии: в изолированной системе сумма масс и энергии постоянно, где опред как E=mc2(уравн Энштейна). Закон Авагадро:в равных объемах в любых газах или паров при одних и тех же физ условиях содержится одинаковое число молекул. |
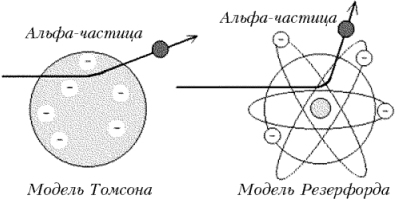
3.первые модели строения атома. Модели Морозова, Томсона, Резерфорда, их характеристики и недостатки. Модель Морозова:
Модель Томсона: атом электронейтральная система, шарообразной формы, которая заряжена положительно. Модель Резерфорда: он предложил ядерную планетарную модель атома, состоящего из тяжелого ядра, вокруг которого двигаются по орбитам электроны, подобно планетам солнечной системы. Однако, как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
|
4.теория Бора, квантовая модель строения атома, двойственная природа электрона. Планк: вещества поглощают и испускают энергию дискретными порциями, названными им квантами. Энергия кванта пропорциональна частоте излучения: E=hv; Бор используя модель Резерфорда и теорию Планка, предложил модель строения атома водорода, согласно которой электроны двигаются вокруг ядра не по любым. А лишь по разрешенным орбитам, на которых электрон обладает определенными энергиями. При переходе электрона с одной орбиты на другую атом поглощает или испускает энергию в виде квантов. Каждая орбита имеет номер n(1,2,3,4…), который назвали главным квантовым числом. Бор вычислил радиусы орбит. Радиус первой орбиты был 5,29*10-13м, радиус других орбит был равен: rn=n2(5,29*10-13). Энергия электрона зависела от значения главного квантового числа n: En=-13,6(1/n2). Отрицательный знак энергии означает устойчивость системы. Которая тем более устойчива, чем ниже(чем более отрицательна) ее энергия. Атом водорода обладает минимальной энергией, когда электрон находится на первой орбите (n=1).такое сост- основное, при переходе электрона на более высокие орбиты атом становится возбужденным.теория Бора позволила рассчитать энергию электронов, значения квантов энергии, испускаемых при переходе элевтрона с одного уровня на другой. Теория Бора оказалась непригодна для многоэлектронных атомов. |
|
5.квантовые числа: главное, орбитальное, магнитное, спиновое. Значения, которые они могут принимать. Их физический смысл. Главное квантовое число n определяет энергию и размеры электронных орбиталей. Главное квантовое число принимает значения 1,2,3,4,…. И характеризует оболочку или энергетический уровень. Чем больше n, тем выше энергия. Оболочки имеют буквенные обозначения: K(n=1), L(2),M(3),N(4),Q(5),переходы электронов с одной оболочки(уровня) на другую сопровождаются выделением квантов энергии, которые могут проявиться в виде линий спектров. Орбитальное квантовое число l определяет форму атомной орбитали. Электронные оболочки расщеплены на подоболочки, поэтому орбитальное квантовое число также характеризует энергетические подуровни в электронной оболочке атома. Орбитальные кв числа принимают целочисленные значения от 0 до (n-1). Обознач: s,p,d,f. электроны с орбитальным кв числом 0 называются s-электронами. Орбитали и соответственно Эл облака имеют сферическую форму. Электроны с орбитальным кв числом 1 называются p-электронами. Орбитали и соответственно Эл облака имеют форму, напоминающую гантель. Электроны с орбитальным кв числом 2 называют d-электронаи. Орбитали имеют более сложную форму(скрещение двух гантель). Орбитали с кв число 3, носят название f-элктроны. Форма- скрещение 3 гантель. Магнитное кв числоml характеризует ориентацию орбитали в пространстве. Магнитное кв число принимает целочисленные значения от –l до +l, включая ноль. Спиновое кв число ms, т.е. каждый электрон характеризуется собственным мех моментом движения, который получил название спина. Имеет значения ±1/2.
|
6.электронная конфигурация атома. Правила записи распред электронов в атоме: принцип минимальной энергии, принцип Паули, правило Клечковского, правило Гунда. Обычно Эл конфигурвция приводится для основного сост атома. В случае, если один или несколько эль находятся в возбужденном сост, то и Эл конфигурация будет характеризовать возбужденное сост атома. При записи Эл конфигурации указывают цифрами главное кв число, буквами подоболочки, а степень буквенных обозначений подоболочек обозначает число Эл в данной подоболочке. Принцип минимальной энергии- эл в основном сост заполняют орбитали в порядке повышения уровня энергии орбиталей. Первыми заполняются орбитали с минимальными уровнями энергии. В многоэлектронных атомах электроны испытывают не только притяжение ядер, но и оттлкивание Эл, находящихся ближе к ядру и экранирующих ядро от более далеко распложенных Эл. Поэтому идет усложнение. Правило Клечковского увеличение энергии и соотв-но заполнение орбиталей происходит в порядке возрастания суммы кв чисел n+l, а при равной сумме n+l в порядке возрастания числа n. Соответственно этому правилу подоболочки выстраиваются в следующей последовательности: 1s<2s<3p<4s=3d<4p<5s=4d<5p<6s=5d=4f<6p<7s и т.д. Искл сост d- и f- элементы с полностью и наполовину заполненными подоболочками. Принцип запретапаули. В атоме не может быть двух электронов, обладающих одинаковым набором кв чисел n,l,ml,ms. Отсюда следует, что на каждой орбитали может быть не более 2 эл. Правило Гунда. Заполнение орбиталей одной подоболочки в основном сост атома начинается одиночными Эл с одинаковыми спинами. После заполняются орбитали вторыми электронами с противоположными спинами. |
7.нормальное и возбужденное сост атома. |
8.периодическая система Д.И. Менделеева, ее структура. Свойство элементов, а также формы и свойства их соед находятся в периодической зависимости от заряда ядра их атомов. Первый период состоит из 2 элементов: водорода и гелия. В данном случае оба элемента имеют формирующие s-электроны и соответственно называются s-элементами. У элементов 2 периода формируется L-оболочка, заполняются s- и p- подоболочки. Третий период начинается с натрия и заканчивается аргоном. Хотя в 3 периоде имеется подоболочка 3d, которая остается незаполненной, в четвертом периоде начинает формироваться следующая оболочка N и период начинается с s-элемента калия. Это обусловлено тем, что энергия подуровня 4s несколько ниже, чем энергия подуровня 3d. Пятый период аналогичен четвертому периоду. Он начинается с s-элемента рубидия и заканчивается p-элементом ксеноном и включает в себя десять 4-d элементов от иттрия до кадмия. Всего 18 элементов. В шестом периоде, как и в пятом, после заполнения s-подоболочки начинается формирование d-подоболочки предвнешнего уровня у лантана. Однако у следующего элемента энергетич выгоднее формирование 4f-подоболочки по сравнению с 5d-подоболочкой. Седьмой период начинается и продолжается аналогично шестому периоду, однако формирование его не завершено. Он также имеет вставную декаду из d-элементов и 14 5f-элементов. Также сущ 8 групп, что соответствует максимальному числу электронов во внешних подоболочках. Группы делятся на главные и побочные. |
|
53.электролиз. Электролиз (от электро... и греч. lysis - разложение, растворение, распад), совокупность процессов электрохимического окисления-восстановления на погруженных в электролит электродах при прохождении через него электрического тока. Э. лежит в основе электрохимического метода лабораторного и промышленного получения различных веществ - как простых (Э. в узком смысле слова), так и сложных (электросинтез). Электролиз - совокупность электрохимических процессов, происходящих в электролите при прохождении через него постоянного электрического тока. При электролизе положительно заряженные ионы (катионы) движутся к катоду, а отрицательно заряженные ионы (анионы) - к аноду. Количество вещества, выделившегося на электродах при электролизе, определяется по закону Фарадея. |
54.законы Фарадея. Выход по току. Законы Фарадея. количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества. Массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов. F=96500Кл(А*с) E=-[G/(nF)] n – число молей эквивалентов. i=I/S Плотность тока. = 0+(0.059/n)*lnCM m = MэIt/
|
55. реальные электрохимические процессы. Поляризация. Перенапряжение. Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Электрохимические процессы можно разделить на две основные группы: 1) процессы превращения химической энергии в электрическую; 2) процессы превращения электрической энергии в химическую. Электродами называют проводники, имеющие электронную проводимость и находящиеся в контакте с ионным проводником. Изменение потенциала электрода при прохождении тока называю поляризацией: ∆E=Ei-Ep, где ∆E- поляризация, Ei- потенциал электрода при прохождении тока; Ep- равновесный потенциал. Так как поляризация возможна на аноде и катоде, различают анодную и катодную. Изменение потенциала при прохождении тока также называют перенапряжением. |
|
|
9.s-,p-,d-,f- элементы, их расположение в периодической системе.
|
10.сродство к электрону. Как сродство электрону изменяется у элементов по группе, по периоду. Энергетический эффект присоденения моля электронов к молю нейтральных атомов. Eср выражается в кДж/моль или в эВ. Наибольшие значения имеют галогены, кислород, сера, наименьшие и даже отрицательные значения её – элементы с электронной конфигурацией s2 (He, Be, Mg, Zn) ,с полностью или наполовину заполненными p-подоболочками (Ne, Ar, Kr, N, P, As).
|
11. энергия ионизации. Изменение энергии ионизации по группе, по периоду. Энергия необходимая для удаления одного моля электронов от одного моля атомов какого-либо элемента называется первой энергией ионизации I1.[кДж/моль, эВ]. Характеризует восстановительную способность элемента. Первая энергия определяется электронным строением элементов и её изменение имеет периодический характер. Наименьшее значение имеют щелочные элементы находящиеся в начале периода, наибольшее – благородные газы, находящиеся в конце периода. По группе сверху вниз – уменьшается, что обусловлено увеличением размеров атомов и расстояния внешних подоболочек от ядра.
|
12.электроотрицательность.Изменение электроотрицтельности по группе. По периоду. Способность атомов в соединениях притягивать к себе электроны. Возрастает по периоду, убывает по группам у элементов I, II, V, VI и VII главных подгрупп, III, IV и V – побочных подгрупп, имеет сложную зависимость у элементов III главной подгруппы(минимум у Al), возрастает с увеличением номера периода у элементов VII – VIII побочных подгрупп. Наименьшие значения s-элементы I подгруппы, наибольшие значения – p-элементы VI и VII групп.Электроотрицательность=
|
|
13. атомные радиусы. Орбитальный радиус, эффективный радиус. Как изменяется радиус атома по группе, по периоду. Атомы не имеют строго опред границ. Поэтому абсолютное значение радиуса атома опред не возможно. Можно условно принять за радиус атома теоретич рассчитанное знач расстояния от ядра до наиболее удаленного от него максимума Эл плотности или половину расстояния между центрами двух смежных атомов в кристаллах. Наблюдается периодичность изменения атомных радиусов, особенно у s-, p-элементов. У d-, f-элементов кривая изменения радиусов по периоду имеет более плавный характер. В одной и той же группе с увеличением номера периода атомные радиусы. Как правило, возрастают в связи с увеличением числа электронных оболочек. Однако увеличение заряда ядра при это показывает противоположный эффект, поэтому увелич атомных радиусов с увелич номера периода относительно невелико. |
14.химическая связь, определение, основные черты и характеристики. Химическая связь- различные виды взаимодествия обуславливающие устойчивость существующих двух или много атомных соединений.Основные черты химической связи: 1снижение общей энергией с-иы по сравнению с энергией суммарных энергией изолированных частиц из которой эта с-ма состоит. 2Перераспределение электронной плотности химической связи. Основные виды химической связи: 1Ковалентная,2Ионная3Металическая4Водородная5 Вондервальские взаимодействия.Энергия связи(Eсв). Кол-во энергии, выделяющейся при образовании химической связи, называется энергией химической связи[кДж/моль]. Для многоатомных соединений принимают среднее её значение. Чем больше Eсв тем устойчивее молекула.Длина связи(lсв). Расстояние между ядрами в соединении. Чем больше длина связи – тем меньше энергия связи.Ковалентный угол-угол между вообр. Прямыми,соединяющие центры ядер Кратность связи-число электронных пар, по средствам которых осуществляется между атомами в молекуле. Вид взаимодействия, обуславливающий устойчивое существование многоатомных соединений: молекул, ионов, кристаллических и иных веществ.Ионная. Электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Возникает в случае большой разности ЭО атомов. Не обладает направленностью и насыщеностью.
|
15. ионная связь. Механизм образования и свойства. Ионная связь- электростатичность взаимодествие + и – ионов в соедин.возник при большей разнице в электроотрц.и возм.между 1 и 2 группой и галогенами.Т.к. ионная связь не имеет сферич.х-ра не имеет направленности и ненаправленности. Li+F=Li+F- |
16.ковалентная связь. Основные черты и характеристики. Ковалентная. Связь образованная за счет обобществленной пары электронов, поставляемых по одному от каждого атома. Обладает направленностью и насыщенностью. Если связь образована двумя одинаковыми атомами, то она неполярная. Если один из атомов притягивает электроны сильнее другого, то связь полярная. Мерой полярности служит электрический момент диполя.Полярная- возникает тогда когда соединение у атомов разная электроотрицательность. Неполярная- если,ковалентная связь образуется из атома с одинаковой электроотрицательностью. Эл.плотность- смещена в сторону более электроотр. Атома.
|
|
17.обменный механизм образования ковалентной связи. Способность атома присоед или замещать определенное число других атомов с образованием хим связей называется валентностью. Согласно обменному механизму метода ВС каждый атом отдает на образование общей электронной пары по одному неспаренному электрону. Колич мерой валентности в обменном механизме метода ВС считают число неспаренных электронов у атома в основном или возбужденном сост атома. При образовании хим связи атом может переходить в возбужденное сост в результате разъедин пары электронов и переходе одного электронав свободную орбиталь той же оболочки. |
18.валентность. метод валентных связей. Валентность. Способность атома присоединять или замещать определённое число других атомов с образованием химических связей. При переходе в возбуждённое состояние, один из спаренных электронов переходит в свободную орбиталь той же оболочки. Метод валентных связей. А) химическая связь между двумя атомами возникает как результат перекрытия АО с образованием электронных пар. Б) атомы вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами(энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц.В) в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с разными спинами.Г)характеристики химической связи(энергия, длина, полярность) определяются типом перекрывающихся АО. Метод валентных связей. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
|
19. донорно-акцепторный механизм образования ковалентной связи. Донор акцептор. Ковалентная связь по донорно-акцепторному механизму образуется при взаимодействии многих атомов, ионов, молекул. Если одна из двух молекул имеет атом со свободными орбиталями, а другая- атом с парой неподеленных электрона, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи:NH3 + BF3=NH3BF3. У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора- вакантная орбиталь. При взаимодействии по донорно-акцепторному механизму атом азота отдает на связь пару электронов, а атом бора- вакантную орбиталь, в результате чего возникает ковалентная связь.
|
20. сигма-связь, пи-связь, кратные связи. Сигма-связь: связь образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов. Может возникает при перекрывании s-орбитали, s-и p-орбиталей, p-орбиталей, d-орбиталей, а также d- и s- орбиталей, d- и p-орбиталей и f-орбиталей друг с другом и другими орбиталями.она обычно охватывает 2 атома и не простирается за их пределы. Пи-связь: образованная перекрыванием АО по обе стороны линии, соед ядра атомов. Она может образовываться при перекрывании p-p орбиталей, p-d орбиталей, d-d орбиталей, а также f-p,f-d, f-f орбиталей. Связь образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется σ-связью. |
|
21.пространственная конфигурация молекул. Линейная, угловая, плоская, тригональная, пирамидальная, тетраэдрическая. Пространственная структура молекул определяется числом атомов в молекуле и направленностью химических связей. Молекула, образованная двумя атомами, линейная. Если на внешней оболочке атома имеются два неспаренных p-электрона, то при перекрывании их АО орбиталями двух других атомов образуются угловые молекулы. Два неспаренных p-электрона в атоме расположены перпендикулярно друг к другу, поэтому угол в плоских молекулах H2S близок к 900. Вследствие отталкивания электронов валентный угол между связями значительно больше и равен 104,50. Такую структуру молекулы можно объяснить, если принять, что происходит sp3-гибридизация АО кислорода при образовании воды. При этом две гибридных орбитали перекрываются орбиталями водорода. На двух орбиталях остаются неподеленных пары электронов, из-за отталкивания от которых других пар электронов угол между связями уменьшается со 1090 до 104,50. Соединение p-элементов 4 группы с водородом и галогенами имеет пирамидальную конфигурацию. Атомы этих элементов имеют на внешних оболочках три неспаренных электрона, атомные орбитали которых расположены в пространстве под углом 900. (рис) |
22.гибридизация атомных орбиталей. Типы гибридизаций. Если у атома, вступающего в хим связь имеются разные АО то в процессе образования химической связи происходит гибридизация АО, т.е. из разных АО образуются у одного атома, имеющего разные орбитали. Гибридизация может происходить и при отсутствии на АО электронов или при наличии на АО пары электронов. Если в хим связь вступает атом, у которого на внешнем энерг уровне имеются s- и p- электроны¸ то у данного атома в процессе образования связи происходит sp-гибридизация АО. Если у атома на внешней оболочке имеются один s- и 2p- электрона, то происходит sp2- гибридизация АО орбиталей этого атома. У атома, на внешней оболочке 1s- и 3p- электрона, при хим взаимодействии происходит sp3- гибрдизация этих АО. Возможны и более сложны гибридизации с участием d- и f- орбиталей.
|
23. полярность молекул. Электрический момент диполя. Если ковалентная связь образована одинаковыми атомами, то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной. Если же один атом сильнее притягивает электроны, то электронная пара смещается в сторону этого атома. В этом случае возникает полярная ковалентная связь. Мерой полярности связи служит электрический момент диполя μсв, равный произведению эффективного заряда на длину диполя. μсв=∂lд. Электрический момент диполя имеет единицу измерения кулон на метр. В качестве единицы измерения используют также внесистемную единицу измерения Дебай D, равную 3,3*10-30Кл*м. |
24.водородная связь. Водородная. образованная положительно поляризованным водородом молекулы A-H и отрицательным атомом B другой или той-же молекулы. Межмолекулярная- связь между молекулами.
|
|
25. комплексные соединения, комплексообразователи, лиганды, координационное число. Классификация. Комплексные соединения-соединения сложные с ковалентной связью образ по донорно акцепторному механизму. Комплексы бывают:1анионые 2 катионные 3 нейтральные. Комплекс:1внутренняя сфера(то,что в квадратных скобках)2внешняя сфера(то,что за квадратными скобками) K
Комплекс образоват.- атом или ион имеющий вакантн.орбиталь.Чаще всего компл. Образ. Dэлементы 6,7,1,2, группы Лиганды-атомы ионы или молекулы они координир.около комплексов образов. Одномолекулярные лиганды- лиганды одного типа молекул ионов. Разноименные лиганды- лиганды 2-х типов молекул и ионов. К-во лигандов- координационное число скординированых вокруг компл.образователей. Внешняя сфера- компенсирует заряд внутри атомные комплексы-комплексы у которых внутренняя сфера имеет отрицат.заряд.Нейтральные компл- комплексы у которого внешняя сфера отсутствует,внутренняя сфера имеет нейтр.заряд или нуливой
|
26. основные понятия термодинамики: система, работа, энергия, теплота. Система-совокупность находящихся во взаимодействии веществ или частиц, мысленно или фактически обособленная от окрудающей среды. Энергия- общая колич. Мера движения и взаим. Всех видов материй. Теплота(Q)-размерность ДЖ или количественная мера харатич.колории движ.частиц.данной с-мы или тела. Работа(А)-количественная мера направлен.движением частиц мера энерг.перед.с-мы и другой по действием сил. Параметри состояния- величины позвол. Состояния с-мы их можно непосредственно изменить:1экстенсивные пропорцион. Экстенсив. Кол-во вещества.2Интенсивные не зависим.от кол-ва вещества |
27. первый закон термодинамики. Внутренняя энергия, энтальпия. Тепловой эффект хим реакции.
Энтальпия(теплота) образования(H). Тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при 298Ки давлении 100кПа. Энтальпия простых веществ при н.у. принята равной нулю.
Внутренняя энергия- все виды энерг. С-мы,энергия частиц молекул, кроме кинетич. И потенциальной с-мы энергии как целого.
Если системе сообщ.определенное количество тепла тела могут обмен энергии и кол-ом теплоты и работы при этом энергитический уровень не исчезает не появ.неоткуда. Тепловой эффект- изменение энергии с-мы при протекании хим. Процесса,с-ма не совершает никакой другой работы,кроме работы расширения. |
28. экзо и эндотермические реакции. Изменение энергии системы при протекнии в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения, называется тепловым эффектом химической реакции. Условия стандартного состояния справедливы для любой температуры. Если в результате реакции теплота выделяется, т.е. энтальпия системы понижается, то реакция называется экзотермической. Реакция. Протекающая с поглощением теплоты, Т.Е. С ПОВЫШЕНИЕМ ЭНТАЛЬПИИ СИСТЕМЫ, НАЗЫВАЕТСЯ ЭНДОТЕРМИЧЕСКОЙ. |
|
29. закон Гесса. Закон Гесса. Тепловой эффект реакции зависит от природы и состояния исходных вещест и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учётом стехиометрических коэффициентов.Т.к. энтальпия реакции возникает вследствие разрушения одних связей и образования других, то по известным значениям энергий, можно определить энтальпию, и наоборот. Q=[Cc+(mCв)] T Cc – теплоёмкость сосуда калориметра. Cв – удельная теплоёмкость реагирующей смеси и или воды m – масса реагирующей смеси или воды.
|
30. энторопия. Второй закон термодинамики. Энергия Гиббса, определение направления протекания процесса и состояния равновесия. Энтропия. Мера неупорядоченности состояния системы. W – число микросостояний системы, термодинамическая вероятность. S = RlnW. В отличии от других термодинамических функций, можно определить не только изменение, но и абсолютное значение. При абсолютном нуле энтропия идеального кристалла равна нулю(третий закон термодинамики). Энтропия растёт по мере повышения температуры. Второй закон термодинамики для изолированных систем. В изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются увеличением энтропии. Энергия Гиббса. – критерий самопроизвольного протекания реакции.(для изобарно-изотермических процессов). G = H - TS G = Gкон - Gнач G = - RTlnKравн G = -zFE G = S, - удельная поверхностная энергия. Если G<0 то реакция может протекать самопроизвольно. Константа химического равновесия(только газы). Константа равновесия-атом произведений равн.концентрации продукта в степени хим.коэффициентов к произвольной степени стихий Пример:
Kравн = [L]l[M]m/[D]d[B]b Кр=Кравн(RT) Kр = exp(-H/(RT)+ S/R)
|
31.третий закон термодинамики (постулат Планка). При абсолютном нуле энтропия идеального кристалла равна нулю. Этот постулат получил название третьего закона термодинамики. |
32. химическое равновесие. Константа химического равновесия. Закон действия масс. При некоторой температуре энтальпийный и энтропийный факторы уравниваются, 2 противопложные тенденции уравновешивают друг друга, и вэтом случае соблюдается уравнение: G=0. Константа химического равновесия(только газы). Константа равновесия-атом произведений равн.концентрации продукта в степени хим.коэффициентов к произвольной степени стихий Пример:
Kравн = [L]l[M]m/[D]d[B]b Кр=Кравн(RT) Kр = exp(-H/(RT)+ S/R) Закон действующих масс: отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, при T=const, является величиной постоянной. |
|
33.влияние температуры на равновесие. Как следует из уравнения , константа равновесия зависти от температуры. С учетом уравнение принимает вид: lnKp=-∆H0/(RT)+∆S0/R. Если принять ∆H0 и ∆S0 независимыми от температуры, то производная логарифма константы равновесия по температуре будет равна: (dlnKp/dT)= ∆H0/(RT2). Как следует из изобары, константа равновесия экзотермической реакции уменьшается, а эндотермической реакции возрастает с повышением температуры. С увеличением абсолютного значения теплового эффекта реакции и уменьшением температуры чувствительность константы равновесия реакции к изменению температуры повышается. |
34. принцип Ле-Шателье. Обратимые и необратимые реакции. Принцип Ле Шателье. Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие. Обратимые реакции(протекающие в двух противоположных направлениях): N2+ 3H2↔2NH3; 2HI↔I2+ H2
|
35. гомогенные и гетерогенные реакции. Гомогенной реакцией называется реакция, протекающая в среде(в одной фазе). Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной. Реакционным пространством гомогенных реакций является вещества к единице объема называется концентрацией с., то скорость гомогенной реакции равна изменению концентрации любого из исходных веществ или продуктов реакции во времени. |
36. скорость химической реакции. Порядок реакции, молекулярность. Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. Гомогенная реакция протекает в одной фазе. Гетерогенные реакции протекают на границе раздела фаз. [моль*м-3/с] не учитывая газы. Vср = -Dc/Dt Vмг = dc/dt Vпр=Kпр*[A]a[B]b Vобр=Kобр*[С]с[В]d Порядок реакции. Суммы порядков реакции по реагентам. K = lnc/t Молекулярность реакции. Число молекул реагента, принимающих участие в простейшей (элементарной) стадии, называется её молекулярностью.
|
|
37. правило Вант-Гоффа. Правило Ван-Гоффа. V2 = V1T/ 10 Согласно правилу, при повышении температуры на 10Л скорость многих реакций увеличивается в 2-4 раза. Где V2 ,V1- скорости реакции при температурах 1 и 2. - коэффициент, лежащий в пределах от двух до четырех.
|
38. уравнение Аррениуса. Энергия активации. Уравнение Аррениуса. K = K0e(-Ea/RT), K – константа скорости реакции, K0 – предэкспотенциальный множитель, e – это e. Ea – энергия активации. Если при изменении температуры, концентрация реагентов остаётся постоянной то: V = V0exp[-Ea/(RT)] Ea/(2,3RT)=lgk/(1/T) Энергия активации. Энергия необходимая для перехода вещества в состояние активированного комплекса.
|
39. растворы, идеальные, реальные, истинные, коллоидные. Растворы- гомогенные смеси переменного состава. Идеальным раствором называют раствор, в котором не происходит химической реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы.
|
40. определение концентрации растворов. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Молярная концентрация вещества- отношение количества вещества, содержащегося в системе, к объему этой системы. Молярная доля вещества- отношение количества вещества данного компонента, содержащегося в системе, к общему количеству вещества. Объемная доля вещества- отношение объема компонента, содержащегося в системе, к общему объему системы компонента, содержащегося в системе, к общему объему сиситемы. Массовая доля вещества- отношение массы данного компонента, содержащегося в системе, к общей массе этой системы. |
|
41.активность. ионная сила раствора. Активность. a=с - коэффициент активности. Коэф активности вычисляется по экспериментальным данным : экспериментальная величина/теоретическая величина. Правило ионной силы: ионы одинаковой зарядности, независимо от их природы, в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности. И ионной силой раствора называется полусумма произведений концентраций всех ионов, присутствующих в растворе, на квадрат их заряда: I=0,5∑ciz2i.
|
42. закон Рауля, следствия закона Рауля. Закон Рауля. Понижение давления насыщенного пара растворителя А над раствором ∆pА пропорционально молярной доле растворенного нелетучего вещества xB. Следствия: Температура кипения раствора выше температуры кипения растворителя. Tкип=KэCm Температура кристализации раствора ниже температуры кристализации чистого растворителя. Tзам=KкCm
|
43.осмос. Осмотическое давление. V=nRT =nRT/V =cRT - осмотическое давление. С – молярная концентрация раствора. Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного веществ, называется осмосом. |
44. растворимость, произведение растворимости, условие выпадения осадка. При растворении вещества может возникать равновесие, при котором скорость равновесия фазы равна скорости ее образования. При равновесии измен энергии Гиббса системы равно нулю. Раствор, в котором устанавливается равновесие между растворением и образованием вещества, называется насыщенным, а концентрация такого раствора- растворимостью, cp. Растворимость газов в жидкости пропорционально их пропорциональному давлению над жидкостью(закон Генри). Произведение активностей ионов электролита в степенях, равных стехиометрическим коэффициентам, содержащихся в его насыщенном растворе при данной температуре, есть величина постоянная. Ту величину называют произведением растворимости электролита и обозначают ПР. Условие выпадение в осадок. Если произведение концентрации ионов будет больше произведения растворимости- выпадет осадок, если меньше- не выпадет. |
|
45.диссоциация. степень диссоциации. Константа диссоциации. Сильные, слабые электролиты. Электролитическая диссоциация- процесс распада электролита на ионы под действием молекул растворителя(воды) Степень диссоциации(). Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворённого электролита. Константа диссоциации(Кд)- константа равновесия, описывающая электролитическую диссоциацию электролита. Электролиты, степень диссоциации которых в растворах равна единице и почти не зависит от концентрации раствора. Их называют сильными электролитами. Электролиты, степень диссоциации которых растворах меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами.
|
46.ионное произведение воды, водородный показатель, кислотно-основные индикаторы. Концентрацию молекул можно рассчитать, разделив массу 1л воды на массу ее моля: 1000/18=55,5 моль/л. Константа диссоциации воды может быть вычислена по уравнению: Кд= аН+аОН-/аН2О. Считая эту величину постоянной, можно уравнение записать в виде: [Н+][OH-]=Кд55,5=КВ, где КВ- ионное произведение воды. Водородным показателем, называется взятый с обратным знаком десятичный логарифм активности ионов водорода в растворе: pH=-lgaH+. Кислотно- основным индикатором или просто индикатором, называют вещества, меняющие свою окраску в определенной области значении pH. Индикаторами могут быть слабые органические кислоты Hind и основания IndOH, молекулы и ионы которых имеют разную окраску.
|
47.теория кислот и оснований: электролитическая, протонная, электронная. Согласно теории электролитической диссоциации, применимой к водным растворам, кислотой является электролит, который диссоциирует с образованием ионов Н+. Электролит, диссоциирующий с образованием ионов ОН-, называется основанием. Согласно протонной теории. Кислоту считают донором протонов, а основание- акцептором протонов. Электронная теория кислот и оснований, согласно ей кислота является акцептором, а основание- донором электронов.
|
48. гидролиз солей. Рассмотреть на примерах. Степень гидролиза. Константа гидролиза. Гидролизом солей называют реакции обмена между водой и растворёнными в ней солями. Например CH3COONа. Соль в растворе полностью диссоциирует на ионы: CH3COONа→ CH3COO-+Na+,вода как уже указывалось, явл слабым электролитом: H2O↔H++OH-. Ионы водорода воды взаимодействуют с ацетат-ионами с образованием слабой уксусной кислоты CH3COO-+ H+↔CH3COOH. Таким образом, гидролиз в ионной форме можно представить уравнением CH3COO-+ H2O↔ CH3COOH+OH- Степень гидролиза . Сгидр концентрация гидролизованных молекул. С – исходная концентрация растворённых молекул. = Сгидр/С. Для расчетов константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени.
|
|
49.окислительно-восстановительные рекции. Окислитель, восстановитель, степень окисления. Уравнение ОВР методом полуреакций. Определение направления протекания реакций. Окислитель- вещество, которое принимает электроны и при этом восстанавливается. Восстановитель- вещество, которое отдает электроны и при этом окисляется. Степень окисления называется условный заряд атома в веществе, который находят, считая все химические связи в соединении чисто ионными. Направление смещения электронной пары каждой связи и, следовательно, заряд определяют по разности электроотрицательностей элементов, образующих эту связь. Сумма с.о. всех атомов в соединении равна нулю. Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными. |
50. гальванический элемент Даниэля-Якоби. Анод, катод, токообразующая реакция, схема элемента. Рассмотрим простейший гальванический элемент Даниэля-Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn2+ // Cu2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Zno ––> Zn2+ + 2е-
Сu2+ + 2е- ––> Сuo
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления – катодом. При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Сu2+ + Zno ––> Сuo + Zn2+
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
|
51. ЭДС гальванического элемента. Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента. |
52. водородный электрод, схема элемента. Уравнение Нернста. Расчет ЭДС. ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода εэ называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как "разность потенциалов на границе электрод – раствор", т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
(III.40)
В уравнении Нернста ε° – стандартный электродный потенциал, равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим
расчёт ЭДС элемента Даниэля-Якоби с
помощью уравнения Нернста. ЭДС всегда
является положительной величиной и
равна разности электродных потенциалов
катода и анода:
|