
Инфекция мочевой системы
Группа инфекционно-воспалительных заболеваний мочевой системы является наиболее изученной среди нефропатий, проявляющихся в неонатальном периоде.
Инфекция органов мочевой системы (ИОМС), объединяющая пиелонефрит (ПН), инфекцию мочевыводящих путей (ИМВП), цистит, уретрит и асимптоматическую бактериурию, обнаруживается у новорожденных наиболее часто из всех нефропатий (в 37 % случаев).
Пиелонефрит – инфекционно-воспалительное заболевание почек с преимущественным поражением чашечно-лоханочной системы, канальцев и интерстиция, проявляющаяся картиной инфекционного заболевания, особенно у детей раннего возраста, характеризующаяся лейкоцитурией и бактериурией и обязательным нарушением функционального состояния почек.
Под диагнозом ИМВП понимается инфицирование органов мочевой системы при отсутствии указаний на её уровень и определения топики воспалительного процесса. Если при углубленном обследовании в условиях стационара не подтверждается диагноз ПН, цистит, уретрит и др., то в этом случае возможна постановка диагноза ИМВП. Однако, данный диагноз должен ставиться достаточно редко, при тщательном дальнейшем наблюдении за грудными детьми, с учетом лабораторных анализов мочи и крови.
Цистит - воспалительное заболевание мочевого пузыря.
Асимптоматическая бактериурия характеризует течение инфекционно-воспалительного процесса в нижних отделах мочевой системы преимущественно у новорожденных детей, проявляющаяся бактериурией без лейкоцитурии и протекающая без выраженной клиники. Асимптоматическая бактериурия (АБ) нередко диагностируется у относительно здоровых новорожденных, при отсутствии клинических и лабораторных (лейкоцитурии) признаков инфекционно-воспалительного заболевания. При АБ придается большая значимость состоянию иммунного статуса. Патогенез АБ достаточно сложен, в последнее время высказывается мнение о её эндогенном происхождении. Источником бактериурии может становиться кишечник. АБ является фактором риска формирования пиелонефрита и др.
ИОМС в неонатальном периоде редко течет изолированно и клиническая картина у новорожденных обычно обусловлена сопутствующей патологией. У больных данной возрастной группы нередко отсутствуют симптомы, характерные для инфекционно-воспалительных заболеваний ОМС у детей старшего возраста. В клинике большинства новорожденных доминируют неспецифические признаки: симптомы интоксикации, субфебрилитет, слабое сосание, недостаточная прибавка массы, дисфункция кишечника.
Клиническая картина пиелонефрита у новорожденных детей может быть разнообразной: преобладает малосимптомное или бессимптомное течение ПН (у 59 % детей), что можно объяснить особенностями иммунологического ответа новорожденных. У остальных детей (41 %), в основном, с врожденными пороками ОМС, отмечается более яркая клиническая картина ПН: субфебрильная температура, нарастание симптомов интоксикации, усиление неврологической симптоматики, появление пастозности тканей и дисфункции кишечника с увеличением патологических примесей в стуле.
Основными лабораторными анализами, подтверждающими течение ПН, являются:
1) общий анализ мочи – в котором выявляются умеренная протеинурия от следовой до 0,06 г/л (однако при пороках развития почек, наличии пузырно-мочеточникового рефлюкса, протеинурия может быть более выраженной), лейкоцитурия от 15-20 в поле зрения (что более характерно для патологии дистальных отделов мочевой системы) до сплошь все поля зрения (наиболее часто встречается при пиелонефрите), бактериурия, а также отмечается нейтральная или щелочная реакция мочи, мутность мочи, наличие солей;
2) посев мочи, где наиболее часто высеваемым возбудителем является кишечная палочка, реже встречаются клебсиелла, синегнойная палочка, протей;
3) общий анализ крови – в котором подтверждается воспалительный характер патологического процесса: лейкоцитоз и ускорение СОЭ.
Дополнительными исследованиями, позволяющими определить пиелонефритический процесс, являются:
- биохимическое исследование мочи, выявляющие нарушения канальцевых функций почек (снижение ацидоаммониогенеза, оксалурия, уратурию, фосфатурию и кальциурию);
- биохимический анализ крови, позволяющий определять степень активности воспалительного процесса и функцию почек;
- ультразвуковое исследование почек, выявляющее аномалии развития почек. По данным УЗИ отмечается также увеличение почек, снижение (в острую фазу) или повышение эхогенности паренхимы почек;
- цистография - устанавливается наличие пузырно-мочеточникового рефлюкса и клапана задней уретры;
- по данным урографии и радиоизотопного исследования почек определяется нарушение функции почек.
Наибольшие трудности у новорожденных детей представляет дифференциальная диагностика ПН с ИМВП. В данном вопросе важную роль играет определение энзимурии и уровня Б-2-МГ в крови и моче, поскольку без вовлечения в процесс почечной ткани активность ферментов и нарастание значений Б-2-МГ у пациентов с ИМВП выражены незначительно. При ПН повышается активность всех ферментов мочи, за исключением ХЭ. Наиболее выражен уровень ЛДГ (в 6 раз превышает норму), а также Y-ГТ (в 3 раза). Обращает на себя внимание значительное увеличение содержания Б-2-МГ в моче (в 20-25 раз) при повышении его в сыворотке крови только в 1,3 раза.
ИМВП - инфекционно-воспалительное заболевание нижних отделов мочевой системы, не затрагивающее почки, можно предположить у детей неонатального периода при выявлении только мочевого синдрома в виде лейкоцитурии, протеинурии и бактериурии, у которых не было изменений по данным рентгенологических и ультразвуковых методов исследования, метаболических нарушений, не отмечались изменения воспалительного характера в анализе крови, а также не было нарастания энзимурии и увеличения уровня Б-2-МГ в крови и моче. В случае обнаружения нарушения уродинамики, наличия аномалий развития почек, воспалительных изменений в крови, мочевого синдрома, бактериурии, метаболических изменений, снижения концентрационной функции почек, выявления значительной ферментурии и повышения Б-2-МГ в моче можно предположить развитие вторичного пиелонефрита.
Эмпирическая терапия при отсутствии данных посевов или при отрицательных результатах посева мочи при наличии яркой клинической картины атаки пиелонефрита:
Антибактериальная терапия: Цефалоспорины второго поколения: цефуроксим (зинацеф) в/м по 60 мг/кг при 2-3 степени активности процесса; зиннат per os по 40-70 мг/кг при 1 степени активности процесса; амоксициллин 30-60 мг/ кг в сутки на 7-10 дней.
Уросептики: Фурагин по 6-8 мг/кг сут на 2-4 недели.
При наличии положительных посевов мочи используются антибактериальные препараты, к которым чувствительна высеваемая флора (ампициллин, защищенные пенициллины, цефалоспорины 2-3-го поколения).
Необходимо учитывать, что в раннем возрасте пиелонефрит протекает на фоне выраженной нестабильности цитомембран и дисметаболических нарушений, поэтому уже через 3-4 дня после начала проведения антибактериальной терапии целесообразно совместное назначение мембранстабилизаторов и антиоксидантов курсом не менее месяца.
При длительном течении пиелонефрита в раннем возрасте необходимо проведение полного нефро-урологического обследования с целью выявления признаков функциональной или органической обструкции. Если результаты проведенного обследования оказались отрицательными, необходимо исследование мочи на микоплазмы, уреаплазмы, хламидии с введением в терапию при положительных результатах макролидов (суммамед); на грибы, при обнаружении которых необходимо решать вопрос о назначении дифлюкана.
В последние годы в неонатологии актуальной проблемой является микотическая инфекция. Первая встреча с грибами может произойти еще внутриутробно, при прохождении через родовые пути, при кормлении новорожденного и др. Для кандидозной патологии мало одного присутствия грибов, главным в патогенезе является состояние макроорганизма, Микотические поражения развиваются чаще у новорожденных, перенесших реанимационные мероприятия, сопровождающиеся длительным лечением различными антибиотиками. В настоящее время отмечается нарастание кандидозной патологии мочевой системы (ПН, ИМВП, ОПН), однако на фоне симптомов других заболеваний она нередко просматривается, поздно диагностируется, что ведет к несвоевременному лечению. В большинстве случаев кандидозная инфекция, проявляющаяся поражением кожи, слизистых и наличием в анализах мочи нитей мицелия, в первые 1-2 недели сочетается с бактериальной, атем стабильно превалирует грибковая. В анализах мочи этих новорожденных могут обнаруживаться грибки, несмотря на то, что дети получали противогрибковые препараты (нистатин, леворин). Манифестация кандидоза ОМС способствовует прогрессивному ухудшению состояния новорожденных. В большинстве случаев развитию кандидозной инфекции мочевыводящих путей у новорожденных предшествовует грибковое поражение слизистых и кожи. Обнаружение в анализах мочи мицелия дрожжевых грибков является показанием для назначения противогрибковых средств, хорошо всасывающихся из желудочно-кишечного тракта (дифлюкана, амфоглюкамина, а в случае тяжелого генерализованного поражения или нечувствительности к дифлюкану – применение амфотерицина В) и, иногда, промывания мочевого пузыря амфотерицином В с целью предотвращения обструктивной ОПН.
Лечебные дозы дифлюкана у новорожденных соствляют 8-12 мг/кг в сутки перорально или парентерально в течение 4-6 недель, а амфоглюкамина 10 тыс. ЕД 2 раза в сутки перорально, в течение 2-3 недель.
Гипоксическая нефропатия
Основными факторами, способствующими развитию заболеваний ОМС у новорожденных детей, являются гипоксия и инфекция как в пренатальном периоде, так и после рождения. Степень гипоксически-ишемического поражения почек определяется тяжестью и длительностью воздействия патологического фактора, а также зрелостью организма новорожденного и наличием у него сопутствующей соматической патологии. Прогноз заболеваний органов мочевой системы зависит от ранней диагностики и своевременности терапевтической коррекции.
Гипоксическая нефропатия /ГНП/ устанавливается, в среднем, у трети (32%) новорожденных с нефропатиями. ГНП у новорожденных детей следует рассматривать как заболевание почек невоспалительного характера, являющееся следствием острой интранатальной гипоксии и метаболических нарушений. Поражения почек, преимущественно их тубулярного отдела, при ГНП являются обратимыми в случае купирования повреждающего фактора. В связи с тем, что ГНП развивается у новорожденных на фоне тяжелой соматической патологии, она зачастую просматривается неонатологами и не фиксируется документально.
В клинической картине больных с ГНП отмечается умеренный отечный синдром, увеличение почек, урежение мочеиспусканий. В лабораторном плане ГНП характеризуется мочевым синдромом в виде умеренной протеинурии (от следовой до 0,09 г/л), микрогематурии (от 3 до 10 в поле зрения), уратурии. В общем и биохимическом анализах крови – без выраженных изменений. По данным УЗИ почек отмечается гипоэхогенность пирамидок. Энзимурия незначительна: отмечается в 1,2-1,5 раза увеличение в моче ферментов, указывающих на повреждение тубулярного аппарата почек (Y-ГТ, ЩФ, В-ГЛ). Уровень Б-2-МГ в крови и моче находится на верхней границе нормы. На фоне мембраностабилизирующей терапии, при коррекции обменных нарушений, у новорожденных с ГНП отмечается положительная динамика и на момент выписки из стационара при осмотре и результатам лабораторных исследований патологических изменений не выявляется.
Таким образом, у детей, перенесших реанимационные мероприятия в неонатальном периоде, ГНП является одной из самых частых нозологических форм патологии ОМС. ГНП - наиболее легкий вариант развития гипоксически-ишемического поражения почек у новорожденных детей, что подтверждается отсутствием в катамнезе развития тяжелого нарушения функции почек у всех детей и достаточно высоким процентом (20%) выздоровления на фоне проведения мембраностабилизирующей и антиоксидантной терапии.
Всем детям, перенесшим гипоксическую нефропатию в периоде новорожденности необходимо проводить коррекцию терапии с целью ликвидации последствий гипоксического воздействия на ткань почки.
Витамины и антиоксиданты:
Витамин В6 – 5 мг в сутки, один раз в день утром до 9 часов, перорально, продолжительность терапии 1 месяц. В течение года возможно проведение 3-4 курсов. С 6-месячного возраста доза витамина В6 составляет 5-10 мг/сутки;
Витамин Е – 1 мг/кг в сутки, один раз в дневное время, перорально, продолжительность терапии 1-3 месяца;
Антигипоксическая терапия:
Рибоксин – 0,1 г в сутки (1/2 таблетки) в 2 приема, перорально, перед едой, продолжительность терапии 3-4 недели;
Антисклеротическая терапия:
Витамин В15 – 15 мг один раз в день в дневное время, продолжительность терапии 3-6 месяцев. С 6-месячного возраста доза витамина В15 составляет 25 мг/сутки;
Цитохром С - 0,25% раствор по 2 мл 1 раз в сутки внутримышечно или внутриенно. Длительность курса – 10 дней;
АТФ-0,5 мл и ККБ – 25 мг, внутримышечно,1 раз в день утром, чередуя данные два препарата, №10 каждого.
Острая почечная недостаточность
Острая почечная недостаточность /ОПН/ является самым тяжелым проявлением поражения почек у новорожденных детей, развитие которой связано с генерализованной инфекцией, гипоксией, вторичными патогенетическими механизмами. ОПН определяется, в среднем, у 16 % детей перинатального периода с нефропатиями. Все новорожденные, находящиеся на ИВЛ, угрожаемы по развитию ОПН.
Острая почечная недостаточность - неспецифический синдром различной этиологии, развивающийся в связи с внезапным выключением гомеостатических функций почек, в основе которого лежит гипоксия почечной ткани с последующим преимущественным повреждением канальцев и развитием интерстициального отека. Термин “ОПН” впервые предложил J.Merill (1951) вместо прежних обозначений “анурия” и “острая уремия”.
ОПН – состояние, которое возникает при внезапном, потенциально обратимом снижении скорости клубочковой фильтрации (КФ). Остается спорным, с какого уровня снижение КФ на 50% и более, сохраняющееся по крайней мере в течение 24 часов, свидетельствует о возникновении ОПН. Это сопровождается повышением концентрации креатинина в плазме крови более 0,11 ммоль/л у новорожденных и пропорционально выше у детей более старшего возраста. Дополнительным диагностическим признаком является олигурия - снижение диуреза менее 1 мл/(кг ч.). Однако очевидно, что значительное и, даже, тяжелое снижение КФ может не сопровождаться олигурией и возможен неолигурический вариант ОПН. Необходимо учитывать, что у новорожденных с врожденными пороками развития почек и даже ренальной агенезией не сразу развивается уремия, поскольку плацента обеспечивает большинство почечных функций сохранения гомеостаза. После рождения ребенка обычно требуется около 3-5 дней, чтобы содержание сывороточного креатинина достигло параметров как при ОПН. С другой стороны, при наличии почечной недостаточности у матери, новорожденные могут иметь повышенный уровень креатинина в крови, который не является следствием почечной недостаточности, а лишь отражает несостоятельность плаценты в регуляции неонатального креатинина.
В большинстве случаев ОПН у новорожденных детей протекает по неолигоанурическому типу и при отсутствии должного лабораторного контроля это состояние может пройти недиагностированным. Неолигурическая ОПН, по-видимому, отражает умеренное повреждение почек. Прогноз при неолигурической ОПН обычно лучше, чем при ОПН с олигурией.
Основные факторы риска развития ОПН у детей неонатального периода: гипоксия плода и новорожденного, генерализованная инфекция, гиповолемия и тромбоз почечных сосудов. Ишемия - наиболее частая причина ОПН. В результате ишемии почек может развиться некроз и апоптоз. Дополнительными факторами, способствующими развитию некроза почечной ткани, могут быть полипрагмазия, использование нефротоксичных медикаментов и перегрузка белковыми препаратами.
ОПН подразделяется на преренальную, обструктивную и собственно почечную недостаточность (ренальную). Преренальная недостаточность развивается как следствие неадекватной системной или ренальной циркуляции. Она может быть вызвана как системной гиповолемией, так и почечной гипоперфузией. Преренальная почечная недостаточность – наиболее частая форма ОПН у новорожденных (более 70%). Она возникает вследствие дегидратации, перинатальной гипоксии, септического шока, некротического энтероколита, потери крови, респираторного дистресс-синдрома. Необходимо учитывать, что у новорожденных почечный кровоток может снижаться под влиянием некоторых ангиотензивных препаратов. В случае гиповолемии, если она корригируется своевременно, почки достаточно быстро реагируют на введение жидкости путем восстановления диуреза и исчезновением азотемии.
Обструктивная почечная недостаточность развивается из-за нарушения оттока мочи вследствие пороков развития дистальных отделов мочевой системы, блокады мочевых путей кристаллами солей или мицелием грибка. Нейрогенный мочевой пузырь также может приводить к обструктивной почечной недостаточности.
Собственно почечную недостаточность обуславливает непосредственное повреждение паренхимы почек. Ренальная почечная недостаточность у новорожденных обычно наступает при изначально нормальных почках, которые подвергались гипоксическому или ишемическому воздействию в анте- или интранатальном периоде. Степень гипоксически-ишемического воздействия определяет спектр почечного повреждения, который варьирует от небольшой тубулярной дисфункции до острого тубулярного некроза и ренального инфаркта с кортикомедулярным некрозом. Несмотря на многообразие причин, которые ведут к развитию ОПН, все они в той или иной мере оказывают либо ишемическое влияние на почечную ткань, либо специфическое нефротоксическое влияние на почечную паренхиму Ренальная почечная недостаточность чаще всего развивается вследствие перинатальной асфиксии. Иногда она вызывается пороками развития почек, если повреждения носят двусторонний характер или страдает единственная почка. Наиболее частыми пороками развития являются инфантильный поликистоз почек, ренальная дисплазия, почечная агенезия. Причиной ОПН может быть вирусная инфекция, особенно цитомегаловирус, а также ДВС-синдром, тромбоз почечных вен и почечной артерии. Нефротоксичные препараты, контрастные вещества также вызывают развитие ренальной ОПН в периоде новорожденности.
Гистологическая картина почек новорожденного, развившего ренальную ОПН, представлена на рис. 2. При этом определяется пролиферация эндотелия капилляров клубочков и дистрофия эпителия канальцев с явлениями некробиоза.
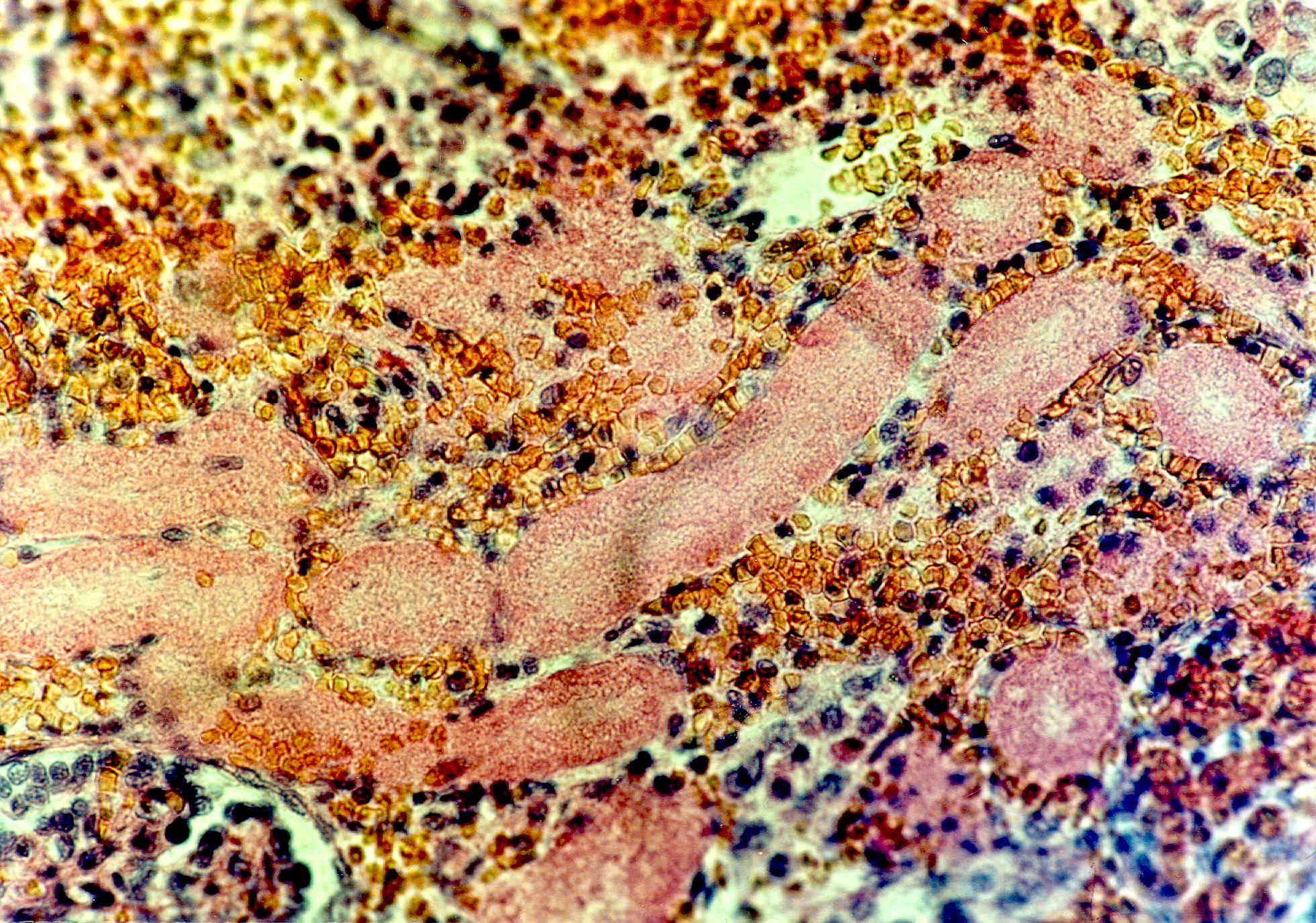
Рис. 2. Гистологическая картина почек новорожденного ребенка, погибшего в результате развития острой почечной недостаточности (пролиферация эндотелия капилляров клубочков и дистрофия эпителия канальцев с явлениями некробиоза).
Окраска гематоксилин-эозином. х300.
Необходима ранняя диагностика ОПН у новорожденных детей. При развитии гиповолемии (преренальная почечная недостаточность) при ранней диагностике, своевременном начале лечения, введением адекватного количества жидкости и коррекцией метаболических нарушений, почки новорожденного ребенка достаточно быстро реагируют восстановлением диуреза и исчезновением азотемии. Раннее выявление новорожденных с обструкцией мочевых путей и своевременное вмешательство может устранить обструкцию и улучшить прогноз. Однако, как преренальная, так и обструктивная ОПН, если продолжается долго, может привести к собственно почечной недостаточности (ренальной). У новорожденных с ренальной ОПН необходимо предотвратить задержку жидкости и электролитов и рано начать проведение диализа, что позволяет уменьшить тяжесть заболевания и снизить уровень смертности в данной группе.
Различные индексы помогают дифференцировать преренальную от ренальной ОПН, однако не один из них не имеет терапевтического преимущества, а также диагностической достоверности по сравнению с нагрузкой жидкостью и ответом диуреза. Наиболее полезным мочевым индексом является индекс почечной недостаточности (ИПН), который вычисляется по формуле: ИПН = UNa/Ucr : Pcr, где UNa – концентрация натрия в моче; Ucr – концентрация креатинина в моче; Pcr – концентрация креатинина в плазме. При значении ИПН менее 3 олигурия является преренальной, более или равном 3 – ренальной. Хотя этот индекс достаточно чувствителен при ренальной ОПН, он не имеет диагностической ценности для недоношенных младенцев, возраст которых при рождении менее 31 недели гестации.
Очень важно тщательно выяснить семейный и акушерский анамнез. Угрожаемыми по развитию ОПН являются дети из семей с пороками развития почек, новорожденные, перенесшие тяжелую перинатальную гипоксию. У новорожденных из группы риска по развитию ОПН должен мониторироваться ежедневный уровень креатинина. ОПН может быть заподозрена, когда креатинин поднимается на 0,02 ммоль/л и более в день, не снижается с течением времени ниже материнского уровня или уровень сывороточного креатинина более 0,11 ммоль/л. При таких изменениях уровня сывороточного креатинина и при выведении мочи более 1 мл/кг/час диагностируется неолигурическая ОПН. У новорожденных с ОПН гиперкалиемия и метаболический ацидоз могут отсутствовать.
Лечебные мероприятия при олигурии необходимо начинать с введения катетера для выявления обструкции нижних мочевых путей, диагностики рефлюкса, сбора мочи для анализов и мониторирования мочи. При отсутствии внутрипочечной обструкции и врожденного порока сердца как причина олигурии должна быть заподозрена преренальная ОПН и начато введение жидкости. Необходимо ввести достаточное количество (до 20 мл/кг массы) изотонического раствора для того, чтобы нормализовать внутрисосудистый объем. В случае продолжения олигурии, должен быть назначен фуросемид (2 мг/кг). Если диурез менее 1 мл/кг/час и азотемия, несмотря на консервативную терапию, сохраняются в течение 24 часов, следует заподозрить собственно ренальную недостаточность и ограничить введение жидкости. УЗИ почек может быть начальной стадией исследовательских процедур у новорожденных, у которых заподозрена как собственно, так и обструктивная ОПН. При ренальной ОПН необходимо раннее проведение перитонеального диализа, который менее травматичен для новорожденных, чем гемодиализ. Почечная недостаточность, требующая диализа, в период новорожденности констатируется в 0,2 случаев на 1000 рожденных живыми.
Дополнительными критериями диагностики ОПН у новорожденных являются определение энзимурии и уровня Б-2-МГ. Значительная ферментурия и увеличение уровня Б-2-МГ в сыворотке крови и моче у новорожденных с ОПН указывают на повреждение как гломерул, так и канальцев: ХЭ повышена в 7,6 раз (клубочек), ЛДГ-в 29,4 раза, ЩФ - в 10 раз (проксимальные канальцы), лизосомальные ферменты увеличены в 6,5 раз (дистальные канальцы). В крови уровень Б-2-МГ превышен почти в 3 раза, в моче - в 9,4 раза.
Новорожденные с тяжелыми врожденными пороками и ОПН имеют наихудший прогноз для развития ХПН - 77%. Работами морфологов показано, что после ОПН полного структурного восстановления почки не происходит и всегда имеются очажки склеротических изменений. Неолигурическая ОПН имеет значительно лучший прогноз: полное восстановление функции почек отмечается более, чем у половины больных, у остальных – развитие интерстициального нефрита. У 40% новорожденных, перенесших олигурическую ОПН, остается сниженным клиренс креатинина. Своевременное лечение диализом значительно улучшают прогноз и снижают смертность.
Показаниями к проведению у новорожденных детей перитонеального диализа является тяжесть состояния ребенка: симптомы интоксикации, анурия более 1 суток, нарастающая азотемия, отсутствие ответа на инфузионную и дегидратационную терапию. Гиперкалиемия и метаболический ацидоз могут отсутствовать. В случае врожденной аномалии развития ОМС, прогноз значительно ухудшается.
Терапия должна быть направлена на борьбу с шоком, улучшение гемодинамики и микроциркуляции, восстановление диуреза, воздействие на этиологический фактор. Если олигурия и азотемия продолжают нарастать в течение суток, несмотря на введение водной нагрузки и сосудорасширяющих препаратов, то можно заподозрить развитие ОПН ренального генеза, что требует проведения перитонеального диализа.
Интерстициальный нефрит
Интерстициальный нефрит /ИН/ является наиболее частой формой поражения почек при гипоксии, особенно на фоне синдрома дыхательных расстройств, так как гипоксия вызывает нарушение ренального кровообращения, повышение проницаемости сосудов и развитие интерстициального отека. Для детей с ИН характерен отягощенный семейный и акушерский анамнез, вовлечение в патологический процесс ЦНС, дыхательной системы, почек, причем степень поражения последних более выражена по сравнению с гипоксической нефропатией. Заболевание у новорожденных развивается как реакция почек на гипоксическое и токсическое воздействие на фоне дисплазии почечной ткани, метаболических нарушений, а также в результате лекарственных, белковых, вирусных повреждений.
Интерстициальный нефрит – это острое или хроническое абактериальное неспецифическое воспаление межуточной ткани почек, сопровождающееся вовлечением в патологический процесс канальцев, кровеносных и лимфатических сосудов почечной стромы. Клинические проявления ИН у новорожденных не имеют специфических симптомов, у некоторых больных, в основном, недоношенных и незрелых, могут быть признаки почечной недостаточностью острого периода (ПНОП).
В клинико-лабораторном плане ИН характеризуется отечным синдромом, повышением мочевины и креатинина в крови на фоне полиурии или адекватного диуреза, анемией, эозинофилией, смешанным мочевым синдромом в виде умеренной протеинурии (до 1г/л), микроэритроцитурии и абактериальной лейкоцитурии, преимущественно лимфоцитарного характера, гипостенурией, гиперкальциемией, гиперфосфатемией, гиперхолетеринемией и гипокалиемией. Протеинурия, развивающаяся в результате перинатальной гипоксии, имеет, преимущественно, тубулярный генез. Отмечается значительная энзимурия, преимущественно повышение В-ГЛ и АС-А (лизосомальных ферментов). Уровень Б-2-МГ в крови увеличен незначительно (в 1,17 раз), в моче - в 4,7 раза. По данным УЗИ для детей, развивших ИН, характерно диффузное повышение эхогенности паренхимы почеки отек сосочков.
Интерстициальный нефрит у новорожденных является часто недиагностированным, так как его клинические признаки нередко теряются на фоне тяжелого общего состояния ребенка. ИН чаще острое состояние, однако у ряда детей раннего возраста в случае поздней диагностики и неадекватного лечения, заболевание проиобретает затяжное течение со снижением массы функционирующих канальцев и появлением очагов некроза, склероза, и развитием хронической почечной недостаточности (ХПН). В генезе хронического интерстициального нефрита большую роль играют не только токсические, но и иммунные факторы.
Клинические проявления ИН у новорожденных не имеют специфических симптомов; у некоторых больных, в основном недоношенных и незрелых детей могут быть признаки почечной недостаточности острого периода (ПНОП). В лечении ИН используется мембраностабилизирующая терапия, антиоксиданты, антиагреганты и антисклеротические препараты.
Дисметаболические нефропатии
В группу новорожденных, страдающих дисметаболическими нефропатиями (ДН), входят дети с отягощенной наследственностью по развитию мочекаменной болезни (МКБ) и желчекаменной болезни (ЖКБ), имеющие незначительные отклонения в функциональном состоянии почек (транзиторный мочевой синдром, умеренную канальцевую ферментурию, нарушение АКОСМ, незначительное повышение эхогенности коркового слоя почек по данным УЗИ) без развития инфекционно-воспалительных изменений. Нередко метаболические нарушения возникают на фоне других почечных заболеваний.
Наиболее часто у новорожденных метаболические нефропатии протекают с оксалатно-кальциевой кристаллурией, реже – уратной и фосфатно-кальциевой. Все эти дети угрожаемы по возникновению МКБ в более старшем возрасте.
Для подтверждения диагноза ДН необходимо сочетание мочевого синдрома в виде следовой протеинурии, микрогематурии (в среднем, 3-5 в поле зрения), лейкоцитурии (обычно до 30 в поле зрения), изменений по данным биохимического анализа мочи в виде кальциурии, оксалурии, фосфатурии, уратурии, снижения антикристаллообразующей способности мочи к оксалатам или фосфатам, определения положительного теста на кальцифилаксию, а также выявление микролитов по данным эхографического исследования почек. Для изучения степени активности кристаллообразования в ОМС у новорожденных детей рекомендуется исследование мочи по Литос-системе. Результаты определения ферментурии и Б-2-МГ в моче и сыворотке крови практически не превышают контрольного уровня. Однако сохраняющиеся у пациентов патологические отклонения некоторых параметров биохимического анализа мочи, а также положительный феномен патологической кристаллизации мочи по Литос-системе обосновывают необходимость дальнейшего наблюдения этих детей нефрологом. Рекомендуется постоянно корректировать диету, питьевой режим, проводить курсы мембраностабилизирующей и антиоксидантной терапии с целью предотвращения образования конкрементов в ОМС.
Мембраностабилизаторы и антиоксиданты:
Витамин В6 – 5мг в сутки, один раз в день утром до 9 часов, перорально, продолжительность терапии 1 месяц. В течение года возможно проведение 3-4 курсов. С 6-месячного возраста доза витамина В6 составляет 5-10 мг/сутки;
Витамин Е - 1мг/кг в сутки, один раз в дневное время, перорально, продолжительность терапии 1-3 месяца;
Ксидифон 2% раствор по1 чайной ложке 3 раза в день за 20 минут до еды, курсами по 2-3 недели 3-4 раза в год;
Инфаркты почек
В неонатальном периоде у детей, особенно недоношенных, на фоне морфо-функциональной незрелости и перенесенной гипоксии отмечается нарушение микроциркуляции почек. В условиях нарушенного артериального и венозного кровотока в различных отделах микроциркуляторного русла почки появляются структуры, состоящие из кислых мукополисахаридов - сосуды паренхимы при этом заполняются, преимущественно, агрегатами и аглютинатами эритроцитов. Наиболее характерная область повреждения - интерстициальная ткань и пирамиды. В отличие от мочекислого диатеза, данное состояние вызывает повреждение структуры и функции органа. В наибольшей степени страдает тубулярный аппарат. В результате ишемии развивается склерозирование эпителия клубочков и канальцев. Решающее значение в диагнозе инфарктов почек (ИП) составляют УЗИ почек с выявлением сильных эхо-позитивных сигналов неправильной формы в проекции пирамидок (рис. 3), а также радиоизотопные исследования почек с определением нарушения функции и снижения объема паренхимы.
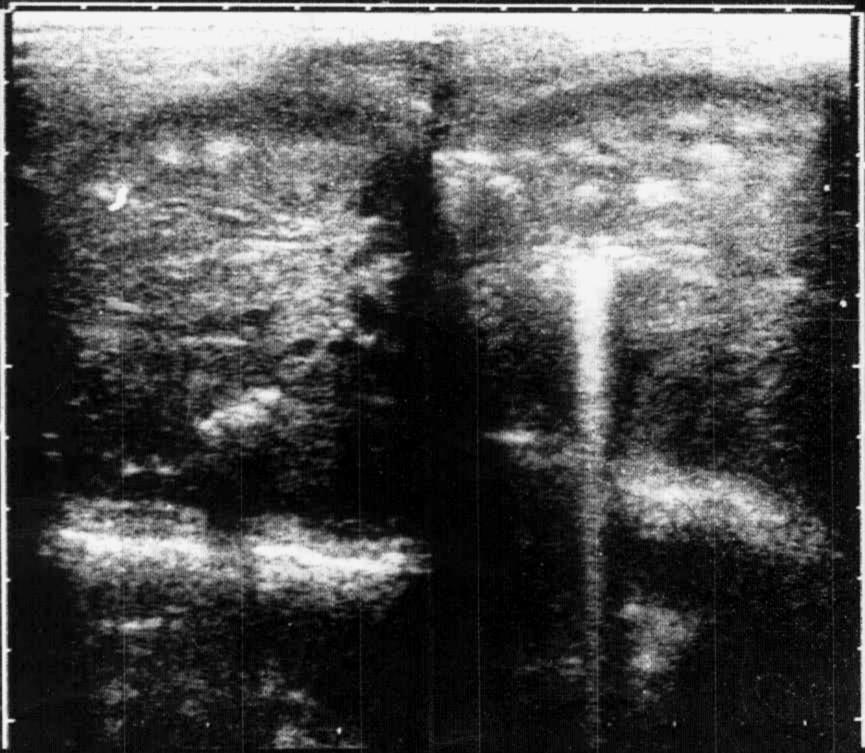
Рис. 3. Эхографическая картина инфарктов почек у новорожденного ребенка.
В проекции пирамид определяются плотные включения – инфаркты почек.
В клинике определяется отечный синдром, склонность к урежению мочеиспусканий, увеличение почек и развитие ОПН по типу неолигурического варианта. Мочевой синдром характеризуется протеинурией и гематурией разной степени выраженности. В биохимических анализах крови отмечается повышение мочевины, липидных комплексов, ЩФ; в моче - высокие цифры Б-2-МГ (у величены в 4 раза) и ферментов: лизосомальные повышены в 3 раза, Y- ГТ, ЩФ и ЛДГ - в 2 раза, ХЭ - в 1,6 раз. У больных с ИП повреждены все отделы почек с преимущественным поражением тубулярного аппарата и интерстиция. Воспаление носит асептический характер.
При распространенных инфарктах почек возможно развитие летального исхода. На рис. 4 представлена гистологическая картина почек новорожденного ребенка, у которого инфаркты почек сопровождались развитием ренальной ОПН и на 11 сутки жизни была констатирована смерть. Результаты патолого-анатомического исследования подтвердили наличие геморрагических инфарктов в почках. При этом выявлялись обширные поля некроза с кровоизлияниями, в сохранных участках паренхимы – дистрофия эпителия канальцев.
В случае благоприятного исхода, у детей с ИП сохраняются изменения по данным УЗИ почек, реносцинтиграфии и допплерографии, а также - мочевой синдром (преимущественно, протеинурия).
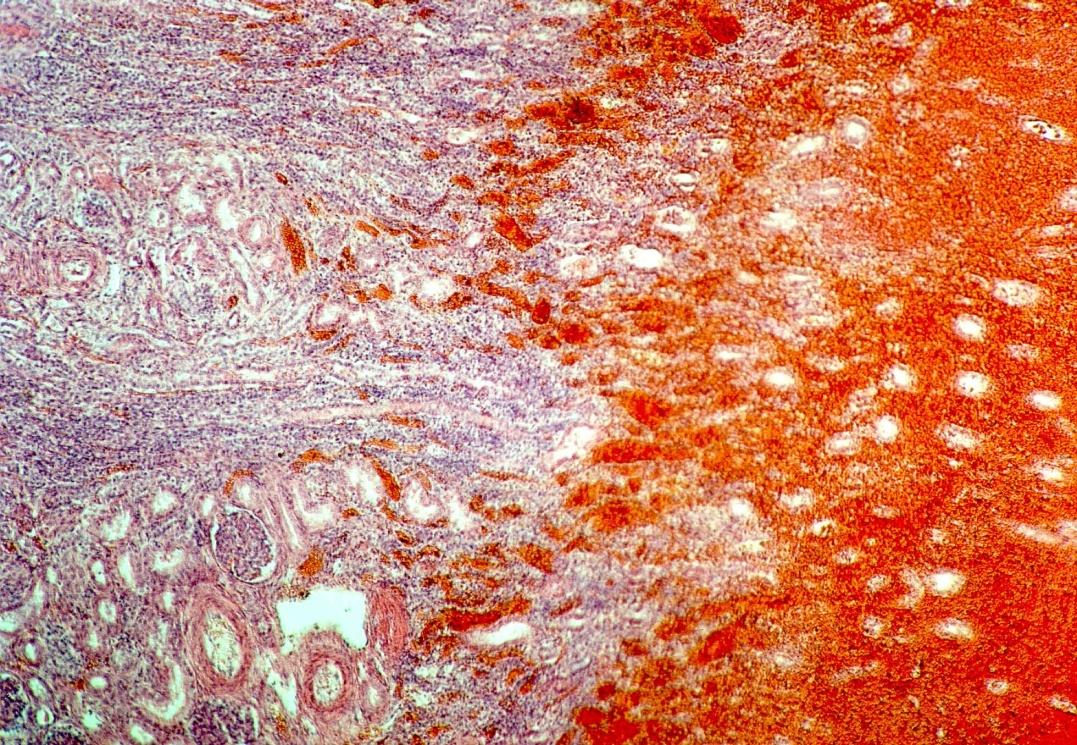
Рис. 4. Гистологическая картина почек новорожденного ребенка Л. с геморрагическими инфарктами. Окраска гематоксилин-эозином. х 100.
Терапия ИП направлена на улучшение почечного кровотока и препятствие прогрессированию склеротических процессов в ишемизированных участках почечной паренхимы.
Применяют антисклеротические препараты, мембраностабилизаторы.
Антисклеротическая терапия:
Солкосерил – 1 мл внутримышечно1 раз в стки в течение 10 дней;
Цитохром С - 0,25% раствор по 2 мл 1 раз в сутки внутримышечно или внутривенно. Длительность курса – 10 дней;
Витамин В15 - 15 мг один раз в день в дневное время. Продолжительность терапии 3-6 месяцев. С 6-месячного возраста доза витамина В15 составляет 25 мг/сутки.
Мембраностабилизаторы и антиоксиданты:
Витамин В6 – 5мг в сутки, один раз в день утром до 9 часов, перорально, продолжительность терапии 1 месяц. В течение года возможно проведение 3-4 курсов. С 6-месячного возраста доза витамина В6 составляет 5-10 мг/сутки;
Витамин Е - 1мг/кг в сутки, один раз в дневное время, перорально, продолжительность терапии 1-3 месяца.
Антиагреганты и антикоагулянты:
Курантил - 6 мг (1/4 таблетки) 2-3 раза в день перорально за 1 час до кормления в течение 2-4 недель;
Гепарин 50 ед/кг в сутки внутривенно или подкожно 3-4 раза в сутки, продолжительность терапии – 10 -14 дней;
Эуфиллин 2-4 мг/кг в сутки в 2-3 приема в течение 3-4 недель;
Никотинамид по1-5 мг 3 раза в сутки, в течение 30-45 дней.
При выписке в возрасте 20-30 дней у детей с ИП наблюдалась заметная положительная ультразвуковая динамика, но сохранялось повышение эхогенности паренхимы почек. В катамнезе у всех детей, перенесших инфаркты почек, выявлены в первые 6 месяцев уплотнения сосочков с обеих сторон, единичные линейные участки нефросклероза по данным УЗИ, а также нарушение функции паренхимы на скенограммах и снижение объема паренхимы.
Таким образом, на ранних этапах ИП возможно развитие ОПН, которая поддается лечебной коррекции. Однако, последствия ОПН сохраняются длительное время. Если ИП занимает обширное пространство, то данное состояние у новорожденного может закончиться летально. Патолого-анатомические результаты подтвердили прижизненную диагностику инфарктов почек: макро - поверхность почек гладкая, эмбрионально дольчатая; под капсулой и в паренхиме имеются множественные геморрагические инфаркты различных размеров; ткань полнокровная, правильного рисунка; микро - некробиоз нефротелия, множественные геморрагические инфаркты на фоне венозного застоя; легкая гипоплазия, лимфостаз, гипотрофия нервных стволов в воротах. В случае поздней диагностики ИП имеет место разрастание соединительной ткани в участках, наиболее подверженных ишемии, и нарушение функции почек принимает характер ХПН.
Следовательно, инфаркт почек, в отличие от мочекислого диатеза, вызывает повреждение структуры и функции органа. Возможна прижизненная диагностика инфарктов почек, где главенствующее значение играет ультразвуковая картина почек с выявлением эхо-плотных включений в области пирамидок. Данная картина сохраняется без изменений длительное время (в течение нескольких месяцев), в дальнейшем, на фоне антисклеротической и мембраностабилизирующей (цитохрома С, солкосерила, курсов АТФ и ККБ, витаминов В15, Е, В6, ксидифона) терапии, происходило уменьшение гиперэхогенных включений в мозговом слое почек. Однако, на протяжении 3-5 лет сохраняются изменения функции почек, определяемые по данным радиоизотопного исследования почек, энзимурии, уровню Б-2-МГ в моче. Эти дети также склонны к развитию дисметаболической нефропатии и имеют риск по формированию интерстициального нефрита и, даже, хронической почечной недостаточности (ХПН).
Врожденные и наследственные заболевания почек.
В последние годы возросло число новорожденных детей с врожденными и наследственными заболеваниями почек, нередко осложняющихся наслоением инфекционно-воспалительного процесса в ОМС и являющихся наиболее частой причиной развития ХПН в детском возрасте.
Некоторые нефропатии встречаются преимущественно в неонатальном периоде: как, например, врожденный нефротический синдром финского или французского типов, аутосомно-рецессивный вариант поликистозной болезни, некоторые тубулопатии, связанные с внутриутробным инфицированием. Эхография является ценным методом в диагностике поликистозной болезни почек плода, позволяющим диагностировать данную группу врожденных пороков развития (ВПР) с середины II триместра беременности. Антенатальная диагностика поликистоза почек с аутосомно-рецессивным типом наследования возможна, начиная с 20 недели гестации. По данным УЗИ выявляются увеличенные гиперэхогенные почки (рис. 5).
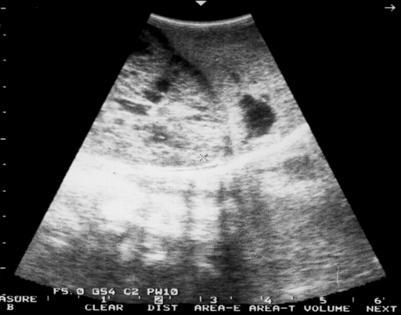
Рис. 5. Ультразвуковая картина почек у новорожденного ребенка Д. с поликистозом почек инфантильного типа.
Сочетание с маловодием, пустым мочевым пузырем и легочной гипоплазией на фоне внутриутробной гипотрофии указывает на максимальную степень внутриутробного повреждения и служит показанием к прерыванию беременности. При поликистозе «инфантильного» типа на первом месяце жизни развивается прогрессирующая почечная недостаточность. На рис. 6 представлена фотография ребенка с поликистозом «инфантильного» типа в возрасте 1 месяца жизни. Живот резко увеличен в размерах. При пальпации живота определяются больших размеров бугристые почки. В дальнейшем ребенок умер в возрасте 7 месяцев в психо-неврологическом отделении ДГКБ №13 им. Н.Ф. Филатова. Смерть наступила от прогрессирующей хронической почечной недостаточности.
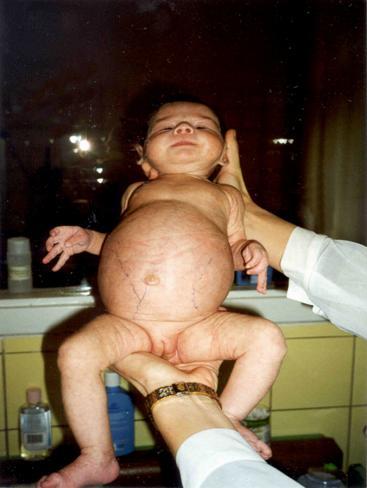
Рис. 6. Фотография новорожденного ребенка Д. с поликистозом почек инфантильного типа.
Патоморфологически диагноз поликистоза почек с развитием уремии был подтвержден. Гистологическая картина почек ребенка Д. с поликистозом почек инфантильного типа представлена на рис. 7. Определяются множественные кисты, выстланные уплощенным эпителием. Между кистами - участки соединительной ткани с полнокровными сосудами. Обнаружены также кисты в печени.
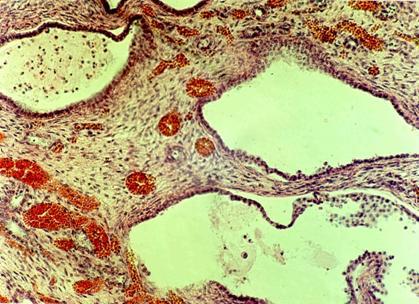
Рис. 7. Гистологическая картина почек ребенка Д. с поликистозом почек инфантильного типа. Окраска гематоксилин-эозином. х 250.
Поликистоз «взрослого» типа выявляется преимущественно у людей старших возрастных групп, однако и у новорожденных могут быть типичные морфологические изменения почек, наблюдаемые у взрослых.
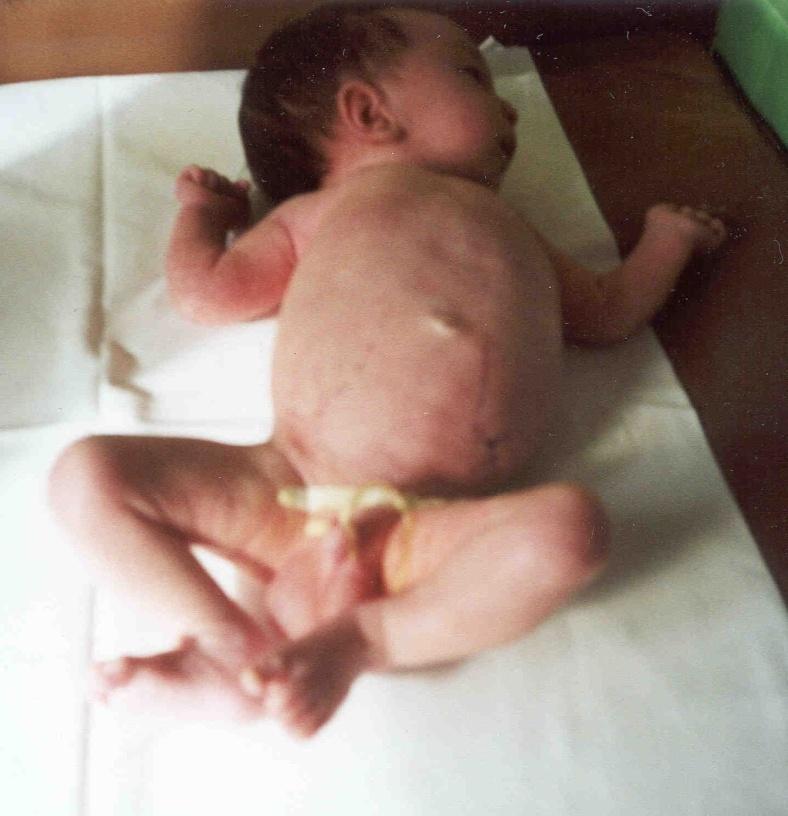
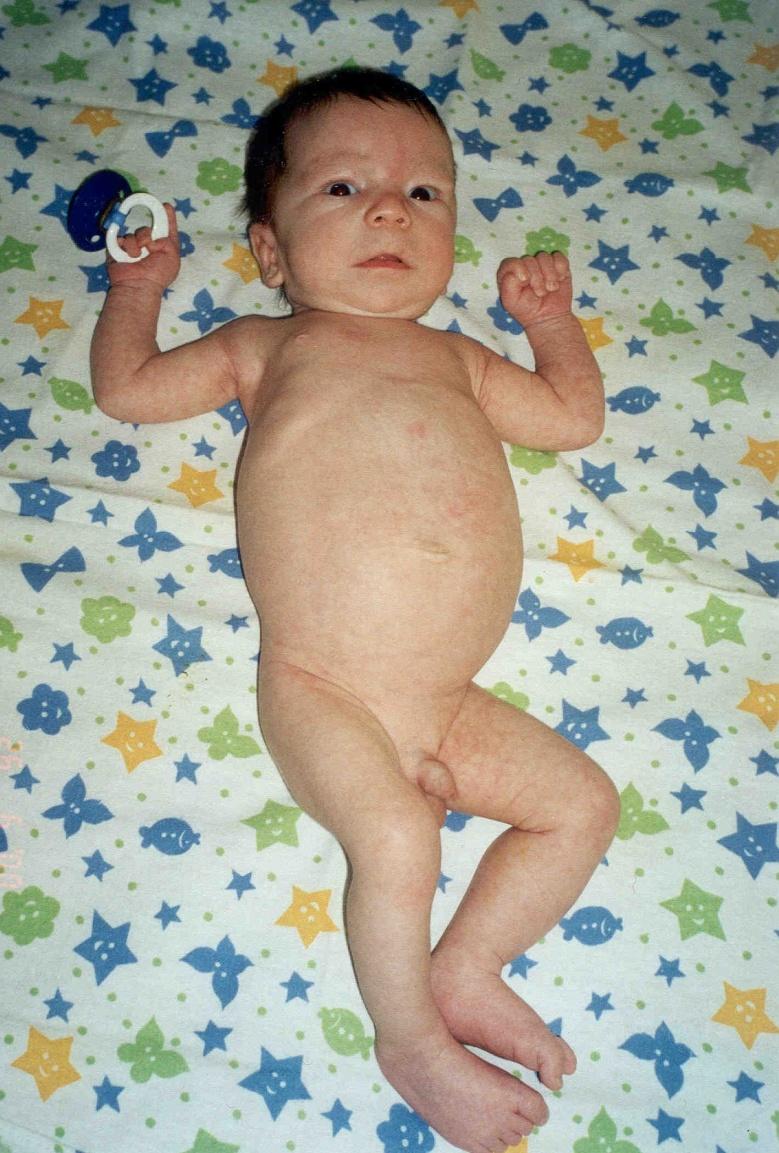
Рис. 8. Фотография ребенка Г. с поликистозом почек взрослого типа в периоде новорожденности и в 4,5 месяца жизни.
Врожденные пороки развития мочевой системы встречаются в 6% патологоанатомических исследований детей в возрасте до 1 года. Следует отметить, что медико-генетическое консультирование, дородовая диагностика, другие профилактические методы позволяют в 50-70% случаев предупредить рождение детей с тяжелыми врожденными и наследственными болезнями, а при некоторых формах – провести успешное профилактическое лечение.
