
- •Белорусский государственный университет информатики и радиоэлектроники Кафедра химии
- •1. Установить химическую активность металлов в водных растворах
- •1.1. Ход и данные опыта.
- •1.2. Расчет, наблюдение и анализ данных.
- •2. Определение стандартной эдс химического гальванического элемента.
- •2.1. Ход и данные опыта.
- •2.2. Расчет, наблюдение и анализ данных.
- •2.3 Вывод: эдс гальванического элемента зависит от природы электродов, от концентрации потенциалопределяющих ионов, от степени поляризации и процессов связанных с её устранением.
- •3.2. Электролиз хлорида натрия.
- •3.2.1. Ход и данные опыта.
- •3.2.2. Расчет, наблюдение и анализ данных.
- •3.3. Электролиз иодида калия.
- •3.3.1. Ход и данные опыта.
- •3.3.2. Расчет, наблюдение и анализ данных.
Белорусский государственный университет информатики и радиоэлектроники Кафедра химии
Отчет по лабораторной работе № 3 «Электрохимические процессы и явления»
Выполнил: Проверила:
студент 1-го курса ФТК Соловей Н.П.
группы 060801
Дятлович Д.В.
Минск 2010
Экспериментальная часть
Цель работы: на конкретных примерах изучить электрохимические процессы, протекающие в гальванических элементах и при электролизе водных растворов электролитов.
1. Установить химическую активность металлов в водных растворах
электролитов и их положение в электрохимическом ряду активностей.
1.1. Ход и данные опыта.
В опыте исследовалась
химическая активность Zn,
Cu,
Al
в водных растворах CuSO4,
ZnSO4,
Аl2(SO4)3,
FeCl3.
Используя тот факт, что самопроизвольно
протекают только реакции удовлетворяющие
условию
![]() ,
было установлено, что реагировать будут
следующие пары веществ: Zn и CuSO4
, Zn
и FeCl3,
Cu и FeCl3
(при условии, что железо восстановится
не полностью). Также возможны реакции
алюминия с сульфатами меди и цинка и
хлоридом железа. Но из-за того, что
алюминий на воздухе покрывается оксидной
пленкой Al2O3,
реакции не протекают.
,
было установлено, что реагировать будут
следующие пары веществ: Zn и CuSO4
, Zn
и FeCl3,
Cu и FeCl3
(при условии, что железо восстановится
не полностью). Также возможны реакции
алюминия с сульфатами меди и цинка и
хлоридом железа. Но из-за того, что
алюминий на воздухе покрывается оксидной
пленкой Al2O3,
реакции не протекают.
В пробирку с раствором CuSO4 опустили гранулу цинка. В результате реакции медь выделилась на поверхности цинка.
 Zn
+ CuSO4
ZnSO4
+ Cu
Zn
+ CuSO4
ZnSO4
+ Cu
 Zn0
+ Cu2+
Zn2+
+ Cu0
Zn0
+ Cu2+
Zn2+
+ Cu0
В раствор с FeCl3 добавили K3[Fe(CN)6] – индикатора на ионы Fe2+. Раствор стал синим, следовательно FeCl3 в большей мере диссоциирует на ионы Fe2+. Затем опустили гранулу цинка.
 Zn
+ 2FeCl3
2FeCl2
+ ZnCl2
Zn
+ 2FeCl3
2FeCl2
+ ZnCl2
 Zn0
+ 2Fe3+
2Fe2+
+ Zn2-
Zn0
+ 2Fe3+
2Fe2+
+ Zn2-
В раствор с FeCl3 опустили гранулу меди.
 Cu
+ 2FeCl3
2FeCl2
+ CuCl2
Cu
+ 2FeCl3
2FeCl2
+ CuCl2
 Cu0
+ 2Fe3+
2Fe2+
+ Cu2-
Cu0
+ 2Fe3+
2Fe2+
+ Cu2-
1.2. Расчет, наблюдение и анализ данных.
Пользуясь тем фактом, что для самопроизвольного протекания реакции требуется, чтобы потенциал окислителя был больше потенциала восстановителя, установим возможность протекания реакций.

 Zn0
+ Cu2+SO42-
ZnSO4
+ Cu
Zn0
+ Cu2+SO42-
ZnSO4
+ Cu
-0,76 B < 0,34 B
восстановитель окислитель
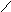 Zn0
+ Al23+(S0)42-
Zn0
+ Al23+(S0)42-
-0,76 В > -1,66 B
восстановитель окислитель
 Zn0
+ 2Fe3+Cl3-
K3[Fe(CN)6]
2FeCl2
+ ZnCl2
Zn0
+ 2Fe3+Cl3-
K3[Fe(CN)6]
2FeCl2
+ ZnCl2
восстановитель окислитель
1) В: Zn – 2e = Zn2+ (-0,763 B)
O: Fe3+ + 3e = Fe0 (-0,036 B)
E(1) = фок-ля – фвос-ля = -0,036 B + 0,763 B = 0,727 B
2) В: Zn – 2e = Zn2+ (-0,763 B)
О: Fe3+ + 1e = Fe2+ (0,770 B)
E(2) = фок-ля – фвос-ля = 0,770 B + 0,763 B = 1,533 B
Т.к Е(2) > E(1) , то предпочтительнее 2-я реакция.
C
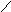 u0
+ Zn2+SO42-
u0
+ Zn2+SO42-
0,34 B > -0,76 B
восстановитель окислитель

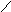 Cu0
+ Al23+(SO4)2-
Cu0
+ Al23+(SO4)2-
0,34 B > -1,66 B
восстановитель окислитель
1
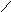

 )
(Fe3+|
Fe0
) Cu0
+ Fe3+Cl3-
)
(Fe3+|
Fe0
) Cu0
+ Fe3+Cl3-
0,34 B > -0,036 B
восстановитель окислитель
2 )
(Fe3+
| Fe2+
) Cu0
+ 2Fe3+Cl3-
K3[Fe(CN)6]
2FeCl2
+ CuCl2
)
(Fe3+
| Fe2+
) Cu0
+ 2Fe3+Cl3-
K3[Fe(CN)6]
2FeCl2
+ CuCl2
0,34 B < 0,770 B
восстановитель окислитель

2Al0 + 3 Cu2+SO42- 3Cu + Al2(SO4)3
-1,66 B < 0,34 B
восстановитель окислитель

2Al0 + 3Zn2+SO4 3Zn + Al2(SO4)3
-1,66 B < -0,76 B
восстановитель окислитель
 2Al0
+ 2FeCl3
2FeCl2
+ AlCl3
2Al0
+ 2FeCl3
2FeCl2
+ AlCl3
-1,66 B < -0,036 B
восстановитель окислитель
Для объяснения реакций с раствором FeCl3 необходимо использовать не только электродный потенциал Fe3+/Fe, но и Fe3+/Fe2+, т.к. железо может восстановиться не полностью, присоединив только один электрон.
В ходе опытов было выяснено, что наиболее активным металлом из исследуемых является алюминий, затем цинк, медь.
1.3
Вывод:
самопроизвольно протекают только те
реакции, которые удовлетворяют условию
![]() . Пассивирующие
слои на
поверхности металлов могут полностью
предотвратить протекание
окислительно-восстановительных реакций.
. Пассивирующие
слои на
поверхности металлов могут полностью
предотвратить протекание
окислительно-восстановительных реакций.
