ТПУ Химия 1курс ИДЗ №1 1вариант
.doc
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Национальный исследовательский Томский политехнический Университет»

Институт
дистанционного образования
химия
Индивидуальное домашнее задание № 1
вариант №1
по дисциплине:
Основные химические понятия и законы
Закон эквивалентов. Газовые законы
|
Исполнитель:
|
|
||||
|
студент группы |
|
|
|
|
23.12.2013 |
|
|
|
|
|
|
|
|
Руководитель:
|
|
||||
|
преподаватель |
|
|
|
|
|
|
|
|
|
|
|
|
Томск 2013
1.
Рассчитать массу 2,24 л (н.у.) оксида углерода (IV) .Сколько это составит моль и молекул?
22.
Составьте электронные формулы атомов, на N - уровне которых содержится а) 2 электрона; б) 7 электронов. Назовите эти элементы и укажите, в каком периоде и группе они находятся.

42.
На каком основании хром и сера, фосфор и ванадий расположены в одной группе периодической системы? Почему их помещают в разных подгруппах?

62.
Определите валентность (по методу ВС) и степень окисления азота в соединениях: N2; NO; N2O3; NO2.

82.
При восстановлении 2,1 г железа с серой выделяется 3,77 кДж тепла. Рассчитать энтальпию образования сульфида

102.
При какой температуре наступит равновесие системы
![]() ,
,
![]() кДж?
кДж?
Найдите
![]() и
и
![]() этой
реакции.
этой
реакции.
Решение. Рассчитаем изменение энтропии реакции на основе табличных значений энтропии образования веществ
![]() =
=![]() Дж/( моль
Дж/( моль![]() К)
К)
![]() =
=
![]() Дж/( моль
Дж/( моль![]() К)
К)
![]() =
=![]() Дж/( моль
Дж/( моль![]() К)
К)
![]() =
=![]() Дж/( моль
Дж/( моль![]() К)
К)
Изменение энтропии реакции
![]() ,
,
![]()
![]() =
=![]() Дж/( моль
Дж/( моль![]() К)
=
К)
=
![]() кДж/( моль
кДж/( моль![]() К)
К)
Изменение энергии
Гиббса
![]() при абсолютной температуре
при абсолютной температуре
![]() К
К
![]() =
=![]() кДж/моль
кДж/моль
Так как
![]() ,
то идет только прямая химическая реакция
,
то идет только прямая химическая реакция
Находим
![]() =
=![]() =
=![]()
Отсюда
![]() =
=![]()
Равновесие системы
наступает при
![]() .
Находим температуру из этого условия
.
Находим температуру из этого условия
![]() ,
,
![]() =
=![]() =
=![]() К
К
115.
В гомогенной
системе
![]() равновесные концентрации реагирующих
газов (в моль/л):
равновесные концентрации реагирующих
газов (в моль/л):
![]() ;
;
![]() ;
;
![]() .
(
.
(![]() ).
Вычислите константу равновесия системы
и исходные концентрации веществ
).
Вычислите константу равновесия системы
и исходные концентрации веществ
![]() и
и
![]() .
Как изменится состояние равновесия
при: а) увеличении
.
Как изменится состояние равновесия
при: а) увеличении
![]() ;
б) разбавлении системы инертным
растворителем; в) поглощении
;
б) разбавлении системы инертным
растворителем; в) поглощении
![]() .
.


130.
Для
реакции
![]() получена зависимость скорости от
концентрации ионов в растворе:
получена зависимость скорости от
концентрации ионов в растворе:
|
|
моль/л |
0,01 |
0,03 |
0,04 |
0,03 |
0,03 |
|
|
моль/л |
0,01 |
0,01 |
0,01 |
0,02 |
0,03 |
|
|
моль/(л |
1 |
3 |
4 |
6 |
9 |
Является ли данная реакция простой (элементарной)? Вывести кинетическое уравнение; определить константу скорости и порядки реакции по обоим компонентам.
Решение. Простые (элементарные) реакции - реакции, протекающие в одну стадию и описываемые уравнением скорости реакции или кинетическим уравнением. Эта реакция является необратимой простой реакцией, так как протекает в одну стадию.
Реакция третьего порядка. Кинетическое уравнение, выражает зависимость скорости химической реакции от концентраций компонентов реакционной смеси. Скорость прямой реакции (закон действующих масс для кинетики):
![]()
![]()
![]()
(сумма показателей
равна трем), где
![]() ,
,
![]() -
молярные концентрации. Если
для какой-либо реакции эта сумма больше
трех, то можно утверждать, что реакция
сложная.
-
молярные концентрации. Если
для какой-либо реакции эта сумма больше
трех, то можно утверждать, что реакция
сложная.
Порядок реакции по кобальту равен 2 а по таллию равен 1.
Константа скорости
реакции равна
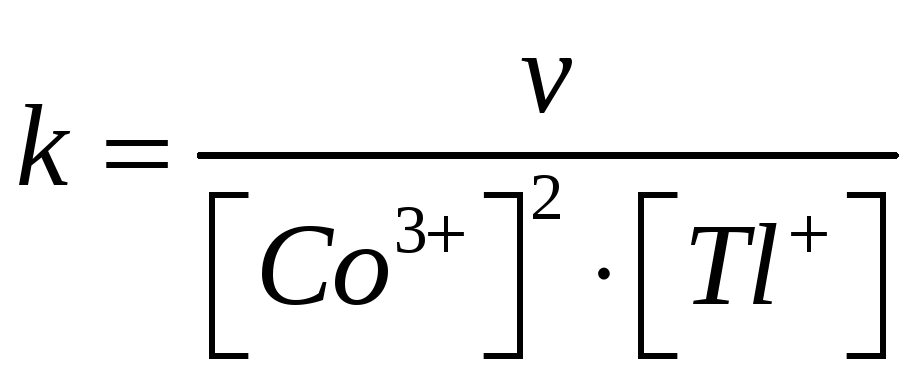
Находим ее значения при разных концентрациях
(для реакции третьего порядка размерность л2·с1·моль2 ).
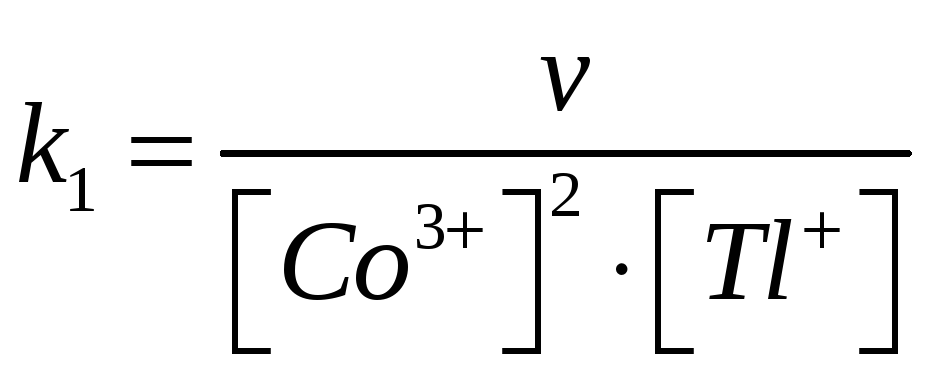 =
=![]() =1000
=1000
![]() =
=![]()
![]() =
=![]()
![]() =
=![]()
![]() =
=![]()
В среднем константа
скорости реакции равна
![]() л2·с1·моль2
л2·с1·моль2
Таким образом,
кинетическое уравнение
![]()
145.
Из 400 г 50%-ного
раствора (по массе)
![]() выпариванием удалили 100 г воды. Чему
равна массовая доля
выпариванием удалили 100 г воды. Чему
равна массовая доля![]() в оставшемся растворе?
в оставшемся растворе?
Решение. Массовая
доля чистой серной кислоты равна
![]() ,
масса раствора
,
масса раствора
![]() г.
г.
Следовательно,
чистой воды было в этом растворе
![]() г,
а также чистой кислоты
г,
а также чистой кислоты
![]() г.
г.
В новом растворе
осталось
![]() г чистой воды и истой кислоты
г чистой воды и истой кислоты
![]() г
г

Концентрация
кислоты составит
![]() .
.
165.
Раствор сахара
![]() при 0°С оказывает осмотическое давление
равное 114 мм рт. ст. Сколько граммов
сахара содержится в 1 л этого раствора?
при 0°С оказывает осмотическое давление
равное 114 мм рт. ст. Сколько граммов
сахара содержится в 1 л этого раствора?

190.
Какие вещества:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
будут взаимодействовать с азотной
кислотой? Записать эти реакции в ионной
и молекулярной форме.
,
будут взаимодействовать с азотной
кислотой? Записать эти реакции в ионной
и молекулярной форме.

210.
Указать, не производя вычислений, в каком из растворов двух солей равной концентрации рН больше или меньше и почему:

230.
Исходя из степени
окисления хлора в соединениях
![]() ,
,
![]() ,
,
![]() ,
определите, какое из них является только
окислителем, только восстановителем и
какое может проявлять как окислительные,
так и восстановительные свойства.
Почему? На основании баланса степеней
окисления расставьте коэффициенты в
уравнении реакции, идущей по схеме:
,
определите, какое из них является только
окислителем, только восстановителем и
какое может проявлять как окислительные,
так и восстановительные свойства.
Почему? На основании баланса степеней
окисления расставьте коэффициенты в
уравнении реакции, идущей по схеме:
![]()


250.
Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом - анодом. Написать уравнения реакций, происходящих при работе этих элементов, и вычислить значения стандартных ЭДС.
Решение. Случай: медь служит анодом.
Стандартные потенциалы
![]() В ( анод)
В ( анод)
![]() В ( катод)
В ( катод)
Гальванический
элемент
![]()
Работа гальванического элемента
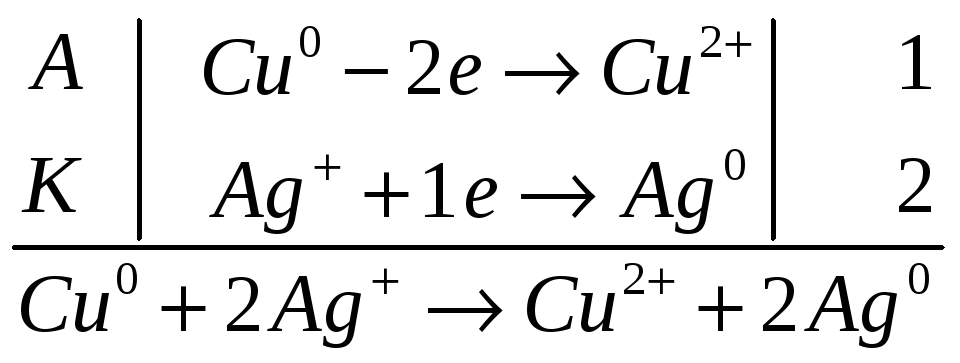
ЭДС цепи равна
![]()
![]()
![]() В
В
Случай: медь служит катодом.
Гальванический
элемент
![]()
Работа гальванического элемента
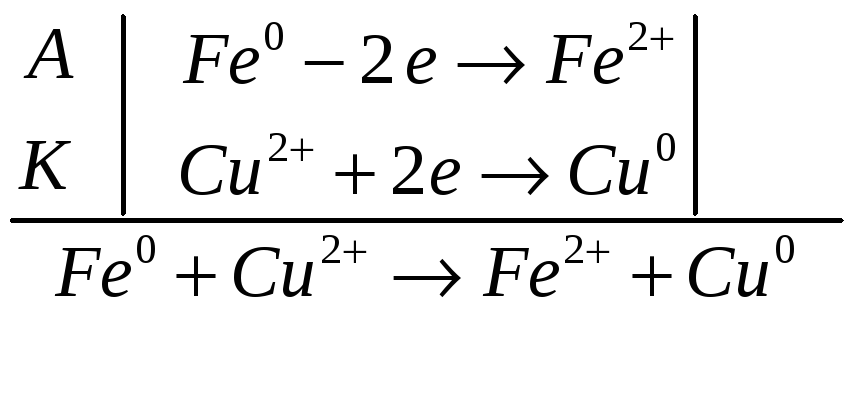
![]() В ( анод)
В ( анод)
![]() В (катод)
В (катод)
![]()
![]()
![]() В
В
270.
Водный раствор содержит смесь нитратов меди (II), железа (II), свинца (II) и натрия одинаковой концентрации. В какой последовательности будут выделяться металлы при электролизе?

286.
Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.

306.


326.


346.
В 500 мл воды растворили 23 г металлического натрия. Определить объем выделившегося газа и рассчитать молярную концентрацию полученного раствора.
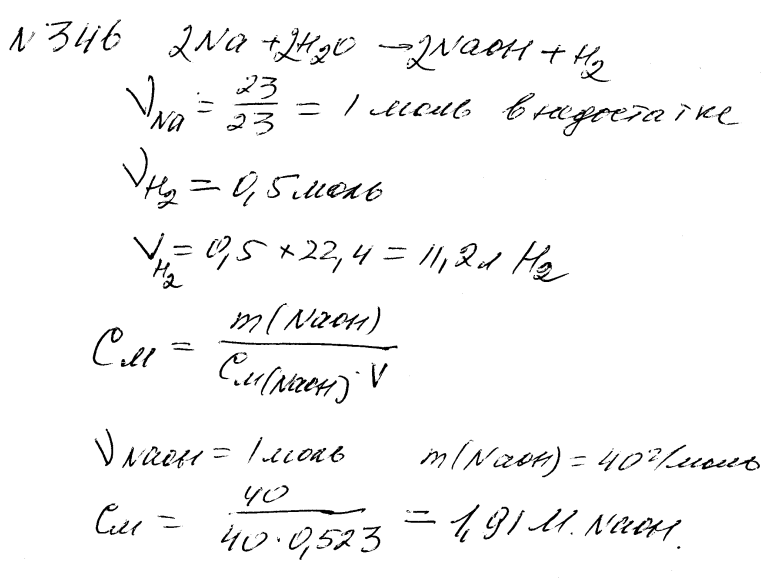
366.
Оксид бария, содержащий в качестве примеси 10,48% карбоната бария, обработан 6М раствором азотной кислоты. Мри этом выделилось 1,12 л газа (н.у.). Какова масса взятой смеси и сколько миллилитров раствора азотной кислоты вступило в реакцию?

386.