
Курсовая по физической химии
.docxМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
СГТУ, ЭТИ СГТУ (филиал)
КАФЕДРА ФИЗИЧЕСКОЙ И ОРГАНИЧЕСКОЙ ХИМИИ
КУРСОВАЯ РАБОТА
ПО ДИСЦИПЛИНЕ ФИЗИЧЕСКАЯ ХИМИЯ
г.ЭНГЕЛЬС
2010 – 2011г.
Задача №5 (вариант 11)
Указать
порядок и найти константу скорости
данной реакции, протекающей при заданной
температуре Т, пользуясь данными
(табл.37) о ходе процесса во времени
 (с начала реакции).
(с начала реакции).
|
Реакция |
Время |
Метод
контроля за ходом реакции
|
Т, К |
|
С12Н22О11
+ Н2О
с
– концентрация сахара в данный момент,
г с0
– начальная концентрация 0,65 , г |
0 |
1 |
298 |
|
1435 |
1,081 |
||
|
4315 |
1,266 |
||
|
7070 |
1,464 |
||
|
11360 |
1,830 |
||
|
14170 |
2,117 |
||
|
16935 |
2,466 |
||
|
19815 |
2,857 |
||
|
29925 |
4,962 |
||
|
|
- |
Решение:
С12Н22О11
+ Н2О
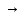 С6Н12О6
+ С6Н12О6
- данная
реакция протекает по первому порядку,
тогда константа скорости находиться
по уравнению:
С6Н12О6
+ С6Н12О6
- данная
реакция протекает по первому порядку,
тогда константа скорости находиться
по уравнению:
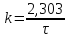 lg
lg

Составим таблицу:
|
|
1435 |
4315 |
7070 |
11360 |
14170 |
16935 |
19815 |
29925 |
|
|
1,081 |
1,266 |
1,464 |
1,830 |
2,117 |
2,466 |
2,857 |
|
|
|
5,41 |
5,46 |
5,54 |
5,32 |
5,298 |
5,33 |
5,299 |
5,35 |
Среднее значение константы скорости данной реакции:
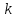 = 5,32
= 5,32
 10 – 5 моль/л
10 – 5 моль/л с
с
Ответ:
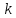 = 5,32
= 5,32
 10 – 5
моль/л
10 – 5
моль/л с
с
Задача №6 (вариант 11)
В
табл. 38 приведены значения константы
скорости k1
и k2
реакции при двух различных температурах
Т1
и Т2
.
вычислить энергию активации этой
реакции, найти константу скорости при
температуре Т3
и определить, сколько вещества
прореагировало к моменту времени
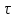 ,
если начальная концентрация вещества
с0
(с0
– начальные концентрации реагирующих
веществ одинаковы). Определить
температурный коэффициент скорости
реакции и проверить применимость правила
Вант – Гоффа на этих примерах. Порядок
реакции считать по молекулярности.
,
если начальная концентрация вещества
с0
(с0
– начальные концентрации реагирующих
веществ одинаковы). Определить
температурный коэффициент скорости
реакции и проверить применимость правила
Вант – Гоффа на этих примерах. Порядок
реакции считать по молекулярности.
|
Реакция |
Т1,К |
k1 |
Т2,К |
k2 |
Т3,К |
|
с0, кмоль/м3 |
|
SO2Cl2
|
552,2 |
0,609 |
593,2 |
0,1321 |
688,2 |
35 |
2,5 |
Решение:
По
уравнению Аррениуса можно найти
зависимость константы скорости реакции
от температуры:
 = А
= А
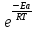
где
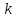 - константа скорости реакции; А –
предэкспоненциальный множитель; Е –
энергия активации реакции; Т –
термодинамическая температура; R
– универсальная газовая постоянная.
- константа скорости реакции; А –
предэкспоненциальный множитель; Е –
энергия активации реакции; Т –
термодинамическая температура; R
– универсальная газовая постоянная.
ln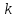 = ln
А
= ln
А
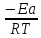
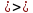 ln
А = ln
ln
А = ln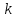 +
+
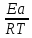
так как нам дано две температуры составим уравнение для констант скорости и уравняем их:
ln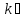 +
+
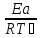 = ln
= ln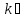 +
+
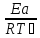 отсюда находим энергию активации
реакции:
отсюда находим энергию активации
реакции:
Еа
= R ln
ln
 подставив данные из таблицы получим:
подставив данные из таблицы получим:
Еа
=
 ln
ln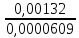 = 24576 Дж/моль
= 24576 Дж/моль
А
=
 =
=
 = 2,89
= 2,89 10-7
10-7
А
при Т3
= 688,2 К ;
 = 0,609
= 0,609 10-4
моль/л
10-4
моль/л с
с
Из уравнения для константы скорости второго порядка найдем количество прореагирующих веществ:
с0
= 2,5
кмоль/м3
;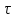 =0,58
ч
=0,58
ч
с
=
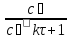 =
=
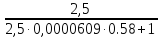 = 2,5
= 2,5
Правило
Вант – Гоффа: k₂ = k₁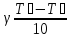
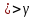 =
=
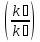 10/(Т₂-Т₁)
=
10/(Т₂-Т₁)
=
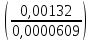 0,24
= 2,10
0,24
= 2,10
Правило Вант – Гоффа выполняется, так как значение температурного коэффициента лежат в области от 2 до 4.
Ответ:
с = 2,5 ; правило Вант – Гоффа выполняется.
Задача № 7 (вариант 12)
Для реакции А, протекающей по n порядку, получены значения константы скорости при различных температурах (табл.39). Рассчитать:
а) энергию активации;
б) предэкспоненциальный множитель;
в) теплоту активации;
г) энтропию активации;
д) температурный коэффициент скорости реакции.
|
Реакция А |
Т,К |
К при
n=1в
с-1 ,
при n=2в
см3 |
|
2HI
n = 2 |
500 |
2,938 |
|
510 |
7,096 |
|
|
520 |
1,652
|
|
|
530 |
3,732 |
|
|
540 |
8,185
|
|
|
550 |
1,742
|
|
|
560 |
3,606
|
Решение:
а)
Уравнение Аррениуса:
 = А
= А

где
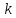 - константа скорости реакции; А –
предэкспоненциальный множитель; Е –
энергия активации реакции; Т –
термодинамическая температура; R
– универсальная газовая постоянная.
- константа скорости реакции; А –
предэкспоненциальный множитель; Е –
энергия активации реакции; Т –
термодинамическая температура; R
– универсальная газовая постоянная.
Энергию
активации можно найти зная хотя бы две
константы равновесия и прологарифмировав
уравнение Аррениуса : ln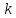 = ln
А
= ln
А
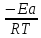
В
координатах ln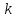 - 1/Т данная зависимость прямолинейна с
тангенсом угла наклона к оси абсцисс
равным Е/ R,
следовательно E
= - tg
- 1/Т данная зависимость прямолинейна с
тангенсом угла наклона к оси абсцисс
равным Е/ R,
следовательно E
= - tg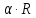
Предэкспоненциальный множитель находим по формуле: A = e ln A
Составим таблицу:
|
|
Т |
1/Т |
ln |
|
2,938 |
500 |
2,00 Е - 03 |
- 12,7378 |
|
7,096 |
510 |
1,96 Е – 03 |
- 11,856 |
|
1,652
|
520 |
1,92 Е – 03 |
- 11,011 |
|
3,732 |
530 |
1,89 Е – 03 |
- 10,196 |
|
8,185
|
540 |
1,85 Е – 03 |
- 9,411 |
|
1,742
|
550 |
1,82 Е – 03 |
- 8,655 |
|
3,606
|
560 |
1,79 Е - 03 |
- 7,928 |
Строим
график в координатах ln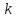 - 1/Т.
- 1/Т.
На графике находим а = 0,21 Е – 03 ; в = 6,73
tg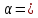 -
-
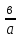 = -
= -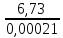 = - 32048
= - 32048
Eа
= - tg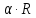 = 32048
= 32048 8,314
= 266447 Дж/моль (где
8,314
= 266447 Дж/моль (где = 8,314Дж/моль
= 8,314Дж/моль К)
К)
б)
ln
А = ln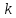 +
+
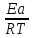 = - 12,7378 +
= - 12,7378 +
 = 51,36
= 51,36
A
= e
ln
A
= 2,71851,36
= 2
 1022
(где е = 2,718)
1022
(где е = 2,718)
в) Теплоту активации найдем по формуле для Т = 298 К:
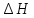 = Е –
= Е –
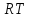 = 266447 – 8,314
= 266447 – 8,314 298
= 263969Дж/моль
298
= 263969Дж/моль
г)
Энтропию активации находим
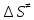 =
=
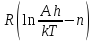
где h - постоянная Планка (6,62Е – 34 Дж/с);
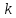 - постоянная
Больцмана (1,38Е - 23)
- постоянная
Больцмана (1,38Е - 23)
n – порядок реакции , n = 2
 =
=
 = 8,314
= 8,314
 = 218,49
= 218,49
д) По правилу Вант – Гоффа найдем температурный коэффициент:
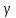 =
=
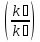 10/(Т₂-Т₁)
=
10/(Т₂-Т₁)
=
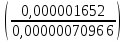 1
= 2,33
1
= 2,33
Ответ:
Eа
= 266447Дж/моль;
A
= 2
 1022
;
1022
;
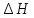 = 263969Дж/моль;
= 263969Дж/моль;
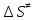 = 218,49;
= 218,49;
 =2,33
=2,33

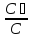
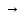 С6Н12О6
+ С6Н12О6
С6Н12О6
+ С6Н12О6 моль/л
моль/л моль/л
моль/л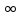
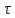
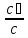
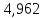
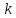
 10 –
5
10 –
5
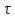
 SO2
+ Cl2
SO2
+ Cl2 10-4
10-4 10-2
10-2 -1
-1 -1
-1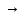 H2
+ I2
H2
+ I2 10-6
10-6 10-6
10-6 10-5
10-5 10-5
10-5 10-5
10-5 10-4
10-4 10-4
10-4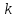
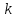
 10-6
10-6 10-6
10-6 10-5
10-5 10-5
10-5 10-5
10-5 10-4
10-4 10-4
10-4