
Ответы к экзамену ( 1 часть )
.pdf
Студенты
Белорусского Государственного Медицинского Университета
Фармакология. Ответы на экзаменационные вопросы первого
раздела. Версия 2012 года.
Минск 2012
1
1. Сущность фармакологии как науки. Разделы и области современной фармакологии. Основные термины и понятия фармакологии – фармакологическая активность, действие, эффективность химических веществ.
Фармакология – наука о лекарствах во всех аспектах – теоретическая основа фармакотерапии: а) наука о взаимодействии химических веществ с живыми системами б) наука об управлении процессами жизнедеятельности организма с помощью химических веществ.
Разделы современной фармакологии:
1)фармакодинамика – изучает а) воздействие ЛС на организм человека, б) взаимодействие различных ЛС в организме при одновременном их назначении, в) влияние возраста и различных заболеваний на действие ЛС
2)фармакокинетика – изучает всасывание, распределение, метаболизм и экскрецию ЛС (т.е. как организм больного реагирует на ЛС)
3)фармакогенетика – изучает роль генетических факторов в формировании фармакологического ответа организма на ЛС
4)фармакоэкономика – оценивает результаты использования и стоимость ЛС для принятия решения о последующем их практическом применении
5)фармакоэпидемиология – изучает применение ЛС и их эффекты на уровне популяций или больших групп людей для обеспечения применения наиболее эффективных и безопасных ЛС Фармакологическая (биологическая) активность – свойство вещества вызывать изменения в биосистеме
(организме человека). Фармакологические вещества = биологически активные вещества (БАВ) Фармакологическое действие – влияние ЛС на объект и его мишени Фармакологический эффект – результат действия вещества в организме (модификация физиологических,
биохимических процессов, морфологических структур) – количественное, но не качественное изменение в состоянии биосистем (клеток, тканей, органов).
Эффективность ЛС – способность ЛС вызывать определенные необходимые в данном случае фармакологические эффекты в организме. Оценивается на основе «существенных доказательств» - адекватных хорошо контролируемых исследований и клинических испытаний, проводимых экспертами с соответствующей научной подготовкой и опытом в исследовании лекарств данного типа {FDA}
2. Источники и этапы создания лекарств. Плацебо-эффекты. Определение понятий лекарственное вещество, лекарственное средство, лекарственный препарат и лекарственная форма. Название лекарств.
Источники создания ЛС:
а) натуральное сырье: растения, животные, минералы и т.д. {сердечные гликозиды, свиной инсулин} б) модифицированные природные БАВ в) синтетические соединения
г) продукты генной инженерии {рекомбинантный инсулин, интерфероны} Этапы создания ЛС:
1.Синтез ЛС в химической лаборатории
2.Доклиническая оценка активности и нежелательных эффектов ЛС Минздравом и др. организациями
3.Клинические испытания ЛС
Плацебо – любой компонент терапии, не оказывающий никакого специфического биологического воздействия на болезнь, являющуюся объектом лечения.
Применяется с целью контроля при оценке действия ЛС и для того, чтобы принести пользу больному без каких-либо фармакологических средств в результате только психологического воздействия (т.е. плацебо-эффекта).
Все виды лечения имеют психологический компонент, либо доставляющий удовлетворения (плацебо-эффект), либо вызывающий беспокойство (ноцебо-эффект). Пример плацебо-эффекта: быстрое улучшение у больного вирусной инфекцией при применении антибиотиков, не влияющих на вирусы.
Благоприятность плацебо-эффекта связана с психологическим воздействием на пациента. Он будет максимальным лишь при его использовании в сочетании с методами лечения, имеющими выраженный специфический эффект. Дорогостоящие вещества в качестве плацебо также способствуют достижению большего ответа.
Показания к применению плацебо:
1)слабые психические нарушения
2)психологическая поддержка пациента с неизлечимой хронической болезнью или с подозрением на тяжелый диагноз Лекарственное средство – любое вещество или продукт, используемые, чтобы модифицировать или исследовать
физиологические системы или патологические состояния для блага реципиента (по ВОЗ, 1966 г.); индивидуальные вещества, смеси веществ или композиции неизвестного состава, обладающие доказанными лечебными свойствами. Лекарственное вещество – индивидуальное химическое соединение, используемое в качестве лекарственного средства.
Лекарственная форма – удобная для практического применения форма, придаваемая лекарственному средству для получения необходимого лечебного или профилактического эффекта.
Лекарственный препарат – лекарственное средство в определенной лекарственной форме, разрешенное органом государственного управления.
2
3. Пути введения лекарств в организм и их характеристика. Пресистемная элиминация лекарств.
1. Для системного действия а. энтеральный путь введения: перорально, сублингвально, трансбуккально, ректально, через зонд
б. парентеральный путь введения: внутривенно, подкожно, внутримышечно, ингаляционно, субарахноидально, трансдермально 2. Для местного воздействия: накожно (эпикутарно), на слизистые, в полости (брюшную, плевральную, суставную), в
ткани (инфильтрация)
Путь |
Достоинства |
Недостатки |
||
введени |
|
|
|
|
я ЛС |
|
|
|
|
Перорал |
1. |
Удобен и прост для пациента |
1. |
Абсорбция многих ЛС зависит от приема пищи, |
ьно – |
2. |
Не требуется стерильности |
функционального состояния ЖКТ и др. факторов, с трудом |
|
через |
препаратов |
учитывающихся на практике |
||
рот |
|
|
2. |
Не все ЛС хорошо всасываются в ЖКТ |
|
|
|
3. |
Некоторые ЛС разрушаются в желудке (инсулин, пенициллин) |
|
|
|
4. |
Часть ЛС оказывает НЛР на слизистую ЖКТ (НПВС – изъявления |
|
|
|
слизистой, антациды – подавляют моторику) |
|
|
|
|
5. |
Не применим у пациентов в бессознательном состоянии и при |
|
|
|
нарушении глотании |
|
Сублинг |
1. |
Удобное и быстрое введение |
1. |
Неудобство, создаваемое частым регулярным использованием |
вально |
2. |
Быстрое всасывание ЛС |
таблеток |
|
и |
3. |
ЛС не подвергается |
2. |
Раздражение слизистой рта, избыточное выделение слюны, |
трансбу |
пресистемной элиминации |
способствующее заглатыванию ЛС и уменьшению его |
||
ккально |
4. |
Действие препарата можно |
эффективности |
|
|
быстро прервать |
3. |
Неприятный вкус |
|
Ректаль |
1. |
Половина ЛВ не подвергается |
1. |
Неприятные для пациента психологические моменты |
но |
пресистемному метаболизму |
2. |
Всасывание ЛС значительно замедляется при неопорожненной |
|
|
2. |
Не раздражается слизистая |
прямой кишке. |
|
|
ЖКТ |
|
|
|
|
3. |
Удобно, когда другие пути |
|
|
|
введения неприемлимы (рвота, |
|
|
|
|
морская болезнь, грудные дети) |
|
|
|
|
4. |
Местное действие |
|
|
Внутрис |
1. |
Быстрое поступление в кровь |
1. |
Технические сложности внутрисосудистого доступа |
осудист |
(неотложные состояния) |
2. |
Риск развития инфекции в месте инъекции |
|
о |
2. |
Быстрое создание высокой |
3. |
Тромбозы вен в месте введения ЛС (эритромицин) и болевые |
(обычно |
системной концентрации и |
ощущения (калия хлорид) |
||
внутрив |
возможность ею управлять |
4. |
Некоторые ЛС адсорбируются на стенках капельниц (инсулин) |
|
енно |
3. |
Позволяет вводить ЛС, |
|
|
|
разрушающиеся в ЖКТ |
|
|
|
Внутрим |
Достаточно быстрое всасывание |
Риск местных осложнений |
||
ышечно |
препарата в кровь (10-30 мин) |
|
|
|
Подкож |
1. |
Больной может делать |
1. |
Медленное всасывание и проявление эффекта ЛС |
но |
инъекции самостоятельно после |
2. |
Атрофия жировой ткани в месте введения и уменьшение |
|
|
обучения |
скорости всасывания ЛС |
||
|
2. |
Длительный эффект ЛС |
|
|
Ингаляц |
1. |
Быстрое начало действия и |
1. |
Необходимость специального устройства (ингалятора) |
ионно |
высокая концентрация в месте |
2. |
Сложность использования аэрозолей под давлением для |
|
|
введения при лечении |
некоторых больных |
||
|
заболеваний дых. путей |
|
|
|
|
2. |
Хорошая контролируемость |
|
|
|
действия |
|
|
|
|
3. |
Уменьшение токсических |
|
|
|
системных эффектов |
|
|
|
Местны |
1. |
Высокая действующая |
При нарушении целостности кожных покровов препарат может |
|
й ЛС |
концентрация ЛС в месте |
попасть в системный кровоток – проявление нежелательных |
||
|
введения |
системных эффектов. |
||
|
2. |
Избегаются нежелательные |
|
|
|
системные эффекты данного ЛС |
|
|
|
Пресистемная элиминация ЛС (эффект первого прохождения) - процесс биотрансформации лекарства до попадания ЛС в системный кровоток. В пресистемной элиминации при пероральном введении лекарства участвуют ферментативные системы кишечника, крови воротной вены и гепатоциты.
При внутривенном введении пресистемная элиминация отсутствует.
3
Для того, чтобы перорально принимаемое ЛС оказало полезное действие, нужно увеличить его дозу для компенсации потерь.
4. Перенос лекарств через биологические барьеры и его разновидности. Основные факторы, влияющие на перенос лекарств в организме.
Способы абсорбции (транспорта) ЛС через биологические мембраны:
1)Фильтрация (водная диффузия) – пассивное перемещение молекул вещества по градиенту концентрации через заполненные водой поры в мембране каждой клетки и между соседними клетками, характерен для воды, некоторых ионов, мелких гидрофильных молекул (мочевина).
2)Пассивная диффузия (липидная диффузия) - основной механизм переноса ЛВ, процесс растворения лекарства в липидах мембраны и движение через них.
3)Транспорт при помощи специфических переносчиков – перенос ЛВ при помощи встроенных в мембрану переносчиков (чаще белков), характерен для гидрофильных полярных молекул, ряда неорганических ионов, сахаров, аминокислот, пиримидинов:
а) облегченная диффузия – осуществляется по градиенту концентрации без затраты АТФ б) активный транспорт – против градиента концентрации с затратами АТФ
Насыщаемый процесс – т.е. скорость абсорбции увеличивается лишь до тех пор, пока количество молекул лекарственного вещества не сравняется с количеством переносчиков.
4)Эндоцитоз и пиноцитоз - лекарство связывается со специальным распознающим компонентом мембраны клетки, возникает инвагинация мембраны и формируется пузырек, содержащий молекулы лекарства. Впоследствии лекарство выделяется из пузырька в клетку или транспортируется из клетки. Характерен для высокомолекулярных полипептидов.
Факторы, влияющие на перенос лекарств в организме:
1) физико-химические свойства вещества (гидро- и липофильность, ионизация, поляризуемость, размер молекул, концентрация)
2) структура барьеров переноса
3) кровоток
5. Перенос через мембраны лекарственных веществ с переменной ионизацией (уравнение ионизации Гендерсона-Гассельбальха). Принципы управления переносом.
Все ЛС - слабые кислоты или слабые основания, имеющие свои значения константы ионизации (рК). Если значение рН среды равно значению рК лекарства, то 50% его молекул будет находится в ионизированном и 50% в неионизированном состоянии и среда для лекарства будет нейтральной.
Вкислой среде (рН меньше рК), там где имеется избыток протонов, слабая кислота будет находиться в недиссоциированной форме (R-COOH), т.е. будет связана с протоном – протонирована. Такая форма кислоты незаряжена и хорошо растворима в липидах. Если рН сместиться в щелочную сторону (т.е. рН станет больше рК), то кислота начнет диссоциировать и лишится протона, перейдя при этом в непротонированную форму, которая имеет заряд и плохо растворима в липидах.
Вщелочной среде, там где имеется дефицит протонов, слабое основание будет находиться в недиссоциированной
форме (R-NH2), т.е. будет непротонировано и лишено заряда. Такая форма основания хорошо растворима в липидах и быстро абсорбируется. В кислой среде имеется избыток протонов и слабое основание начнет диссоциировать, связывая при этом протоны и образуя протонированную, заряженную форму основания. Такая форма плохо растворима в липидах и слабо абсорбируется.
Следовательно, абсорбция слабых кислот протекает преимущественно в кислой среде, а слабых
оснований – в щелочной.
Особенности метаболизма слабых кислот (СК):
1) желудок: СК в кислом содержимом желудка неионизирована, а в щелочной среде тонкого кишечника она будет диссоциациировать и молекулы СК приобретут заряд. Поэтому, абсорбция слабых кислот будет наиболее интенсивной в желудке.
2) в крови среда достаточно щелочная и всосавшиеся молекулы СК перейдут в ионизированную форму. Фильтр клубочков почек пропускает как ионизированные, так и неионизированные молекулы, поэтому, несмотря на заряд молекулы, СК будут выводиться в первичную мочу 3) если моча щелочная, то кислота останется в ионизированной форме, не сможет реабсорбироваться обратно в
кровоток и выделится с мочой; мочи кислая, то лекарство перейдет в неионизированную форму, которая легко реабсорбируется обратно в кровь.
Особенности метаболизма слабых оснований: противоположно СК (абсорбция лучше в кишечнике; в щелочной моче подвергаются реабсорбции)
Т.о., чтобы ускорить выведение из организма слабой кислоты мочу необходимо ощелачивать, а чтобы ускорить выведение слабого основания ее необходимо подкислить (детоксикация по Попову).
Количественную зависимость процесса ионизации лекарства при различном рН среды позволяет получить уравнение
Henderson-Hasselbach:
4

рК рН lg |
протониров анная форма |
, где pKa соответствует значению pH, при котором концентрации |
|
непротонир ованная форма |
|||
|
|
ионизированной и неионизированной форм находятся в равновесии.
Уравнение Гендерсона-Гассельбаха позволяет оценить степень ионизации ЛС при данном значении рН и предсказать вероятность его проникновения через клеточную мембрану.
(1) Для разбавленной кислоты, A,
HA ↔ H+ + A- , где HA – концентрация неионизированной (протонированной) формы кислоты и A- - концентрация ионизированной (непротонированной) формы.
(2) Для слабого основания, B,
BH+ ↔ H+ + B, где BH+ - концентрация протонированной формы основания, B - концентрация непротонированной формы Зная рН среды и рКа вещества, можно по вычисленному логарифму определить степень ионизации лекарства, а
значит, и степень его всасывания из желудочно-кишечного тракта, реабсорбции или экскреции почками при разных значениях рН мочи и т. д.
6. Перенос лекарств в организме. Водная диффузия и диффузия в липидах (закон Фика). Активный транспорт.
Перенос ЛС в организме может осуществляться водной и липидной диффузией, активным транспортом, эндо- и пиноцитозом.
Особености перенос ЛС в организме водной диффузией:
1.Эпителиальные покровы (слизистые ЖКТ, полости рта и др.) – водная диффузия только очень малых молекул (метанол, ионы лития и т.д.)
2.Капилляры (кроме мозговых) – фильтрация веществ с молекулярной массой до 20-30 тыс. Да.
3.Капилляры мозга – в основном не имеют водных пор, за исключением областей гипофиза, эпифиза, зоны IV желудочка, хориоидного сплетения, медианного возвышения
4.Плацента – не имеет водных пор (хотя вопрос спорный).
5.Связывание ЛС с белками крови препятствует их выходу из кровяного русла, а значит, и водной диффузии
6.Диффузия в воде зависит от размеров молекул ЛС и водных пор
Особенности липидной диффузии:
1.Основной механизм переноса ЛС через клеточные мембраны
2.Определяется липофильностью диффундируемого вещества (т.е. коэффициентом распределения «масло/вода») и градиентом концентрации, может быть ограничена очень низкой растворимостью вещества в воде (что препятствует проникновению ЛС в водную фазу мембран)
3.Легко диффундируют неполярные соединения, трудно – ионы.
Любая диффузия (и водная, и в липидах) подчиняется закону диффузии Фика:
Скоростьдиффузии (С1 С2 ) коэф. переноса площадьмембраны толщинамембраны , где
Скорость диффузии – количество переносимых в единицу времени молекул лекарства; С1 - концентрация вещества снаружи мембраны;С2 - концентрация вещества изнутри мембраны.
Следствие из закона Фика:
1)фильтрация ЛС тем выше, чем больше площадь поверхности в месте введения {S абсорбируемой поверхности в кишечнике больше, чем в желудке, поэтому абсорбция ЛС в кишечника более быстрая}
2)фильтрация ЛС тем выше, чем больше концентрация ЛС в месте введения
3)фильтрация ЛС тем выше, чем меньше толщина преодолеваемой биологической мембраны {толщина барьера в альвеолах легких значительно меньше, чем кожи, поэтому скорость абсорбции выше в легких}
Активный транспорт – перенос ЛC независимо от градиента концентрации с использованием энергии АТФ, характерен для гидрофильных полярных молекул, ряда неорганических ионов, сахаров, аминокислот, пиримидинов. Характеризуется: а) избирательностью к определенным соединениям б) возможностью конкуренции двух веществ за один транспортный механизм в) насыщаемостью при высоких концентрациях вещества г) возможностью транспорта против градиента концентрации д) затратой энергии.
7. Центральный постулат фармакокинетики: концентрация лекарства в крови – основной параметр для управления терапевтическим эффектом. Задачи, решаемые на основании знания этого постулата.
Центральный постулат (догма) фармакокинетики: концентрация ЛВ в плазме крови детерминирует (количественно определяет) фармакологический эффект.
В большинстве случаев скорость всасывания, распределения, метаболизма и экскреции ЛС пропорциональна их концентрации в плазме крови (подчиняется закону действующих масс), поэтому зная ее возможно:
1)определить период полуэлиминации (для ЛС с кинетикой первого порядка)
2)объяснить длительность некоторых токсических эффектов ЛС (для ЛС в высоких дозах с кинетикой насыщения)
3)рассчитать загрузочную и поддерживающие дозы ЛС, необходимые для обеспечения адекватного терапевтического действия
5
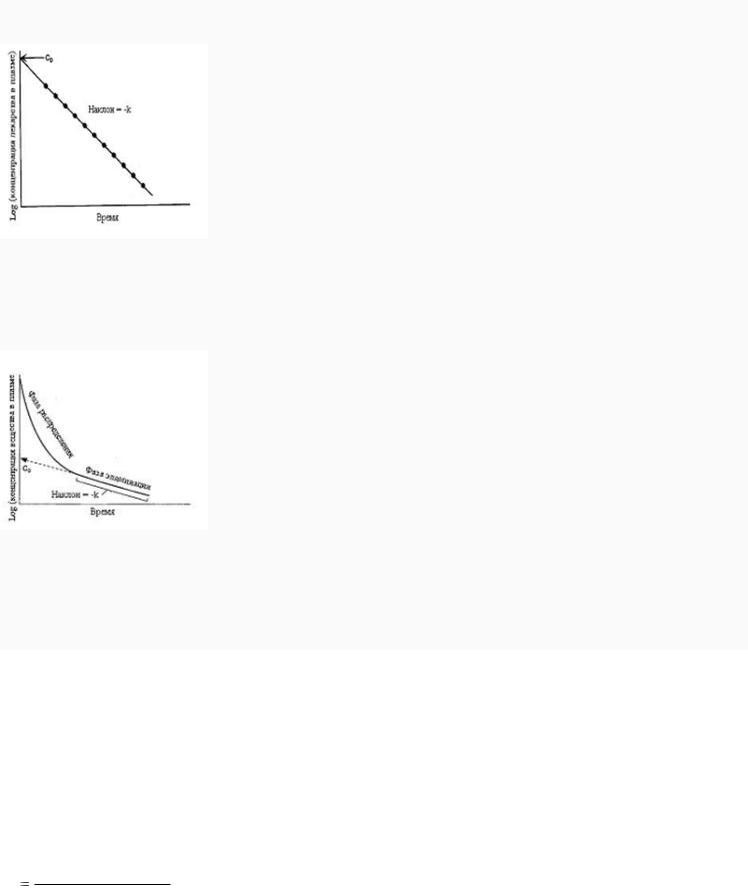
8. Фармакологические модели (однокамерная, двухкамерная), количественные законы всасывания и распределения.
Фармакокинетические модели (однокамерная и двухкамерная), количественные законы всасывания и элиминации лекарств.
Однокамерная модель.
Весь организм – единый однородный контейнер. Допущения:
1)устанавливается быстрое динамическое развитие между содержанием препарата в кровяном русле и его концентрацией в экстраваскулярных тканях
2)ЛС быстро и равномерно распределяется по всему объему крови
3)Элиминация ЛС подчиняется кинетике первого порядка: скорость уменьшения содержания препарата в крови пропорциональна его концентрации
Если механизмы для устранения лекарственного средства (биотрансформация в печени, почечная секреция) не насыщены при введении терапевтической дозы,
логнормальный график изменения плазменной концентрации во времени будет линеен.
Наклон логнормальной оси - Kel, где Kel - постоянная скорости элиминации и имеет размерность время-1. Значение С0 получается экстраполяцией графика до пересечения с осью ординат. Плазменная концентрация ЛВ (Ct) в любое время t после введения в организм составляет:
Ln Ct = Ln C0 – kt. Константа элиминации Kel, Vd, и общий клиренс (CL) связаны выражением: CL = k × Vd
Двухкамерная модель.
Часто после поступления ЛС в организм не удается быстро достичь равновесия между содержанием ЛС в крови и его концентрацией в экстраваскулярной жидкости. Тогда полагают, что в совокупности тканей и биологических жидкостей организма можно выделить две камеры, которые отличаются степенью доступности для проникновения ЛС. К центральной камере относится кровь (часто с интенсивно перфузируемыми органами – печень, почки), к периферической – интерстициальная жидкость внутренних органов и тканей.
Результирующий график показывает начальную Фазу распределения (Время, требуемое ЛС для достижения равновесного состояния между центральной и периферической камерами и следующую за ней медленную Фазу элиминацииПервого порядка.
Значение С0, получается экстраполяцией Фазы элиминации до пересечения с осью ординат. С0 используется для вычисления объема распределения и константы элиминации. Формулы для расчета Сt и Cl, приведенные для однокамерной модели, также применяются в течение фазы элиминации для препаратов, которые удовлетворяют условиям модели с двумя камерами.
9. Биодоступность лекарств – определение, сущность, количественное выражение, детерминанты. Понятие о биодоступности
Биодоступность (F) – характеризует полноту и скорость всасывания ЛС при внесистемных путях введения - отражает количество неизмененного вещества, которое достигло системного кровотока, относительно исходной дозы препарата.
F составляет 100% для ЛС, которые вводят внутривенно. При введении другими путями F обычно меньше из-за неполной абсорбции и частичного метаболизма в периферических тканях. F равна 0, если ЛС не всасывается из просвета ЖКТ.
Для оценки F строят кривую зависимости концентрации ЛС в крови от времени после его введения внутривенно, а также после введения исследуемым путем. Это т.н. фармакокинетические кривые зависимости «время-концентрация». Путем интегрирования находят значения площади под фармакокинетической кривой и рассчитывают F как отношение:
F |
AUC _ per _ os |
≤ 1, где AUC – площадь под фармакокинетической кривой (Area Under Curve) |
AUC _ внутривенно |
Биодоступность > 70% считается высокой, ниже 30% - низкой. Детерминанты биодоступности:
1)скорость всасывания
2)полнота всасывания - недостаточная абсорбция ЛС вследствие его очень высокой гидрофильности или липофильности, метаболизма бактериями кишечника при энтеральном введении и т.д.
6

3)пресистемная элиминация – при высокой F, биотрансформация ЛС в печени низкая (нитроглицерин при пероральном введении).
4)лекарственная форма - сублингвальные таблетки и ректальные суппозитории помогают ЛС избежать пресистемной элиминации.
10. Распределение лекарств в организме. Отсеки, лиганды. Основные детерминанты распределения.
Распределение ЛС - процесс распространения ЛС по органам и тканям после того, как они поступят в системный кровоток.
Отсеки распределения:
1.Внеклеточное пространство (плазма, межклеточная жидкость)
2.Клетки (цитоплазма, мембрана органелл)
3.Жировая и костная ткань (депонирование ЛС)
Учеловека массой 70 кг объемы жидких сред составляют в целом 42 л, тогда если:
Vd=3-4 л, то все лекарство распределено в крови;
Vd= 4-14 л, то все лекарство распределено во внеклеточной жидкости;
Vd=14-42 л, то все лекарство приблизительно равномерно распределено в организме;
Vd>42 л, то все лекарство находится преимущественно во внутриклеточном пространстве.
Молекулярные лиганды ЛС:
а) специфические и неспецифические рецепторы б) белки крови (альбумин, гликопротеин) и тканей в) полисахариды соединительной ткани г) нуклеопротеиды (ДНК, РНК)
Детерминанты распределения:
Природа ЛС - чем меньше размеры молекулы и липофильнее ЛС, тем быстрее и равномернее его распределение.
Размер органов – чем больше размер органа, тем больше лекарственного средства может поступить в него без существенного изменения градиента концентраций
Кровоток в органе - в хорошо перфузируемых тканях (мозг, сердце, почки) терапевтическая концентрация вещества создается значительно раньше, чем в тканях плохо перфузируемых (жировая, костная)
Наличие гистогематических барьеров – ЛС легко проникают в ткани с плохо выраженным ГГБ
Связывание лекарства с белками плазмы - чем больше связанная фракция ЛС, тем хуже его распределение в ткани, т.к. покидать капилляр могут лишь свободные молекулы.
Депонирование лекарства в тканях - связывание ЛС с белками тканей способствует его накоплению в них, т.к. снижается концентрация свободного ЛС в периваскулярном пространстве и постоянно поддерживается высокий градиент концентраций между кровью и тканями.
Количественной характеристикой распределения лекарства является кажущийся объем распределения (Vd). Кажущийся объем распределения Vd – это гипотетический объем жидкости, в котором может распределиться вся введенная доза лекарства, чтобы создалась концентрация, равная концентрации в плазме крови.
Vd равен отношению введенной дозы (общего количества лекарства в организме) к его концентрации в плазме крови:
Vd |
доза лекарства,мг |
||
|
|
||
концентрация в плазме,мг/л . |
|||
|
|||
Чем больше кажущийся объем распределения, тем большая часть лекарств распределяется в ткани.
11. Константа элиминации, ее сущность, размерность, связь с другими фармакокинетическими параметрами.
Константа скорости элиминации (kel, мин-1) – показывает, какая часть ЛС элиминируется из организма в единицу
времени Kel = Aвыд/Аобщ, где Авыд – количество ЛС, выделяемое в ед. времени, Аобщ – общее количество ЛС в организме.
Значение kel обычно находят путем решения фармакокинетического уравнения, описывающего процесс элиминации лекарства из крови, поэтому kel называют модельным показателем кинетики. Непосредственного отношения к планированию режима дозирования kel не имеет, но ее значение используют для расчета других фармакокинетических параметров.
Константа элиминации прямо пропорциональна клиренсу и обратно пропорционально объему распределения (из определения клиренса): Kel=CL/Vd; [Ke] = час-1/мин-1=доля в час.
12. Период полувыведения лекарств, его сущность, размерность, взаимосвязь с другими фармакокинетическими параметрами.
7

Период полуэлиминации (t½, мин) – это время, необходимое для снижения концентрации ЛС в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов.
Период полуэлиминации определяют по формуле:
t1 2 |
ln 2 |
|
ln 2 Vd |
kel |
|
Cl |
|
|
|
Период полувыведения – важнейший фармакокинетический параметр, позволяющий:
а) рассчитать время наступления равновесной концентрации (равно 5 периодам полуэлиминации) б) определить время полной элиминации препарата в) предсказать концентрацию ЛС в любой момент времени (для ЛС с кинетикой первого порядка)
13. Клиренс как главный параметр фармакокинетики для управления режимом дозирования. Его сущность, размерность и связь с другими фармакокинетическими показателями.
Клиренс (Cl, мл/мин) - объем крови, который очищается от ЛС за единицу времени.
Т.к. плазма (кровь) - «видимая» часть объема распределения, то клиренс – фракция объема распределения, из которой лекарство выделяется в единицу времени. Если обозначить общее количество лекарства в организме через Аобщ, а количество, которое выделилось через Авыд, то :
Cl 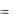 Авыд Vd
Авыд Vd
Аобщ
С другой стороны, из определения объема распределения следует, что общее количество лекарства в организме составляет Аобщ=Vd Cтер/плазма. Подставляя это значение в формулу клиренса, мы получим:
Cl |
Авыд |
|
скорость выделения |
Стер / плазма |
|
Стер/плазма |
|
|
|
Таким образом, клиренс – отношение скорости выведения лекарственного средства к его концентрации в плазме крови.
В таком виде формулу клиренса используют для расчета поддерживающей дозы лекарства (Dп), т.е той дозы лекарственного средства, которая должна скомпенсировать потерю лекарства и поддержать его уровень на постоянном уровне:
Скорость введения = скорость выведения = Cl Cтер (доза/мин)
Dп = скорость введения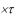 (
(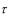 - интервал, между приемом лекарства)
- интервал, между приемом лекарства)
Клиренс аддитивен, т.е. элиминация вещества из организма может происходить с участием процессов, идущих в
почках, легких, печени и других органах: Clсистемный = Clпочечн. + Clпечени + Clдр.
Клиренс связан с периодом полуэлиминации ЛС и объемом распределения: t1/2=0,7*Vd/Cl.
14. Доза. Виды доз. Единицы дозирования лекарственных средств. Цели дозирования лекарств, способы и варианты введения, интервал введения.
Действие ЛС на организм в большей степени определяется их дозой.
Доза - количество вещества, введенное в организм за один прием; выражается в весовых, объемных или условных (биологических) единицах.
Виды доз:
а) разовая доза – количество вещества на один прием б) суточная доза - количество препарата, назначаемое на сутки в один или несколько приемов
в) курсовая доза - общее количество препарата на курс лечения г) терапевтические дозы - дозы, в которых препарат используют с лечебными или профилактическими целями
(пороговые, или минимальные действующие, средние терапевтические и высшие терапевтические дозы).
д) токсические и смертельные дозы – дозы ЛВ, при которых они начинают оказывать выраженные токсические эффекты или вызывать смерть организма.
е) загрузочная (вводная) доза – кол-во вводимого ЛС, которое заполняет весь объем распределения организма в действующей (терапевтической) концентрации: ВД = (Css * Vd)/F
ж) поддерживающая доза – систематически вводимое количество ЛС, которое компенсирует потери ЛС с клиренсом:
ПД = (Css * Cl * T)/F
Единицы дозирования ЛС:
1)в граммах или долях грамма ЛС
2)количество ЛС в расчете на 1 кг массы тела (например, 1 мг/кг) или на единицу поверхности тела (например,
1 мг/м2)
Цели дозирования ЛС:
1)определить количество ЛС, необходимое для того, чтобы вызвать нужный терапевтический эффект с определенной длительностью
2)избежать явлений интоксикации и побочных эффектов при введении ЛС
Способы введения ЛС: 1) энтерально 2) парентерально (см. в. 3)
8
Варианты введения ЛС:
а) непрерывный (путем длительных внутрисосудистых инфузий ЛС капельно или через автоматические дозаторы). При непрерывном введении ЛС его концентрация в организме изменяется плавно и не подвергается значительным колебаниям
б) прерывистое введение (инъекционным или неинъекционным способами) - введение лекарства через определенные промежутки времени (интервалы дозирования). При прерывистом введении ЛС его концентрация в организме непрерывно колеблется. После приема определенной дозы она вначале повышается, а затем постепенно снижается, достигая минимальных значений перед очередным введением лекарства. Колебания концентрации тем значительнее, чем больше вводимая доза лекарства и интервал между введениями.
Интервал введения – интервал между вводимыми дозами, обеспечивающий поддержание терапевтической концентрации вещества в крови.
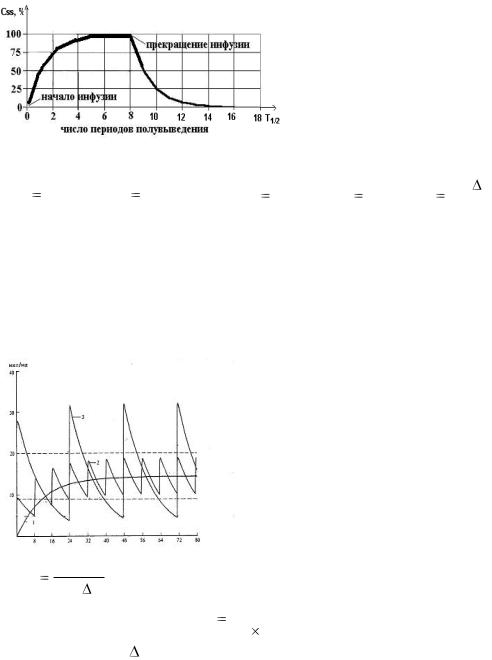
15. Введение лекарств с постоянной скоростью. Кинетика концентрации препарата в крови. Стационарная концентрация препарата в крови (Css), время ее достижения, расчет и управление ею.
Особенность введения ЛС с постоянной скоростью - плавное изменение его концентрации в крови при введении, при этом:
1)время достижения стационарной концентрации лекарства
составляет 4-5t½ и не зависит от скорости инфузии (величины вводимой дозы)
2)при увеличении скорости инфузии (вводимой дозы) величина СSS также увеличивается в пропорциональное число раз
3)элиминация лекарства из организма после прекращения инфузии занимает 4-5t½.
Сss – равновесная стационарная концентрация – концентрация ЛС, достигаемая при скорости введения равной скорости выведения, поэтому:
Cl |
скор. _ элим |
скор. _ введ |
; Css |
скор _ введ |
|
D / время |
|
D / T |
(из определения клиренса) |
|
|
|
|
Cl |
|
Cl |
|
Cl |
|||
|
[конц] |
Css |
|
|
|
|||||
За каждый последующий период полувыведения концентрация ЛС прирастает на половину от оставшейся концентрации. Все ЛС, подчиняющиеся закону элиминации первого порядка, будут достигать Css через 4-5 периодов полувыведения.
Подходы к управлению уровнем Сss: изменить вводимую дозу ЛС или интервал введения
16. Прерывистое введение лекарств. Кинетика концентрации препарата в крови, терапевтический и токсический диапазон концентраций. Расчет стационарной концентрации (C ss), границ ее колебаний и управление ею. Адекватный интервал введения дискретных доз.
Колебания концентрации ЛС в плазме крови: 1 - при постоянном внутривенном капельном введении; 2 —при дробном введении той же суточной дозы с интервалом 8 ч;3 — при введении суточной дозы с интервалом 24 ч.
Прерывистое введение ЛС – введение определенного количества ЛС через некоторые промежутки времени.
Равновесная стационарная концентрация достигается через 4-5 периодов полуэлиминации, время ее достижения не зависит от дозы (в начале, когда уровень концентрации ЛС невысок, скорость его элиминации также невысока; по мере увеличения количества вещества в организме нарастает и скорость его элиминации, поэтому рано или поздно наступит такой момент, когда возросшая скорость элиминации уравновесит вводимую дозу ЛС и дальнейший рост концентрации прекратиться)
Css |
ПД |
,Css прямо пропорциональна дозе ЛС и обратно пропорциональна интервалу введения и клиренсу ЛС. |
Cl * T |
Границы колебаний Css: Сssmax |
|
ПД |
; Cssmin = Cssmax × (1 – эл. фр.). Колебания концентрации ЛС |
|
|
|
|
||
|
|
|
||
Vd |
эл.фр |
|
||
пропорциональны T/t1/2.
Терапевтический диапазон (коридор безопасности, терапевтическое окно) – это интервал концентраций от минимальной терапевтической до вызывающей появление первых признаков побочных действий.
Токсический диапазон – интервал концентрации от высшей терапевтической до смертельной.
Адекватный режим введения дискретных доз: такой режим введения, при котором флюктуация концентрации препарата в крови укладывается в терапевтический диапазон. Для определения адекватного режима введения ЛС терапевтический диапазон необходимо рассчитать. (Cssmax -Cssmin ) при этом не должна превысить 2Css.
Управление колебаниями Css:
Размах колебаний Css прямо пропорционален дозе ЛС и обратно пропорционален интервалу его введения.
1. Изменить дозу ЛС: при увеличении дозы ЛС диапазон колебаний его Css пропорционально увеличивается
9

2.Изменить интервал введения ЛС: при увеличении интервала введения ЛС диапазон колебаний его Css пропорционально уменьшается
3.Одновременно изменить дозу и интервал введения
17. Вводная (загрузочная) доза. Терапевтический смысл, расчет по фармакокинетическим параметрам, условия и ограничения ее использования.
Вводная (загрузочная) доза – доза, вводимая за один прием и заполняющая весь объем распределения в действующей терапевтической концентрации. ВД=(Css*Vd)/F ; [Css]=мг/л, [Vd]=л/кг
Терапевтический смысл: вводная доза быстро обеспечивает действующую терапевтическую концентрацию ЛС в крови, что позволяет, например, быстро купировать приступ БА, аритмии и т.д.
Вводная доза может быть введена за один раз лишь тогда, когда игнорируется процесс распределения
вещества Ограничение использования ВД: если распределение ЛС происходит значительно медленнее, чем его
поступление в кровь, введение сразу всей загрузочной дозы (особенно внутривенно) создаст концентрацию значительно выше терапевтической и обусловит возникновение токсических эффектов.
Условие использования ВД: поэтому введение нагрузочных доз всегда должно быть медленным или дробным.
18. Поддерживающие дозы, их терапевтический смысл и расчет для оптимального режима дозирования.
Поддерживающая доза – доза ЛС, вводимая систематически, которая заполняет объем клиренса, т.е. тот фрагмент Vd, который очищается от ЛС за интервал T: ПД=(Css*Cl* T)/F.
Терапевтический смысл: ПД компенсирует потери с клиренсом за интервал между введениями препарата. Расчет для оптимального дозирования ЛС (для быстрого купирования приступа):
1.Рассчитываем ВД: ВД=(Css*Vd)/F
2.Выбираем интервал введения T (обычно большинство ЛС назначается с интервалом, близким к t1/2) и рассчитываем ПД: ПД=(Css*Cl* T)/F
3.Проверяем, не выходят ли колебания ЛС в крови за пределы терапевтического диапазона путем расчета Cssmax и
Сss : |
Сss |
max |
|
ПД |
; C min = C |
max × (1 – эл. фр.). Разница между Css |
max |
и Сss |
min |
не должна превышать двух |
||
min |
Vd |
эл.фр |
ss |
ss |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||
Css. |
|
|
|
|
|
|
|
|
|
|
|
|
Элиминируемая фракция находится по графику (см. в.15) или по формуле: эл.фр. |
1 0,5 |
T / t1 / 2 |
||||||||||
|
||||||||||||
4. Если при выбранном нами интервале введения ЛС его колебания выходят за пределы терапевтического диапазона, меняем T и повторяем расчет (пункт 2 – пункт 4)
NB! Если ЛС не предназначено для купирования неотложных состояний или принимается в таблетках, ВД не рассчитывается.
19. Индивидуальные, возрастные и половые различия фармакокинетики лекарств. Поправки для расчета индивидуальных значений объема распределения лекарств.
1. Возрастные различия фармакокинеткики лекарств.
Дети |
|
Пожилые |
|
1. Роговой слой кожи тоньше, поэтому при накожном применении ЛС |
1. Отмечается снижение концентрации |
||
всасываются лучше. Абсорбция ЛС при ректальном применении также |
альбумина в плазме крови и фракция |
||
лучше. |
лекарства, связанная с белком |
||
2. Объем жидкости в организме детей 70-80%, тогда как у взрослых |
2. Уменьшается содержание воды в |
||
только 60%, поэтому Vd гидрофильных ЛС у них больше и требуются |
организме с 60% до 45%, поэтому |
||
более высокие дозы. |
увеличивается кумуляция липофильных |
||
3. У новорожденного уровень альбумина в плазме ниже, чем у взрослых, |
лекарств. |
|
|
поэтому связывание ЛС с белком у них менее интенсивное |
3. Скорость |
клубочковой |
фильтрации |
4. У новорожденных низкая интенсивность систем цитохрома Р450 и |
может падать до 50-60% от скорости |
||
конъюгирующих ферментов, но высокая активность метилирующих |
зрелого пациента, поэтому почечная |
||
систем. |
элиминация |
лекарств |
резко |
5. Скорость клубочковой фильтрации в почках детей до 6 мес составляет |
ограничивается. |
|
|
30-40% скорости взрослых, поэтому почечная эксркеция лекарств |
|
|
|
снижена. |
|
|
|
2. Половые различия в действии лекарств. Для женщин характерна меньшая масса тела, чем для мужчин, поэтому и величина доз лекарства для них должна находиться, как правило, у нижней границы диапазона терапевтических доз. 3. Патологические состояния организма и действие лекарств
а) заболевания печени:  F ЛС из-за выключения пресистемного метаболизма,
F ЛС из-за выключения пресистемного метаболизма,  фракция несвязанного ЛС из-за недостатка синтеза альбуминов, пролонгируются эффекты ЛС из-за их биотрансформации.
фракция несвязанного ЛС из-за недостатка синтеза альбуминов, пролонгируются эффекты ЛС из-за их биотрансформации.
б) патология почек: замедляется элиминация ЛС, которые выводятся через почки 4. Генетические факторы – дефицит тех или иных ферментов метаболизма ЛС может способствовать пролонгированию их действия (псевдохолинэстераза и т.д.)
Поправки для расчета индивидуальных значений объема распределения ЛС:
10
