
- •Молекулярная биофизика.
- •1.1. Физическая иерархия биосистем.
- •1.2. Атомарный состав живых систем.
- •1.3. Аминокислоты.
- •1.4. Нуклеиновые кислоты (нк).
- •Общая схема строения цепи:
- •1.5. Углеводы и липиды.
- •Функции полисахаридов:
- •1.6. Кофакторы. Витамины. Гормоны.
- •2. Пространственная организация биополимеров.
- •2.1. Объемные взаимодействия и переходы глобула - клубок.
- •2.2. Гибкость биополимеров
- •2.3. Объёмное взаимодействие. Переходы глобула - клубок в биополимерах.
- •2.4. Условия существования клубка и глобулы.
- •2.5. Различные типы взаимодействия в макромолекулах.
- •2.6. Ван-дер-ваальсовые (вв) силы.
- •2.7. Ориентационное взаимодействие.
- •2.8. Индукционное взаимодействие.
- •2.9. Дисперсионное взаимодействие.
- •2.10. Водородная связь и электростатические взаимодействия.
- •2.11. Физическая природа водородной связи.
- •2.12. Электростатические взаимодействия.
- •3.Элементы биофизики белка.
- •3.1. Биологические функции белков.
- •3.2. Основные задачи биофизики белка
- •3.3. Конформация полипептидной цепи.
- •3.4. Структура воды и гидрофобные взаимодействия.
- •3.5. Гидрофобные взаимодействия и структуры белков.
- •3.6. Связывание лигандов с макромолекулами.
- •Уравнение Хилла
- •3.7.Гемолиз
2.5. Различные типы взаимодействия в макромолекулах.
Первичная структура или основная последовательность биополимеров определяется химическими или валентными взаимодействиями. Помимо этого между молекулами действуют слабые невалентные силы, которые приводят к притяжению на больших расстояниях и отталкиванию на малых. Типичная зависимость потенциальной энергии взаимодействия U(r)двух частиц молекулярной природы можно представить в виде:
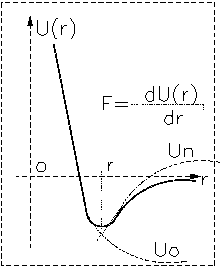
При малых расстояниях преобладает сила отталкивания, и Fотталк >0, при большихrпреобладает сила притяжения. Общую энергию можно представить в виде:
U(r)=Uотт(r)-Uпритяж(r).
Минимум на графике соответствует равновесию.
2.6. Ван-дер-ваальсовые (вв) силы.
ВВ силы играют важнейшую роль в образовании конденсированных жидких и твёрдых состояний. Ими определяются взаимодействия газов и возникающие отклонения законов идеальных газов. Эти отклонения подчиняются уравнению Ван-дер-Ваальса для газов:
![]() ,
,
где a, b- константы притяжения и отталкивания;V-объем.
Биомакромолекулы можно рассматривать как своего рода конденсируемые системы, состояния которых определяются относительно слабых невалентных взаимодействий. Именно такие взаимодействия дают основной вклад к стабилизации конденсации состояния биополимеров и его изменения в процессе функционирования. Значения энергии при ВВ взаимодействиях лежат в интервале 4-8 кДж/моль и выше. Энергия при комнатной (температуре) составляет 2,5 кДж/моль, а энергия коллективных ионных связей составляет 150 -600 кДж/моль.
Силы ВВ имеют электромагнитную природу и определяются взаимодействием электрических диполей молекул. В зависимости от того, обладает ли взаимодействие молекулы электрическим дипольным моментом, или последнее возникает вследствие поляризации оболочек, существуют различные типы сил ВВ.
- коэффициент ионизации раствора макромолекул,
I - ионная сила раствора
2.7. Ориентационное взаимодействие.
Рассмотрим энергию взаимодействия диполей, расположенных простейшим образом. При этом расстояние между диполями R много больше их размеров.

Найдем энергию их взаимодействия:
![]() ,
,

Энергия взаимодействия двух диполей является функцией квадратичных, а не линейных членов, следовательно:
 .
.
Разложим в ряд Тейлора:
 .
.
![]()
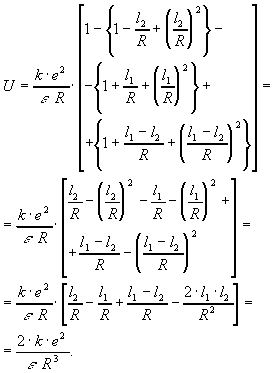
Имеем:
![]() .
.
Если диполи свободны и совершают тепловое движение, то в среднем они будут принимать ориентации, соответствующие притяжению (так как в этом случае энергия их взаимодействия понижается). Вероятность взаимного расположения диполей зависит от их энергий, и в равновесии описывается законом Больцмана.
Расчет дает:
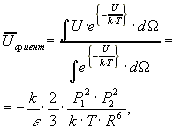
где ![]() телесный
угол.
телесный
угол.
![]()
2.8. Индукционное взаимодействие.
Когда одна из молекул имеет постоянный
дипольный момент, она наводит (индуцирует)
дипольный момент Р2другой
молекуле, причем эта индукция не зависит
от того, имеет ли молекула постоянный
момент. Из электродинамики известно,
чтоP2=![]() E1(E1- напряженность поля, создаваемое
первой молекулой в точке второй
молекулы;
E1(E1- напряженность поля, создаваемое
первой молекулой в точке второй
молекулы;![]() - поляризуемость). Расчеты показывают,
что в этом случае энергия индукционного
взаимодействия определяется формулой:
- поляризуемость). Расчеты показывают,
что в этом случае энергия индукционного
взаимодействия определяется формулой:
![]() .
.
В жидких и твердых телах поляризуемая молекула испытывает симметричное влияние большого количества соседних молекул, при этом результат их действия сильно компенсирует индукционное взаимодействие. Это приводит к тому, что реальное индукционное взаимодействие:
![]() .
.
