
- •Молекулярная биофизика.
- •1.1. Физическая иерархия биосистем.
- •1.2. Атомарный состав живых систем.
- •1.3. Аминокислоты.
- •1.4. Нуклеиновые кислоты (нк).
- •Общая схема строения цепи:
- •1.5. Углеводы и липиды.
- •Функции полисахаридов:
- •1.6. Кофакторы. Витамины. Гормоны.
- •2. Пространственная организация биополимеров.
- •2.1. Объемные взаимодействия и переходы глобула - клубок.
- •2.2. Гибкость биополимеров
- •2.3. Объёмное взаимодействие. Переходы глобула - клубок в биополимерах.
- •2.4. Условия существования клубка и глобулы.
- •2.5. Различные типы взаимодействия в макромолекулах.
- •2.6. Ван-дер-ваальсовые (вв) силы.
- •2.7. Ориентационное взаимодействие.
- •2.8. Индукционное взаимодействие.
- •2.9. Дисперсионное взаимодействие.
- •2.10. Водородная связь и электростатические взаимодействия.
- •2.11. Физическая природа водородной связи.
- •2.12. Электростатические взаимодействия.
- •3.Элементы биофизики белка.
- •3.1. Биологические функции белков.
- •3.2. Основные задачи биофизики белка
- •3.3. Конформация полипептидной цепи.
- •3.4. Структура воды и гидрофобные взаимодействия.
- •3.5. Гидрофобные взаимодействия и структуры белков.
- •3.6. Связывание лигандов с макромолекулами.
- •Уравнение Хилла
- •3.7.Гемолиз
3.5. Гидрофобные взаимодействия и структуры белков.
Все аминокислотные остатки, входящие в состав полипептидной цепи условно разделяются на две группы:
-неполярные (гидрофобные)
-полярные (гидрофильные)
Степень гидрофобности остатка определяют по разности свободных энергий растворения аминокислоты в слабополярном растворителе и воде (обычно используют этиловый спирт).
Полученные таким образом величины разностей свободных энергий, приходящихся на белковую группу аминокислоты при переносе из спирта в воду, приведены в таблице:
|
Степень гидрофобности аминокислотных остатков | |||||
|
Гидрофобные
|
Три |
Иле |
Тир |
Фен |
Про |
|
12.50 |
12.40 |
12.00 |
11.10 |
10.85 | |
|
Гидрофобные
|
Лей |
Вал |
Лиз |
Гис |
Нет |
|
10.10 |
7.06 |
6.27 |
5.85 |
5.45 | |
|
Гидрофильные
|
Ала |
Арг |
Цис |
Глу |
Асп |
|
3.05 |
3.05 |
2.71 |
2.50 |
2.26 | |
|
Гидрофильные
|
Тре |
Сер |
Гли |
Асн |
Глн |
|
1.84 |
0.17 |
0.00 |
-0.04 |
-0.42 | |
Названия остатков: глицил, аланил, валил, лейцил, изолейцил (иле), фенилаланил (фен), пролил, тритофонил (три), серил (сер), треонил (тре), метионил (мет), аспарагинил (асп), глутаминил (глн), цистинил, аспаргил, глутамил (глу), тирозил, гистидил (гис), лизил (лиз), аргинил (арг).
Гипотеза об определяющей роли гидрофобных взаимодействий была доказана в 1944 году. Идея состояла в том, что гибкая молекула белка в воде сворачивается в глобулу (поскольку полярные остатки белка стремятся к максимальному контакту с водным окружением, а неполярные - к минимальному контакту). Из геометрии известно, что минимальной поверхностью при заданном объеме обладает шар. Стремление неполярных остатков образовать внутри белковой части некое подобие шарообразной капли, а полярных - сосредоточиться на ее поверхности, и приводит к образованию компактного тела - глобулы с гидрофобным ядром и гидрофильной поверхностью.
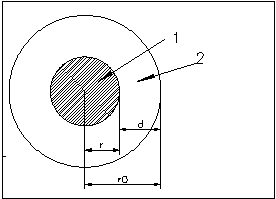
1 - гидрофобное ядро
2 - гидрофильная оболочка
В 1964 году Фишер установил, что, зная общее число аминокислотных остатков в ядре и отношение полярных остатков к неполярным, можно предсказать форму глобулы. Для простоты будем считать, что все остатки имеют одинаковые объемы. Найдем отношение числа полярных остатков к неполярным, которое обозначим bs. Будем считать , что радиус глобулыr0, и глобула покрыта мономолекулярным слоем полярных остатков толщиной d (Фишер считал, чтоd~4-5A). При сделанных допущениях отношение числа полярных и неполярных остатков равно отношению объемов сферического слоя и центрального ядра:

Следовательно, чем меньше r0,тем больше должна быть относительная гидрофильность белка. На рисунке приведена теоретическая кривая (кривая Фишера) значений параметраbот объема глобулы (V=4/3r03), а также экспериментальные значения.
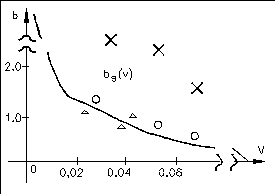
Глобула может быть сферической, строго говоря, лишь при b=bs (соответствует кривой Фишера на графике). Еслиb>bs, то есть число полярных остатков в белке больше, чем необходимо для того, чтобы покрыть гидрофобное ядро гидрофильным слоем, то глобула вытягивается в виде эллипсоида и имеет большую поверхность, чем в случае сферы.
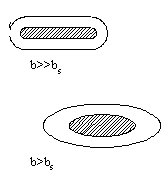
b>>bsвозникают фибриллярные структуры ( обозначено x на графике)
b<bsгидрофильные остатки не полностью закрывают гидрофобное ядро и гидрофобное взаимодействие между такими открытыми участками приводит к агрегации белков и возникновению надмолекулярных структур (обозначено на графике).

Таким образом, белки, для которых значения bлежат выше кривой Фишера, представляют собой эллипсоиды и фибриллы, значения лежат на кривой представляют собой глобулы. Под кривой располагаются белки, образующие надмолекулярную структуру. Формирование гидрофобного ядра в глобулярных белках имеет принципиальное значение для их функционирования. Белки при их огромной молекулярной массе обладают сравнительно компактной структурой прежде всего, благодаря гидрофобным взаимодействиям.
