
- •Содержание
- •Глава I почки: почечные камни
- •Глава II обмен натрия и воды
- •Глава III обмен калия: лечение диуретиками
- •Глава IV гомеостаз ионов водорода:
- •Глава V гипоталамус и гипофиз
- •Глава VI кора надпочечников: актг
- •Глава VII половые железы: гонадотропины, пролактин
- •1. Тестирование в течение ночи (для диагностики синдрома Кушинга)
- •2. Тестирование с применением высокой дозы (для идентификации причины диагностированного синдрома Кушинга)
- •Функции щитовидной железы: ттр
- •Глава IX обмен углеводов и его взаимосвязи
- •Липиды и липопротеиды плазмы крови
- •Глава XI обмен кальция, фосфатов и магния
- •Глава XII всасывание в кишечнике: функции поджелудочной железы и желудка
- •Глава XIII заболевания печени и желчные камни
- •Глава XIV белки мочи и плазмы крови
- •Глава XV ферменты плазмы крови в диагностике
- •Глава XVI врожденные нарушения обмена веществ
- •Глава XVII обмен пуринов и солей мочевой кислоты
- •Глава XVIII обмен железа
- •Глава XIX порфирии
- •Глава XX витамины
- •Глава XXI беременность и терапия пероральными контрацептивами
- •Глава XXII биохимические эффекты новообразовании
- •Глава XXIII спинномозговая жидкость
- •Глава XXIV мониторинг лекарственных средств
- •Глава XXV вклад клинициста в повышение информативности результатов лабораторных исследований
- •Глава XXVI запросы на выполнение анализов и интерпретация полученных результатов
Липиды и липопротеиды плазмы крови
Взаимосвязь между атеросклерозом, а также ишемической болезнью сердца и нарушениями свойств липидов плазмы стимулировала многие исследования в этой области. Современные представления о физиологии и патологии липидов плазмы основаны на концепции о липопротеинах, в виде которых липиды находятся в циркулирующей крови. В первой части этой главы мы останавливаемся на современной терминологии и классификациях липидов и липопротеинов плазмь!.
ТЕРМИНОЛОГИЯ И КЛАССИФИКАЦИЯ
Липиды плазмы
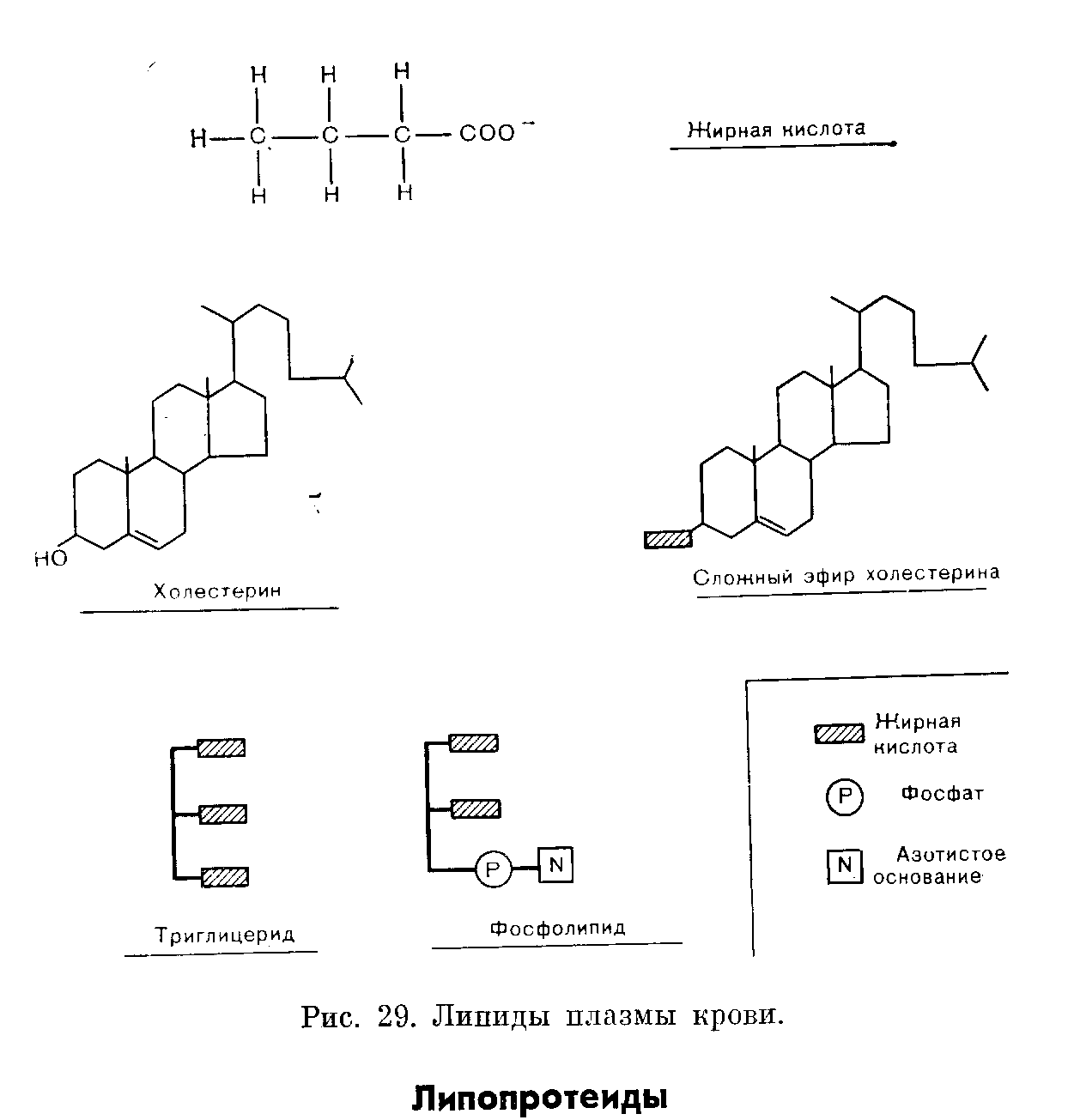
На рис. 29 представлены химические формулы четырех типов липидов, имеющихся в плазме.
Жирные кислоты представляют собой соединения, молекулы которых содержат углеводородные цепи различной длины. Они могут быть насыщенными (не содержащими двойных связей) или ненасыщенными (с двумя и более двойными связями). В плазме из числа насыщенных жирных кислот преобладают пальмитиновая (16 углеродных атомов) и стеариновая (18 углеродных атомов). Жирные кислоты могут подвергаться этерификации глицерином с образованием глицеридов, или оставаться свободными, В последнем случае их называют свободными жирными кислотами (СЖК) или неэтерифицированными жирными кислотами (НЭЖК). В крови СЖК преимущественно находятся в связанной с альбумином форме. Свободные жирные кислоты, представляя собой легко доступный источник энергии, в значительной степени удовлетворяют энергетические потребности организма. Более подробное обсуждение этих вопросов метаболизма жиров представлено на стр. 206—208.
Триглицериды состоят из глицерина, каждая молекула которого этерифицирована тремя жирными кислотами.
Фосфолипиды являются сложными липидами, напоминающими Триглицериды, но содержащими остаток фосфата и азотистое основание. Основные фосфолипиды в плазме — лецитин (фосфатидилхолин) и сфингомиелин. Фосфаты и азотистые основания растворимы в воде — факт, важный в транспорте липидов.
Холестерин имеет стероидную структуру, производными которой являются другие стероиды. Приблизительно 2/з имеющегося в плазме крови холестерина этерифицированы жирными кислотами с образованием эфиров холестерина. Рутинные методы исследования позволяют определить общее содержание холестерина, но не дают возможности измерить отдельно концентрации неэтерифицированных и этерифипированных форм.
Липиды относительно нерастворимы в воде, но в биологических жидкостях они транспортируются в виде растворимых белковых комплексов, известных как липопротеины: водорастворимые (полярные) группы белков, фосфолипидов и свободного холестерина окружают ядро, состоящее из нерастворимых (неполярных) сложных эфиров холестерина и триглицеридов. Различают 5 групп белков, называемых апопротеинами А, В, С, D и Е. Такие подгруппы, как А1 или С1, специфические функции которых известны, будут упоминаться по мере необходимости.
Липопротеины различаются между собой по размеру и составу. В организме в значительной степени осуществляются процессы взаимопревращения и взаимообмена как липидных, так и белковых компонентов липопротеинов. Их можно классифицировать в зависимости от плотности, измеряемой методом ультрацентрифугирования, на 4 основных класса (рис. 30).
Для транспорта холестерина наиболее важное значение имеют два класса липопротеинов: липопротеины высокой плотности (ЛПВП), транспортирующие холестерин из клеток, и липопротеины низкой плотности (ЛПНП), транспортирующие холестерин в клетки.

Для транспорта триглицеридов наиболее важное значение имеют липопротеины очень низкой плотности (ЛПОНП), транспортирующие эндогенные триглицериды от печени к клеткам, и хнломикроны, транспортирующие экзогенные (алимептарные) триглицериды от кишечника.
Пятый класс липопротеипов, отсутствующий в плазме крови здорового человека, составляют липопротеины промежуточной плотности (ЛППП). Обычно они представляют собой транзиторные промежуточные продукты превращения ЛПОНП в ЛПНП, содержащие как холестерин, так и эндогенные триглицериды.
Плазма крови, взятой натощак у здорового человека, содержит только ЛПВП, ЛПНП и ЛПОНП. У здорового человека имеется параллелизм между величиной содержания холестерина в плазме крови и величинами, характеризующими количество холестерина, включенного в ЛПНП. Аналогичный параллелизм имеется между содержанием триглицеридов в плазме крови и в ЛПОНП. Эти заключения справедливы также для большинства случаев гиперлипидемии. В редких случаях может возникать необходимость в характеристике липопротеинов с помощью одного или нескольких из следующих методов.
Ультрацентрифугирование представляет собой метод, позволяющий получать однозначные результаты путем разделения липопротеинов в зависимости от их плотности. При ультрацентрифугировании происходит седиментация ЛПВП вместе с другими белками плазмы. Липопротеины низкой плотности обнаруживают тенденцию к флотации. Скорость флотации выражают в единицах Sf (флотация по Сведбергу). Чем выше соотношение липид: белок, тем ниже плотность липопротеина и тем выше число Sf.
Электрофорез позволяет разделять липопротеины в зависимости от величины электрического заряда их апопротеинов. Этот метод более доступен, чем ультрацентрифугирование. Хотя в данной главе мы не пользуемся электрофоретической номенклатурой, она отражена в названиях ряда патологических состояний, которые будут рассмотрены ниже. Путем электрофореза липопротеины удается разделить на альфа (ЛПВП), бета (ЛПНП), пребета (ЛПОНП) и хиломикроновую фракции. В присутствии избытка ЛППП полоса, соответствующая бетафракции, может расширяться.
Простая методика преципитации позволяет отделить ЛПВП от других липопротеинов, после чего можно дифференцировать холестерин, связанный с ЛПВП и с ЛПНП.
На рис. 30 представлены номенклатура и состав основных классов липопротеидов.
Метаболизм липопротеидов
Липиды плазмы имеют своим источником пищу (экзогенные) или синтезируются в организме (эндогенные).
Метаболизм экзогенных (пищевых) липидов (рис. 31). Жирные кислоты и глицерин, высвобождаемые при переваривании пищевых жиров, всасываются в клетки слизистой оболочки кишечника, где они вновь этерифицируются, образуя триглицериды и эфиры холестерина. Последние в сочетании с фосфолипидами и апопротеинами В (необходимыми для транспорта из клетки) и А секретируются в виде хиломикронов в систему лимфообращения и через грудной проток поступают в кровяное русло. В лимфе и крови апопротеины С и Е, происходящие из ЛПВП, присоединяются к хиломикронам. Благодаря своим большим размерам (30—600 нм) хиломикроны обладают свойством светорассеивания, которое лежит в основе помутнения плазмы крови, обнаруживаемого иногда после приема жирной пищи (послеобеденная липемия).
Большая часть хиломикронов метаболизируется в жировой и мышечной тканях. Апопротеин С2 активирует локализованный в стенках кровеносных капилляров фермент липопротеидлипазу, катализирующий гидролиз триглицеридов в хиломикронах до глицерина и жирных кислот. Эти жирные кислоты либо поступают в клетки жировой или мышечной тканей, либо связываются с альбумином плазмы, тогда как глицерин в печени включается в процесс гликолиза. По мере уменьшения размеров хиломикрона апопротеин А его поверхности, а также некоторая доля апопротеина С и фосфолипидов вновь включаются в состав ЛПВП. Более мелкие остаточные частицы свойством светорассеивания не обладают и помутнение плазмы крови исчезает. Эти короткоживущие частицы состоят преимущественно из холестерина и апопротеинов В, С, а также Е. Они связываются со специфическими печеночными рецепторами и поступают в гепатоциты, где происходит распад белка и высвобождение холестерина в клетки.

В результате этого процесса триглицериды доставляются в жировую ткань и в мышцы, а холестерин — в печень.
Метаболизм эндогенных липидов (рис. 32). Триглицерпды синтезируются в печени из СЖК, поступающих из жировой ткани. При высоком уровне углеводов в рационе возможен непосредственный синтез СЖК из избытка глюкозы. Эти триглицериды, а также холестерин, синтезируемый в печени или поступающий из остатков хиломикронов, соединяются с апопротеинами В и С и образуют ЛПОНП. После секреции в кровь эти ЛПОНП, присоединяя еще большее количество апопротеина С, образуют ЛПВП. Последние активируют липопротеидлипазу на стенках капилляров, и триглицериды, подобно экзогенным триглицеридам хиломикронос, подвергаются гидролизу п удалению из плазмы крови, в которой остаются ЛППП. Некоторая доля ЛППП взаимодействует с рецепторами печени, тогда как остальные превращаются в ЛПНП, состоящие почти целиком из холестерина и апопротеина В. Механизм и локализация этого процесса превращения неизвестны.
Последующий метаболизм ЛПНП изучен очень частично, но ему придают важное значение в развитии атероматоза. По-видимому, существуют 2 пути удаления ЛПНП из плазмы. Согласно первому, ЛПНП после связывания со специфическими рецепторами, имеющимися на поверхности мембран большинства клеток, захватываются клетками и высвобождают холестерин, который может быть включен в состав биомембран. Этот холестерин, угнетая по механизму обратной связи начальные этапы процесса биосинтеза холестерина в клетках, а также ингибируя биосинтез рецепторов ЛПНП на поверхности клеток, регулирует внутриклеточный уровень холестерина. По-видимому, в периферические клетки необходимый холестерин поступает преимущественно из печени. Часть ЛПНП, особенно если их концентрация в плазме высока, может также проникать в некоторые клетки в результате нерегулируемого пассивного процесса. Некоторое количество ЛПНП могут захватывать гепатоциты, но механизм и количественная характеристика этого процесса неизвестны.
Таким образом, в результате осуществления этого процесса эндогенные триглицериды доставляются в периферические клетки для обеспечения потребностей последних в энергии, а эндогенный холестерин — для биосинтеза мембран.
Регуляция содержания холестерина в плазме и в клетках; роль ЛПНП и ЛПВП
Холестерин поступает в кровь и в клетки, всасываясь из пищи, а также синтезируется в организме. При обычной диете количество всасывающегося холестерина почти пропорционально его содержанию в продуктах питания. В экономически развитых странах холестерин пищи содержится преимущественно в яичном желтке (наиболее богатый источник), молочных и мясных продуктах. За сутки в организм поступает с продуктами питания приблизительно от 1,5 до 2 ммоль (от 600 до 800 мг) холестерина.
Эндогенный холестерин синтезируется преимущественно в печени, причем скорость этого процесса снижается, когда в печень поступает экзогенный холестерин. Синтез холестерина в периферических тканях регулируется захватом ЛПНП.
Холестерин плазмы крови и ЛПНП. У здорового человека при увеличении общего содержания холестерина в организме нарастает экскреция холестерина с желчью. Холестерин экскретиру«тся либо после его превращения в печени до желчных кислот и их солей, либо в виде свободного холестерина. Как свободный холестерин, так и желчные кислоты и их соли могут подвергаться обратному всасыванию в подвздошной кнщко (кпшсчпопеченочная циркуляция). Лекарственные средства, которые благодаря свойству связывать соли желчных кислот в содержимом кишечника препятствуют их реабсорбции, могут быть использованы для снижения концентрации холестерина и ЛПНП в плазме.
При поступлении в организм с пищей очень большого количества холестерина угнетение биосинтеза холестерина в печени может быть недостаточным для предотвращения повышения его концентрации в плазме. Более того, насыщенные жирные кислоты, которые, подобно холестерину, поступают преимущественно из пищевых жиров животного происхождения, по-видимому, способствуют увеличению ЛПНП и, следовательно, содержанию холестерина в плазме, тогда как полиненасыщенные жирные кислоты (источником которых являются главным образом растительные жиры) могут способствовать уменьшению их содержания. Причина этого явления неизвестна.
Холестерин в клетках, ЛПВП и ЛХАТ. Захват ЛПНП и местный синтез или высвобождение при распаде клеточных мембран могут вызвать накопление холестерина в периферических клетках. Этот избыток холестерина может быть перенесен в печень (с последующей экскрецией в желчь) только после включения в ЛПВП.
ЛПВП синтезируются в клетках печени и кишечника, которые секретируют их в виде небольших комплексов с фосфолипидами, окруженными апопротеинами А и Е. Свободный холестерин, поступающий из биомембран периферических клеток или из других липопротеидов, поглощается ЛПВП и этерифицируется. Этерификацию катализирует фермент лецитинхолестеролацилтрансфераза (ЛХАТ). Для процесса этерификации требуется также апопротеин А1. Основное количество этерифицированного холестерина переносится на ЛПНП, ЛПОНП и остаточные частицы и таким образом достигает печени. Небольшая доля этерифицированного холестерина резервируется в ядре ЛПВП.
Мы уже упоминали о том, что при голодании ЛПВП транспортируют основное количество апопротеина С плазмы крови. По

мере повышения уровня ЛПОНП или хиломикронов эти частицы захватывают апопротеин G2, который активирует липопротеидлипазу. После завершения гидролиза триглицеридов указанный апонротеин вновь присоединяется к ЛПВП.
Апопротеины
Путь метаболизма липопротеидов, как мы видели, определяется характером транспортируемых ими апопротеинов. Эти белки не только придают липидам водорастворимость, но и необходимы для секреции липопротеидов клетками печени и кишечника и в процессах взаимодействия липопротеидов с рецепторами на поверхности клеток. Они также в табл. 20 активируют ферменты, участвующие в метаболизме липопротеидов, обобщены функции главных типов апопротеидов. Более подробные сведения по этому вопросу можно найти в работах, ссылки на которые имеются в конце этой главы.
Диапазон нормальных колебаний содержания холестерина в плазме
У новорожденного содержание холестерина в плазме (крови из пупочного канатика) обычно не превышает 2,6 ммоль/л (100 мг/дл). Со временем, особенно в течение первого года жизни, содержание холестерина в плазме крови постепенно нарастает, но в детстве обычно не превышает 4,1 ммоль/л (160 мл/дл). У наиболее обеспеченной материально части населения дальнейшее нарастание уровня холестерина в плазме происходит после второго десятилетия жизни. Это нарастание более значительно у мужчин, чем у женщин, на протяжении всего репродуктивного возраста. На 5м и 6м десятилетии жизни во многих популяциях наиболее распространенная (95%) верхняя граница нормы достигает 8,4 ммоль/л (330 мг/дл). Такое нарастание концентрации холестерина в плазме не отмечается среди представителей менее обеспеченных слоев населения, среди которых заболеваемость ишемической болезнью сердца значительно ниже.
НАРУШЕНИЯ МЕТАБОЛИЗМА ЛИПИДОВ
Наиболее распространенные нарушения метаболизма липидов связаны с гиперлипидемией. Очень редко встречаются врожденные аномалии, при которых возможно накопление липидов в тканях, но не в крови.
Как правило, гиперлипидемия обусловлена поступлением в организм избытка высококалорийных продуктов, особенно алкоголя. Возможна вторичная гиперлипидемия, развивающаяся на фоне другого заболевания, приводящего к нарушениям метаболизма липидов. Более редко встречается гиперлипидемия вследствие первичного (наследственного) дефекта, степень выраженности которого могут усугубить алиментарные факторы.
Клинические проявления нарушений метаболизма липидов
Результатом тяжелой и длительной гиперлипидемии обычно (но не всегда) является накопление в тканях липидов, вызывающее повреждение клеток. Накопление липидов, например под кожей или слизистыми оболочками, может быть видимым.
Липиды могут накапливаться в стенках артерий. Этот процесс является наиболее распространенным и важным проявлением парушения метаболизма липидов. Накопление холестерина и сопровождающие его клеточная пролиферация и образование фиброзной ткани приводят к возникновению атероматозных бляшек. Атеросклероз обусловлен патологическими изменениями и закупоркой артерий, что может быть результатом кальцификации и изъязвления этих бляшек.
Накопление липидов в подкожной клетчатке вызывает ксантоматоз, клиническая картина которого, по-видимому, обычно определяется природой липидных фракций, преимущественно вовлекаемых в патологический процесс.
При сопровождающемся сыпью ксантоматозе на коже появляются небольшие желтые зудящие узелки. В этих случаях в плазме крови резко повышено содержание ЛПОНП или хиломикронов (триглицеридов). Если концентрация липидов в плазме снижается до нормальных величин, то сыпь быстро исчезает.
Для бугорчатого ксантоматоза характерны желтые бляшки, обнаруживаемые преимущественно на локтях и коленях. Эти бляшки могут быть большими и обезображивающими. Такие проявления, а также имеющие вид выпуклых полосок отложения липидов в кожных складках на ладонях сопровождаются повышением содержания в плазме ЛППП (в состав которых входят как триглицериды, так и холестерин).
Термином ксантепазма обозначают отложения липидов под кожей лица вокруг глаз, что может быть связано с высокими уровнями холестерина в ЛПНП плазмы.
Отложение липидов в сухожилиях называют ксантоматозом сухожилий. При отложении липидов в роговой оболочке глаза возникает характерное дугообразное образование. У лиц относительно молодого возраста (не старше 40 лет) при ксантоматозе сухожилий или дугообразных отложениях липидов в роговой оболочке глаза, как и в случаях ксантелазмы, особенно часто отмечают высокие уровни холестерина в ЛПНП плазмы.
Гипертриглицеридемия, обусловленная повышением содержания как хиломикронов, так и ЛПОНП (или сочетанием обоих факторов), вызывает помутнение плазмы. Длительные и очень высокие концентрации хиломикронов сочетаются с болями в области живота и даже панкреатитом, а также ксаатоматозом с сыпью. Гипертриглицеридемия часто не сопровождается клиническими проявлениями. По-видимому, имеющие высокую молекулярную массу липопротеиды не вызывают атеромы. Однако для многих пациентов с повышенным содержанием триглицеридов в ЛПОНП характерна пониженная концентрация ЛПВП (необходимых для транспорта холестерина из тканей), а в некоторых случаях — повышенные уровни ЛПНП или ЛППП (содержащих холестерин). Эти воздействия на метаболизм холестерина могут объяснить несколько повышенный риск развития атером, который связывают с гипертриглицеридемией.
Факторы, ассоциируемые с заболеваниями сердечнососудистой системы
Имеются убедительные доказательства существования прямой корреляции между содержанием ЛПНП и сердечнососудистыми заболеваниями. Еще более убедительны доказательства обратной корреляции между этими заболеваниями и содержанием ЛПВП. Чем выше концентрация ЛПВП в плазме, тем ниже степень риска развития сердечнососудистых заболеваний. По-видимому, ЛПВП выполняют защитную функцию, что не представляется удивительным, поскольку ЛПВП принадлежит физиологическая роль переносчиков холестерина от периферических тканей в процессе его экскреции. Влияние ряда факторов, снижающих степень риска развития сердечнососудистых заболеваний, связывают с высокими уровнями ЛПВП. Такие факторы могут быть гормо нальными (концентрация гормонов у женщин репродуктивного возраста выше, чем у мужчин); физические упражнения способствуют повышению концентрации ЛПВП, тогда как питание, богатое углеводами, и курение способствуют ее снижению.
Вторичная гиперлипидемия
В большинстве случаев гиперлипидемия бывает вторичной, обусловленной либо алиментарными факторами, либо наличием заболеваний, при которых метаболизм липидов нарушен.

К числу таких патологических состояний относятся ожирение, злоупотребление алкоголем, сахарный диабет, гипотиреоз и нефротический синдром. В табл. 21 перечислены основные причины вторичных гиперлипидемий.
Первичные аномалии метаболизма липидов
Полигенная гиперхолестеринемия
Для большинства семей с повышенной заболеваемостью гиперхолестеринемией характерно нормальное распределение величин содержания холестерина в плазме отдельных индивидуумов. При истинной моногенной наследственной гиперхолестеринемии для указанных величин характерно явное тримодальное распределение, когда гомозиготным носителям нормального гена, гетерозиготам и гомозиготным носителям аномального гена соответствуют 3 отчетливо различаемых пика. Полагают, что нарушения синтеза и превращений ЛПНП или холестерина в семьях, для которых характерно нормальное распределение с высокой средней величиной, обусловлены аномалиями нескольких генов. Поэтому применяют название полигенная гиперхолестеринемия. Алиментарные и связанные с воздействиями внешней среды факторы могут определять проявления этого полигенного дефекта. Относительно редко встречаются ксантомы, но степень риска развития сердечнососудистых заболеваний повышена.
Поскольку аномалии, обнаруживаемые при первичных нарушениях метаболизма липидов, можно использовать для иллюстрации этапов биохимических превращений, описанных в начале этой главы, мы рассмотрим их более подробно, чем они того заслуживают. Обсуждая результаты лабораторных исследований при каждом из этих патологических состояний, мы сопоставим их с нарушениями физиологических функций.
Хотя обычно такие заболевания являются наследственными, в анамнезе соответствующая информация может отсутствовать. Некоторые особенно редко встречающиеся патологические состояния могут сопровождаться гипо, а не гиперлипемией. Вторичные факторы могут влиять на экспрессию генетических аномалий.
Дисфункции рецепторов
Недостаточность рецепторов для ЛПНП (наследственная гиперхолестеринемия) наследуется как аутосомнодоминантный признак. Поскольку поступление холестерина ЛПНП в клетки снижено, его содержание в плазме нарастает. Концентрация триглиперидов остается в пределах нормы или слегка повышается. Из наследственных нарушений метаболизма это патологическое состояние характеризуется особенно высокой смертностью. Повышенная концентрация холестерина может быть обнаружена в крови из пупочного канатика.
У гомозигот рецепторы для ЛПНП фактически отсутствуют и содержание холестерина ЛПНП в плазме крови в 3 или 4 раза превышает величины, характерные для здоровых лиц. В связи с развитием сердечнососудистых заболеваний возраст таких пациентов редко превышает 20 лет. У гетерозиготных носителей аномального гена число рецепторов для ЛПНП снижено приблизительно на 50% и содержание холестерина ЛПНП в плазме крови приблизительно в 2 раза выше, чем у здоровых людей. У этих больных степень риска развития сердечнососудистых заболеваний повышена в 10—50 раз. У гомозигот ксантомы сухожилий и ксантелазмы развиваются в раннем детстве, но у гетерозиготных носителей — только после 20 лет.
В семьях с моногенным типом наследования имеется четкое различие между клинически здоровыми гомозиготными и гетерозиготными индивидуумами, в противоположность тому, что имеет место при более распространенном полигенном типе заболевания. В большинстве стран моногенная гиперхолестеринемия составляет менее 5% всех случаев первичной гиперхолестеринемии.
Аномалии, связанные с апопротеинами
Недостаточность апопротеина С2 будет упомянута при обсуждении вопроса о дисфункциях липопротеидлипазы.
Низкое содержание апопротеинов в плазме обычно сопровождается не гиперлипидемией, а накоплением липидов в тканях.
Апопротеин А — важный компонент ЛПВП и снижение его содержания приводит к недостаточности ЛПВП. Поскольку ЛПВП имеют важное значение для транспорта холестерина, при их недостаточности эфиры холестерина скапливаются в тканях, особенно в клетках ретикулоэндотелиальной системы. Для этого синдрома, известного под названием болезни Танжье (синдром Фредериксона), характерны увеличенные желтые миндалины, гепатомегалия, лимфаденопатия.
Недостаточность апопротеина В (абеталипопротеидемия; дефицит ЛПНП) приводит к нарушению синтеза хиломикронов и ЛПОНП (и, следовательно, ЛПНП). Поэтому липиды не могут транспортироваться от кишечника или печени. Среди клинических проявлений этого синдрома характерны стеаторея, прогрессирующая атакспя, пигментозный ретинит, акантоцитоз («колючие» эритроциты).
Продуцирование печенью избытка аиоиротеына В сопровождает наследственную сочетанную гаперлипидемию. Апопротеин В необходим для секреции хиломикронов и ЛПОНП, а также для связывания ЛПНП с рецепторами. Приблизительно у '/з пораженных заболеванием членов семей, в которых встречается наследствоппая соястапиая .пшсрлиппдсмпя, повышено содержание ЛПОНП в плазме вследствие первичной или вторичной стимуляции биосинтеза триглицеридов. У другой трети пациентов нет стимуляции биосинтеза триглицеридов, а отмечается только повышенный уровень ЛПНП в плазме. Наконец, еще у одной трети пациентов повышено содержание обеих фракций. Эти нарушения обмена липидов становятся явными только поело 30 лет. Во всех случаях риск развития сердечнососудистых заболеваний выше, чем в норме. Высокое содержание триглицеридов может вызывать ксантоматоз, сопровождающийся сыпью.
Наличие функционально аномального апопротеина Е можно обнаружить у 1 % населения, но заболевание наследственная дисбеталипопротеидемия (болезнь «широкой бета») возникает только в тех случаях, когда имеется иная причина первичной или вторичной гиперлипидемии. При этом нарастает содержание ЛППП и клинически могут быть отмечены высокая частота заболеваний кровеносных сосудов, бугорчатый ксантоматоз, отложения липидов в ладонных складках.
Дисфункции ферментов
Недостаточность липопротеидлипазы. Активность липопротеидлипазы может быть снижена в результате либо недостаточности самого фермента, либо нарушения активации фермента в связи с недостаточностью апопротеина С2.
Накопление хиломикронов приводит к очень значительному помутнению плазмы крови. Истинную недостаточность липопротеидлипазы обычно обнаруживают в детстве по симптомам, указывающим на накопление жиров в различных органах и тканях: в коже (сопровождающийся сыпью ксантоматоз); в печени (гепатомегалия); в кровеносных сосудах сетчатой оболочки глаза (ретинальная липемия); боли в области живота (симптом, сопровождающий гиперхиломикронемию).
Хиломикронемия, обусловленная недостаточностью апопротеина G2, чаще наблюдается у взрослых.
Недостаточность ЛХАТ. ЛХАТ необходима для этерификации свободного холестерина. Недостаточность ЛХАТ приводит к накоплению свободного, преимущественно неэтерифицированного холестерина в тканях, следствием чего является преждевременное развитие атеросклероза, помутнение роговой оболочки глаза, повреждение почек, анемия, которая может быть обусловлена нарушением свойств клеточных мембран.
Продуцирование избытка триглицеридов
Наследственная эндогенная гипертриглицеридемия обусловлена продуцированием избытка триглицеридов в печени. Повышена секреция ЛПОНП из печени в плазму. Заболевание, по-видимому, исследуется лак аутосомнодоминантный признак и обычно становится явным только после 40 лет. Оно может проявляться ожирением, непереносимостью глюкозы, гиперурикемией.
В сочетании с такими вторичными факторами, как сахарный диабет или алкоголизм, указанное заболевание может привести к очень существенному повышению содержания ЛПОНП в плазме и часто, кроме того, к хиломикронемии.
ПРИНЦИПЫ ЛЕЧЕНИЯ
Принятие решения о необходимости лечения пациента с гиперлипидемией должно быть основано на результатах как клинических наблюдений, так и определений содержания липидов в плазме. Некоторые виды лечения связань! с определенным риском, степень которого следует оценить в сопоставлении с возможной пользой лечебных мероприятий.
Вторичные причины гиперлипидемии, в том числе ожирение и злоупотребление алкоголем, следует выявить и провести соответствующее лечение.
Диета должна контролироваться вне зависимости от конкретной причины гиперлипидемии. Диета рекомендуется в зависимости от природы аномалии.
Гиперхолестеринемия
Гиперхолестеринемия повышает степень риска развития сердечнососудистых заболеваний. Поскольку липиды, осаждающиеся в клетках стенок артериальных сосудов, проникают в них из плазмы (особенно из ЛПНП и ЛППП), было выдвинуто предположение о том, что повышение концентрации липидов в плазме приведет к нарастанию скорости их отложения на стенках сосудов. Представляется обоснованным и следующее предположение о том, что снижение концентрации липидов в плазме приведет к замедлению скорости развития атеросклероза (см. ссылки в конце главы). Степень риска, связанного с интенсивным лечением, необходимо оценить в сопоставлении с учетом возможной пользы лечебных мероприятий для больного. Во всяком случае необходимо понимать природу нарушения липидного обмена, чтобы обеспечить выбор национального способа лечения.
Ограничение количества потребляемых с пищей животных жиров, яиц и молочных продуктов снижает поступление в организм как холестерина, так и насыщенных жирных кислот. Следует повысить потребление полиненасыщенных жиров. Эти мероприятия по контролю диеты не всегда бьгаают полностью успешными.
Секвестранты солей желчных кислот, такие как холестирамин и колестипол, представляют собой смолы, которые связывают образующиеся из холестерина соли желчных кислот, предотвращая таким образом их обратное всасывание и повторное использование. При этом происходит кимцецсаторная стимуляция биосинтеза холестерина в печени, но содержание холестерина в плазме обычно понижается.
Никотиновая кислота может уменьшить секрецию ЛПОНП и, следовательно, образование ЛПНП, но может вызвать и неприятные добочныс эффекты, также как приливы крови к лицу. Никотиновую кислоту можно назначать в сочетании с секвестрантами солей желчных кислот. Она также может быть эффективна в тех случаях наследственной сочетанной гиперлипидемии, когда доказано повышение секреции ЛПОНП.
Гипертриглицеридемия
Для лечения гипертриглицеридемип могут оказаться вполне достаточными только определенные ограничения в питании.
Ограничение количества жиров в диете может быть эффективной мерой для снижения уровня хиломикронов в плазме.
Ограничение количества углеводов в диете снижает эндогенный синтез триглицеридов и может быть использовано как лечебное мероприятие в тех случаях, когда концентрация ЛПОНП в плазме повышена.
Клофибрат представляет собой лекарственное средство, которое может активировать липопротеидлипазу, повышая таким образом скорость удаления из плазмы крови ЛПОНП и хиломикронов. Клофибрат применяют для лечения наследственной дисбеталипопротеидемии, когда ограничения в питании оказываются неэффективными. По клиническим показаниям клофибрат может быть назначен при эндогенной гипертриглицеридемии, когда концентрация ЛПОНП повышена. У больных, принимающих клофибрат, относительно часто встречаются желчные камни; к числу других побочных эффектов относятся мышечные судороги и в редких случаях импотенция. Как всегда, риск, связанный с лечением, следует сопоставить с его возможной пользой для пациента.
ЗАКЛЮЧЕНИЕ
1. Липиды в плазме транспортируются в виде липопротеидов.
2. Липиды плазмы можно классифицировать в зависимости от их химического строения или как липопротеиды с помощью электрофореза или ультрацентрифугирования. Для понимания аномалий обмена липидов наиболее информативны данные, получаемые при анализе липопротеидов.
3. Химически фракции липидов представляют собой холестерин, триглицериды, фосфолипиды и свободные жирные кислоты.
4. Основными липопротеидами являются липопротеиды высокой плотности (ЛПВП), низкой плотности (ЛПНП), очень низкой плотности (ЛПОНП) и хиломикроны.
5. Холестерин встречается преимущественно в ЛПВП и в ЛПНП, а триглицериды — в ЛПОНП и хиломикронах.
6. Гиперлипидемия может быть первичной или вторичной, т. е. обусловленной другим заболеванием. Только при первичной гиперлипидемии может возникать необходимость в более полной характеристике аномалий свойств липопротеидов для разработки тактики лечения. Для дифференциальной диагностики сходных аномалий в свойствах липопротеидов необходимы систематические обследования членов семей больных, что лишь в редких случаях бывает осуществимо практически из-за организационных трудностей.
8. Лечение первичной гиперлипидемии основано прежде всего на контроле диеты. Лекарственные средства могут быть использованы дополнительно, если это необходимо. Лечение первичной гиперлнпидемии преимущественно является эмпирическим.
Исследования при подозрении на гиперлипидемию
Должна быть логическая последовательность в ходе обследования пац№ ента с предполагаемыми аномалиями липидов плазмы крови.
1. Имеется ли истинная гиперлицидемия?
Гиперлипидемия может быть диагностирована на основании свойствен. ного липемии внешнего вида плазмы крови или результатов определений содержания в ней холестерина и триглицеридов. Кровь для анализов обоих компонентов следует брать после того, как пациент голодал 14—16 ч, так кан концентрация триглицеридов (но не холестерина) значительно изменяется после приема содержащей жиры пищи.
Наиболее распространенной причиной получения явно липемичной плаз. мы при взятии крови у больных, находящихся в стационаре, бывают внутривенные вливания жидкостей, содержащих липиды; поэтому в течение нескольких часов перед взятием крови для проведения какихлибо исследовал ний такого типа больным не следует внутривенно вводить жидкости, со, держащие липиды.
2. Является ли аномалия первичной или вторичной?
В большинстве случаев гиперлипидемии бывают вторичными и подда, ются коррекции путем контроля диеты или лечения заболевания, лежащего В основе аномалии обмена липидов.
В табл. 21 представлены основные причины вторичной гиперлипидемии. Во всех случаях гиперлипидемии следует рассмотреть возможность наличия сахарного диабета, гипотиреоза и нефротического синдрома. Злоупотребление алкоголем — обычная причина вторичной гипертриглицеридемпп.
3. Какова природа аномалии?
Если не удается установить причину, которая могла бы вызвать вторичную гиперлипидемию, то наблюдаемую аномалию следует считать первич. ной. Выбор адекватного способа лечения в некоторых случаях зависит oi точности определения природы основного нарушения свойств липопротеидов. Визуальная оценка внешнего вида плазмы крови может дать ценные сведения.
На основании результатов лабораторных исследований различают три основные группы аномалий:
а) Преимущественное нарастание холестерина ЛПНП при прозрачной плазме крови. Такое явление может быть при наследственной гиперхолестеринемии, полигенной гиперхолестеринемии, наследственной сочетанной ги перлппидемии.
б) Преимущественное нарастание триглицеридов при мутной (или даже напоминающей по виду молоко) плазме крови, что обусловлено присутствием рассеивающих свет липопротеидов с высокой молекулярной массой. Такие явления могут быть при наследственных сочетанной гиперлипидемпи (ЛПОНП), эндогенной гипертриглицеридемии (ЛПОНП), гиперхиломикронемии.
Способы лечения этих патологических состояний различны; поэтому важно установить, обусловлено ли помутнение плазмы крови ЛПОНП или хпломикронами.
Образцы мутной плазмы выдерживают при 4°С в течение 18 ч. За это время на поверхности пробы большие, обладающие низкой плотностью хиломикроны образуют сметанообразный слой. Имеющие меньшие размеры и более высокую плотность частицы ЛПОНП не всплывают, и пробы остаются равномерно мутными. При значительной гиперлипидемии это распределение частиц может быть не таким четким.
в) Нарастание в одинаковой степени как холестерина, так и триглицеридов, что возможно при наследственных гиперлипидемии (ЛПНП и ЛПОНП) или дисбеталипопротеинемии (ЛППП).
При этих заболеваниях часто бывают необходимы исследования липопротеидов методами электрофореза или ультрацентрифугирования, чтобы оценить относительный вклад ЛПНП, ЛППП и ЛПОНП в развитие наблюдаемой аномалии.
4. Обследования членов семьи больного.
Эти обследования необходимы, чтобы идентифицировать природу заболевания, а также чтобы выявить других (возможно, не имеющих явных клинических признаков патологического процесса) больных.
Взятие крови для исследования липидов плазмы
Содержание липидов в плазме и соотношения липопротеидов являются вариабельными величинами, на которые влияют прием пищи, курение, потребление алкоголя, изменения диеты, поза больного и стресс. Важно, чтобы условия взятия образцов крови при первичном обследовании и при после дующих анализах были стандартными, и некоторых случаях может оказаться необходимым повторение анализов, чтобы добиться получения наиболее воспроизводимых результатов. Следующие факторы являются важными.

1. Перед взятием крови пациент должен голодать в течение 14—16 ч. Больному не следует делать внутривенные вливания жидкостей, содержащих лппиды.
2. Перед проведением исследования в течение 2 нед пациент должен находиться на обычной для него диете и масса его тела должна оставаться постоянной.
3. Если не проводится мониторинг лечения, больному не следует назначать какиелибо терапевтические мероприятия, направленные на понижение содержания липидов в плазме.
4. На определяемые величины концентрации липопротеидов (как п всех высокомолекулярных соединений) влияют застой крови в венах п поза пациента. При взятии крови у больного в положении лежа копцепттрация холестерина в плазме может быть приблизительно на 10% нп/ке, чем при взятии крови у этого же больного в положении стоя. Зависимость определяемой концентрации триглицеридов от позы пациента может быть даже несколько большей. При оценке эффекта лечения путем серип повторных анализов важно стандартизовать процедуру взятия крови. Например, в течение 30 мин перед взятием крови больному следует сидеть.
5. Проведение исследований, направленных на выявление и характеристику типа гиперлипидемий, предпочитают отложить на 3 мес после инфаркта миокарда, больших хирургических операций или любой тяжелой болезни, поскольку стресс может изменять содержание липидов в плазме. Однако исследования проб крови, взятой на протяжении первых 12 ч после инфаркта миокарда, по-видимому, отражают истинные величины содержания липидов в плазме.
6. Не следует гепаринизировать пробы крови; необходимо по возможности быстро отделить плазму или сыворотку от клеточных элементов кровп.
Классификация по Фредериксону (ВОЗ)
Фредериксон предложил классификацию типов гиперлппидемии, основанную на результатах электрофоретических исследований. Однако электрофореграммы, полученные в разное время при исследовании липидов крови одного и того же больного с первичной гиперлипидемией, могут быть различны, тогда как идентичные электрофореграммы могут быть получе. ны при различных патологических состояниях. Поскольку соответствующие термины все еще встречаются в медицинской литературе, читатель может воспользоваться табл. 22 для их сравнения с общепринятой терминологией.
