
- •БИОРОЛЬ ВОДЫ РАСТВОРИМОСТЬ ВЕЩЕСТВ
- •Растворы
- •Cодержание воды в организме
- •Тема 1 Свойства и биороль воды
- •Cуточная потребность - 3 л
- •Выведение воды
- •Физико-химические свойства
- •Физико-химические свойства
- •4. Образование МВС
- •Способы структурирования воды
- •Следствия образования МВС
- •Растворимость веществ
- •Растворимость веществ
- •Растворимость веществ
- •Растворимость веществ
- •Функции воды (биороль)
- •Функции воды
- •Функции воды
- •Газовые законы
- •Закон Сеченова В присутствии электролитов
- •Биороль растворимости газов
- •2. регулирование КЩР (КОС)
- •3. заболевания и лечение
- •Кессонная болезнь
- •Кессонная болезнь
- •Лечение 1) в декомпрессионных камерах (адаптация к изменению Р)
- •Коллигативные свойства растворов
- •Закон Рауля
- •Закон Рауля
- •Закон Рауля (следствия)
- •Диаграмма зависимости ДНП от Т
- •Закон Рауля (следствия)
- •Криометрия, эбулиометрия
- •Осмос
- •Осмотическое давление π
- •Экспериментальное определение π
- •Осмотическое давление плазмы крови
- •Онкотическое давление
- •Биороль осмоса
- •Биороль осмоса
- •Биороль осмоса
- •Поведение эритроцитов в изотонических растворах
- •Биороль осмоса
- •Гипертонические растворы
- •Гипертонические растворы в медицине
- •Гипотонические растворы
- •Коллигативные свойства растворов электролитов
- •Коллигативные свойства растворов электролитов
- •Изотонический коэффициент

Биороль растворимости газов
1. в основе газообмена ННвО2 + СО2 ↔ ННвСО2 + О2
артериальная |
венозная кровь |
В тканях р(СО2) > p(O2) растворимость (СО2) ↑
равновесие смещается
В легких p(O2) > р(СО2) растворимость (О2) ↑
равновесие смещается ←
За один цикл (24 минуты) кровь переносит 64 мл О2 и 50 – 100 мл СО2

2. регулирование КЩР (КОС)
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-
↑р(СО2 ) равновесия смещаются вправо
[H+] ↑ - ацидоз (закисление крови)
↓р(СО2 ) [H+] ↓ - алкалоз (защелачивание)

3. заболевания и лечение
Гипоксия при недостатке О2
(сердечно-сосудистые заболевания, горная болезнь)
Лечение - вдыхание О2

Кессонная болезнь

Кессонная болезнь
При погружении на 10 м Р на 1 атмрастворимости газов в крови
При резком всплытии ↓ Р ↓ растворимости газов (N2)
газовая эмболия
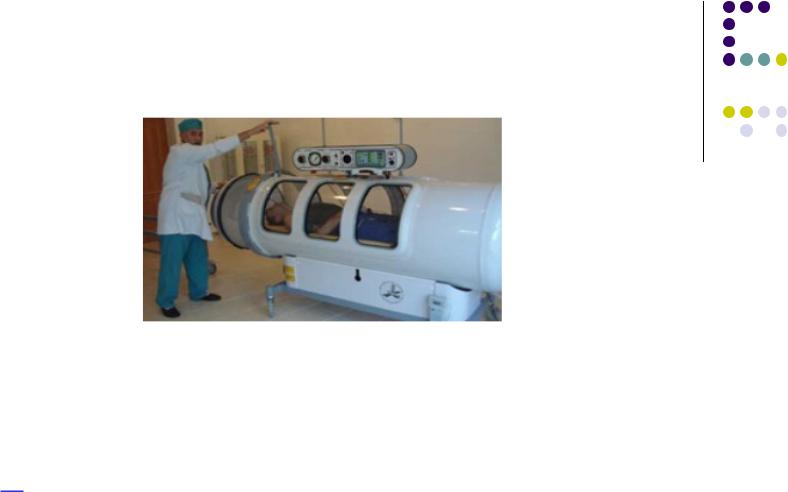
Лечение 1) в декомпрессионных камерах


 (адаптация к изменению Р)
(адаптация к изменению Р) 




2) применение дыхательных смесей:
80% Не 20% О2
Гипербарическая оксигенация (ГБО)
лечение в барокамерах при р(О2) = 2-3 атм заболеваний: анемии, столбняка, гангрены, заболеваний сердца и лёгких

Коллигативные свойства растворов
зависят от числа частиц растворенного вещества и не зависят от природы веществ:
1.давление насыщенного пара (ДНП)
2.повышение ↑ Ткипения (ΔTкип)
3.понижение ↓ Тзамерзания (ΔTзам)
4.осмотическое давление π
Закон Рауля
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
раствор |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р0 |
|
|
|
Р |
|||||||||||
ДНП над растворителем больше |
ДНП над раствором |
||||||||||||||||||
Р0 > Р

Закон Рауля |
||
Относительное понижение ДНП над |
||
раствором неэлектролита равно молярной |
||
доле растворенного вещества N(X) |
||
P0 P |
N р.в ва |
|
P0 |
||
|
||
N р.в ва |
nв ва |
n |
m |
||
nв ва nр тель |
|
|
|||
M |
|||||
|
|
||||
|
|
число моль |
|||
1) P~1/C |
2) Р~ Т |
|
|
||

Закон Рауля (следствия)
Ткипения – температура, при которой ДНП = Ратм
Ткип раствора > T кип растворителя
Тзамерзания – это Т, при которой ДНП над твердой и жидкой фазой равны
Тзам р-ра < Т зам р-теля
