
ПЦР исследования практического врача
.pdf

Метод полимеразных цепных реакций (ПЦР) с каждым годом все шире применяется в клинической практике. В последние десять лет он перешел из разряда уникальных методов, доступных только элитным клиникам, в разряд высокоточных, но доступных исследований.
Все это время за ПЦР-исследованиями шествует шлейф «мифов и преданий», распространяемых теми, кто «слышал звон, да не знает где он», т. е. людьми, не имевшими возможности на практике пользоваться ПЦР-исследованиями. Попытаемся развеять некоторые из них.
Миф ПЦР-исследования столь чувствительны, что дают много ложноположительных реакций, особенно при выявлении микоплазм, уреаплазм, гарднерелл и т. п.
Реалии Чувствительность ПЦР — параметр вполне регулируемый, и регулируется он количеством циклов амплификации. Так, хламидии выявляются после 42-45 циклов, уреаплазмы и микоплазмы — после 30-32 циклов (что соответствует чувствительности 104 КОЕ/мл), лактобактерии — после 20 циклов амплификации (что соответствует 106 КОЕ/мл).
Миф В ПЦР-исследованиях легко возникает контаминация — перекрестное загрязнение проб от положительных образцов, что также ведет к ложноположительным результатам.
Реалии Контаминация в ПЦР теоретически произойти, конечно же, может, но ее частота весьма мала. Поскольку риск контаминации был известен давно, его учли при проектировании ПЦР-лабора- торий, создании аппаратуры и тест-систем.Современная ПЦРлаборатория надежно разделяет различные зоны проведения анализа, ламинарные шкафы создают чистый незагрязненный воздух, а фасованные в пробирки в заводских условиях реагенты сводят риск контаминации к минимуму.
Миф ПЦР не признан никакими нормативными документами Реалии ПЦР-исследования широко вошли в список рекомендуемых те-
стов в рекомендациях ЦНИКВИ в 2002 г., в рекомендациях гепатологов МЗ РФ. Большинство реагентов для ПЦР-исследова- ний зарегистрированы и разрешены МЗ РФ.
Где же с наибольшей эффективностью работают все плюсы этого метода?
1.Диагностика инфекций, передающихся половым путем (лидер среди ПЦР-исследований).
2.Диагностика вирусных инфекций — вирусные гепатиты (А, В, С, D, E, G, TTV), ВИЧ, вирус клещевого энцефалита, инфекции, вызываемые вирусами герпеса различных типов и т. п.
3.Диагностика инфекционных заболеваний, вызываемых плохо
3

культивируемыми возбудителями — боррелия лайма, легионелла, некоторые виды сальмонелл и т. п.
4.Диагностика врожденных, генетически обусловленных заболеваний (в т. ч. еще до рождения ребенка).
5.Быстрая диагностика особо опасных инфекций.
6.Определение пола плода на ранних сроках беременности.
7.Идентификация личности.
Этот список увеличивается с большой скоростью.
1. Подготовка пациента
За 10 дней до взятия материала на исследование необходимо прекратить прием химиопрепаратов и лечебные процедуры. Материал для исследования у женщин следует брать перед менструацией или через 1-2 дня после ее окончания. Перед взятием материала необходимо воздержаться от мочеиспускания (в течение 3-4 часов) и половых сношений. Женщины накануне обследования не должны проводить туалет наружных половых органов и спринцевание. Исследуемый материал должен быть без примесей крови. Не следует для исследования брать свободно стекающие уретральные выделения. Секрет простаты следует брать только после окончания острых явлений простатита.
2.Особенности получения материала для ПЦР-исследований
2.1.Особенности взятия материала из уретры
•перед взятием материала пациенту рекомендуется воздержаться от мочеиспускания в течение 1,5-2 часов;
•непосредственно перед взятием материала наружное отверстие уретры необходимо обработать тампоном, смоченным стерильным физиологическим раствором;
•при наличии гнойных выделений соскоб рекомендуется брать через 1520 мин. после мочеиспускания, при отсутствии выделений необходимо провести массаж уретры с помощью зонда для взятия материала;
•у женщин перед введением зонда в уретру проводится ее массаж о лобковое сочленение;
•в уретру у женщин зонд вводится на глубину 1,0-1,5 см, у мужчин — на 3- 4 см, и затем делается несколько вращательных движений;
•у детей материал для исследования берут только с наружного отверстия
уретры.
После взятия материала зонд переносят в упаковку зонда, либо зонд вносят в пробирку с транспортной средой и тщательно отмывают, пробирка закрывает-
4

ся и маркируется, и в таком виде доставляется в лабораторию.
2.2.Особенности взятия материала из цервикального канала
•перед взятием материала необходимо удалить ватным тампоном слизь и затем обработать шейку матки стерильным физиологическим раствором;
•зонд вводится в цервикальный канал на глубину 0,5-1,5 см;
•при наличии эрозий цервикального канала необходимо их обработать стерильным физиологическим раствором, материал следует брать на границе здоровой и измененной ткани;
•при извлечении зонда необходимо полностью исключить его касание со стенками влагалища.
После взятия материала зонд переносят в упаковку зонда, либо зонд вносят в пробирку с транспортной средой и тщательно отмывают, пробирка закрывается и маркируется, и в таком виде доставляется в лабораторию.
2.3.Особенности взятия материала из влагалища
Материал должен быть взят до проведения мануального исследования. Зеркало перед манипуляцией можно смочить горячей водой, применение антисептиков для обработки зеркала противопоказано. Влагалищное отделяемое собирают стерильным одноразовым зондом из заднего нижнего свода или с патологически измененных участков слизистой.
После взятия материала зонд переносят в упаковку зонда, либо зонд вносят в пробирку с транспортной средой и тщательно отмывают, пробирка закрывается и маркируется, и в таком виде доставляется в лабораторию.
2.4.Особенности взятия секрета предстательной железы
Перед взятием секрета простаты головка полового члена обрабатывается стерильным ватным тампоном, смоченным физиологическим раствором. Секрет простаты берется после предварительного массажа простаты через прямую кишку. Врач проводит массаж с надавливанием несколькими энергичными движениями от основания к верхушке. Затем из кавернозной части выдавливается простатический секрет, который собирается в стерильную емкость (сосуды с широким горлом, пробирки). После взятия секрета простаты он должен быть доставлен в лабораторию в течение 1-3 часов. Транспортировка биологического материала должна производиться только в сумкехолодильнике.
2.5.Особенности взятия (сбора) мочи
Мочу собирают утром натощак после сна или не ранее чем через 2-3 часа после последнего мочеиспускания.
При сборе мочи желательно использовать широкий сосуд с крышкой, по возможности собирать мочу сразу в посуду, в которой она будет доставлена в лабо-
5

раторию. Минимальный объем мочи, необходимый для проведения анализа, составляет 20 мл.
Если в лабораторию доставляется не вся собранная моча, то перед тем, как часть мочи сливается в посуду для транспортировки, ее необходимо тщательно взболтать.
Собранную мочу доставляют в лабораторию в течение 1-3 часов без дополнительного охлаждения. Длительное хранение мочи при комнатной температуре до исследования приводит к изменению не только ее физических свойств и к разрушению клеток, но и к размножению бактерий.
2.6.Особенности взятия материала с конъюнктивы глаз
При наличии обильного гнойного отделяемого его убирают стерильным ватным тампоном, смоченным физиологическим раствором.
Соскоб берут с внутренней поверхности нижнего века движением к внутреннему углу глазной щели. При взятии соскоба необходимо придерживать веко руками, чтобы при моргании ресницы не касались зонда.
После взятия материала зонд переносят в упаковку зонда, либо зонд вносят в пробирку с транспортной средой и тщательно отмывают, пробирка закрывается и маркируется, и в таком виде доставляется в лабораторию.
2.7. Особенности взятия материала с задней стенки глотки
Одноразовый зонд вводят за мягкое небо в носоглотку и проводят по задней стенке глотки.
Если целью исследованию стоят миндалины, то лучше вводить зонд в лакуны миндалин и ротировать там.
После взятия материала зонд переносят в упаковку зонда и доставляют в лабораторию.
Либо зонд вносят в пробирку с транспортной средой и тщательно отмывают. Пробирка закрывается и маркируется.
2.8.Особенности взятия мазка из носоглотки
Взятие мазка проводится натощак или не ранее, чем через 2-4 часа после еды. При взятии материала необходимо хорошее освещение, пациент сидит против источника света, корень языка придавливают шпателем, материал берут стерильным зондом, не касаясь языка, слизистой щек и зубов.
После взятия материала зонд переносят в упаковку зонда, либо зонд вносят в пробирку с транспортной средой и тщательно отмывают, пробирка закрывается и маркируется, и в таком виде доставляется в лабораторию.
2.9.Мазки из зубодесневых карманов.
Мазки из зубодесневого кармана собираются в стерильную пробирку (типа эппендорф) с физиологическим раствором. В этом случае пробирки могут хра-
6

ниться в холодильнике (+4… 6°С) не более 12 часов, а их транспортировка осуществляется в сумке-холодильнике.
Можно брать мазки и жесткими уретральными зондами. В этом случае зонд после взятия материала помещают в его одноразовую упаковку, и в таком виде доставляют в лабораторию.
2.10.Особенности сбора слюны
За 12 часов до взятия (сбора) слюны исключается прием пищи, алкоголя и лекарственных препаратов. Непосредственно перед сбором слюны необходимо исключить использование зубной пасты и удалить зубные протезы.
Перед тем, как собрать слюну, необходимо почистить зубы без зубной пасты, затем хорошо прополоскать рот без использования раздражающих средств. Далее, общую слюну (смешанную) выплевывают изо рта или отсасывают со дна рта одноразовым шприцем и переносят в пробирку (типа эппендорф). Слюна может храниться в холодильнике (+4…6°С) не более 12 часов, а ее транспортировка осуществляется в сумке-холодильнике.
2.11.Венозная кровь
Кровь на исследование желательно брать натощак. Венозная кровь в количестве 2-2,5 мл отбирается в стерильную пробирку объемом 5 мл. Пробирка с кровью может храниться в холодильнике (+4…6°С) не более 24 часов. Пробирку не замораживать (исследование проводится из сыворотки).
Непосредственно перед взятием крови участок кожи над пунктируемой веной с особой тщательностью обрабатывается ватным тампоном с 70° спиртом, затем тампоном с 10% раствором йода от центра к периферии. Перед взятием крови дезинфицирующее средство должно испариться с поверхности кожи. Нельзя пальпировать вену в месте пункции. После взятия крови удаляют следы йода тампоном с 70° спиртом во избежание возможного воспаления кожи.
Для взятия крови необходимо пользоваться шприцами для одноразового пользования либо системами вакуумного взятия крови — Vacuette, Vacutainer. Освобождение шприцев из упаковки производится непосредственно перед взятием крови.
3. ПЦР в клинической практике: диагностика ИППП
Для специальностей: акушерство и гинекология, урология и андрология, дерматовенерология, педиатрия
3.1.Урогенитальный хламидиоз
3.1.1.Краткая информация о возбудителе
Урогениталыные хламидиозы по распространенности занимают важное место среди ИППП, а их последствия в виде трубного бесплодия и эктопической бе-
7
ременности у женщин, нарушения сперматогенеза у мужчин оказывают существенное влияние на репродуктивное здоровье населения.
Наряду с характерным течением заболевания, часто встречаются атипичные и бессимптомные формы хламидийной инфекции, представляющие трудности в диагностике.
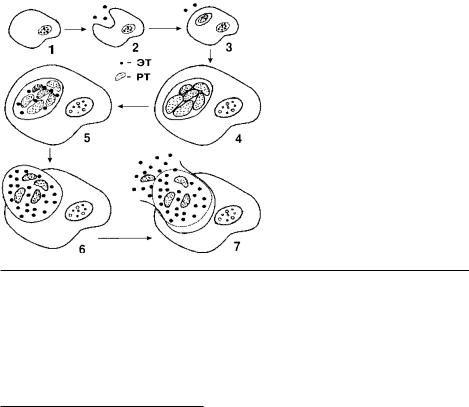
Хламидии (Chlamidia)— мелкие грамотрицательные неподвижные облигатно паразитические бактерии, основными морфологическими формами которых являются элементарные (ЭТ) и ретикулярные (РТ) тельца. ЭТ хламидий обладают инфекционными свойствами, способны проникать в чувствительные клетки, где происходит их цикл развития — превращение мелких ЭТ в более крупные РТ, которые затем претерпевают деление. Хламидии имеют основные признаки бактерий: содержат ДНК, РНК и рибосомы. Все виды, входящие в семейство Chlamydiaceae, обладают сходной структурой липополисахаридного (ЛПС) антигена. Основные белковые антигены, представленные на поверхности ЭТ (белки МОМР массой 40 кД и ОМР2 массой 60 кД) также проявляют значительное структурное сходство у разных видов семейства, что зачастую затрудняет дифференциальную диагностику.
Исходя из того, что виды семейства Chlamydiaceae отличаются между собой лишь различиями в нуклеотидной последовательности некоторых генов, становится очевидным, что правильная диагностика возбудителя хламидийной инфекции возможна лишь при использовании методов обнаружения генома возбудителя, т. е. ПЦР.
Рис. 1. Жизненный цикл хламидий. 1) адсорбция ЭТ; 2) проникновение ЭТ в клетку; 3) реорганизация ЭТ в РТ; 4) деление РТ; 5) созревание РТ в ЭТ; 6) накопление РТ в эндосоме; 7) выход из клетки.
3.1.2.Показания для диагностики хламидий методом ПЦР:
•Острая фаза заболевания.
•Установление этиологии хронического инфекционного процесса урогенитального тракта, в т. ч. его верхних отделов. Возможность обнаружить единичные молекулы ДНК хламидий, не выявляемые методами прямого обнаружения антигена (культуральный, ПИФ).
•Беременность с отягощенным акушерским анамнезом.
8

•Бесплодие неясного генеза.
•Контроль эффективности терапии (не ранее чем через 1 месяц после приема антибактериальных препаратов).
3.1.3.Материал для исследования:
•соскоб из уретры или цервикального канала (пп. 2.1., 2.2.);
•секрет предстательной железы (п. 2.4.);
•осадок мочи (п. 2.5.);
•соскоб с конъюнктивы (п. 2.6.);
•у новорожденных в качестве материала для исследования используют соскоб с конъюнктивы глаз и задней стенки глотки (п. 2.7.);
•у девочек в качестве материала для исследования используют соскоб из вульвы, у мальчиков — мочу.
3.2.Урогенитальные микоплазмозы (уреаплазмоз)
3.2.1.Уреаплазмозы
3.2.1.1.Краткая информация о возбудителе
Представители рода Ureaplasma относятся к группе урогенитальных микоплазм и обладают всеми отличительными признаками этих микроорганизмов: наименьший среди прокариот размер генома, чрезвычайно простая организация, отсутствие плотной клеточной стенки и, как следствие, выраженный полиморфизм.
Уреаплазмы способны длительно персистировать на мембране эпителиальных клеток макроорганизма и локализоваться внутриклеточно. При этом, подобно другим генитальным микоплазмам, могут расти на искусственных бесклеточных питательных средах. Уреаплазмы являются условно-патогенными микроорганизмами и способны вызывать различные заболевания урогенитального тракта человека.
По современной классификации, к роду Ureaplasma относят два вида: U. parvum и U. urealyticum, ранее (до 2000 г.) считавшимися двумя биоварами одного вида U. urealyticum. Из них преимущественно U. parvum способна вызывать воспалительные процессы со стороны слизистых урогенитального тракта, тогда как U. urealyticum является комменсалом в составе вагинального микробиоценоза.
Уреаплазменная инфекция может сопровождаться воспалительными процессами гениталий, приводящими к бесплодию, прерыванию беременности, преждевременным родам, пренатальной патологии плода, а также вызывать уретриты, простатиты и бесплодие у мужчин. Недавно было показано, что уреаплазма является кофактором развития СПИД.
3.2.1.2. Особенности течения уреаплазменной инфекции
•Бессимптомное протекание.
•Отсутствие стойкого иммунного ответа.
9

•Быстрая изменчивость генома, приводящая к возникновению феномена ухода от иммунного ответа
•Природная устойчивость к антибиотикотерапии.
3.2.1.3. Материал для исследований
Наибольшую диагностическую значимость при выявлении ДНК U. urealyticum и U. parvum методом ПЦР имеют следующие биологические материалы:
•соскоб из уретры (п. 2.1.);
•соскоб из цервикального канала (п. 2.2.);
•соскоб с задней стенки влагалища (диагностика бактериального вагиноза) (п. 2.3.);
•соскоб с задней стенки глотки (у новорожденных) (п. 2.7.);
•секрет предстательной железы, сперма (п. 2.4.);
•осадок мочи (п. 2.5.).
3.2.2.Микоплазмозы
3.2.2.1.Краткая информация о возбудителе.
Микоплазмы — микроорганизмы с наименьшим среди прокариот размером генома и чрезвычайно простой организацией. Отличаются от бактерий отсутствием клеточной стенки и, как следствие, выраженным полиморфизмом. При этом способны расти на бесклеточных питательных средах, метаболизировать ряд субстратов и обладают чувствительностью к некоторым антибиотикам. Плазматическая мембрана микоплазм содержит антигены, сходные с человеческими.
Исключительно важная особенность микоплазм состоит в том, что все известные виды способны длительно персистировать на мембране клеток макроорганизма: эпителиальных, лимфоцитах, тромбоцитах и т. д. Микоплазмы способны внедряться внутрь эпителиальных клеток и локализоваться внутриклеточно, где происходит их активное размножение.
M. hominis являются условно-патогенными для человека микроорганизмам. Персистируя в эпителиальных клетках и на их поверхности, микоплазмы способны вызывать различные заболевания урогенитального тракта человека: эндометриты, сальпингиты, негонококковые уретриты. У новорожденных, которые, видимо, инфицируются при прохождении родовых путей, М . hominis колонизирует чаще всего носоглотку и влагалище. У мужчин микоплазма чаще колонизирует уретру и крайнюю плоть, у женщин — влагалище, реже шейку матки и уретру. Показатели инфицированности этим видом микоплазм варьируют от 10 до 50%.
Более патогенна и практически не встречается в норме M. genitalium.
3.2.2.2. Особенности течения микоплазменной инфекции:
•Бессимптомное протекание.
•Отсутствие стойкого иммунного ответа.
•Быстрая изменчивость генома, приводящая к возникновению феномена
10
