
- •На каких фактах основываются современные представления о возникновении Вселенной? Как образовались химические элементы?
- •Какие теории возникновения жизни на Земле Вы знаете? Что такое хиральная чистота биосферы?
- •Как меняется спектр солнечного излучения при прохождении через атмосферу Земли? Почему происходят изменения спектра?
- •Нарисуйте и объясните вид зависимости температуры атмосферы от расстояния до поверхности океана
- •Как изменяется содержание компонентов атмосферы с высотой?
- •В каких единицах принято выражать содержание основных и следовых газов в атмосфере?
- •Как меняется содержание озона в атмосфере с изменением: высоты над уровнем моря; географической широты; времени года?
- •Можно ли сравнить концентрацию озона, выраженную в единицах Добсона (е.Д.) и в ppm?
- •Что такое “нулевой” цикл озона?
- •Какие процессы приводят к нарушению “нулевого” цикла озона? Приведите уравнения реакций.
- •11.Что такое озоновой слой планеты и какие “дыры” в нем могут образоваться?
- •12. Как меняются основные пути стока и время жизни фторхлоруглеводородов в зависимости от их состава?
- •13. Почему свободные радикалы, озон и другие окислители, концентрация которых значительно ниже, чем у кислорода, играют основную роль в процессах окисления примесей в атмосферном воздухе?
- •14.Дайте характеристику природных и антропогенных источников поступления соединений серы в атмосферу.
- •15.Каковы особенности процесса глобального переноса соединений серы?
- •1 6. Охарактеризуйте источники, масштабы поступления и пути стока соединений серы в ее атмосферном цикле.
- •28. Из какой части Солнца поступает основной поток солнечной радиации?
- •29. Какой температуре черного тела соответствует спектр излучения солнечной радиации?
- •30. Излучение какой части спектра несет наибольшую долю энергии в солнечной радиации?
- •31. Изменяется ли количество энергии поступающей от Солнца при изменении его активности? Как значительны эти изменения? в какой части спектра они наблюдаются?
- •32. Что такое “солнечная постоянная”? Изменяется ли количество энергии поступающей от Солнца при изменении его активности? Как значительны эти изменения? в какой части спектра они наблюдаются?
- •40. Сероводород в тропосфере: источники; концентрация; время жизни.
- •42. Какие катализаторы процессов окисления диоксида серы могут присутствовать в воздухе?
- •43. Какие вещества являются основными окислителями соединений серы в воде?
- •44. Какие пути стока соединений серы и других примесей из атмосферы Вы знаете?
- •45. Как выглядит зависимость доли соединений серы, поступающих в атмосферу в виде диоксида серы от времени?
- •46. В чем опасность трансграничного переноса соединений серы в атмосфере?
40. Сероводород в тропосфере: источники; концентрация; время жизни.
см прошлый вопрос и вопрос 14
концентрация
Имеющиеся в литературе сведения позволяют лишь грубо оценить его содержание в тропосфере. Так над океанами концентрация H2S колебалась от 0.0076 до 0.076 мкг*м-3, а над континентами от 0,05 до 0.1 мкг*м-3.
время жизни
П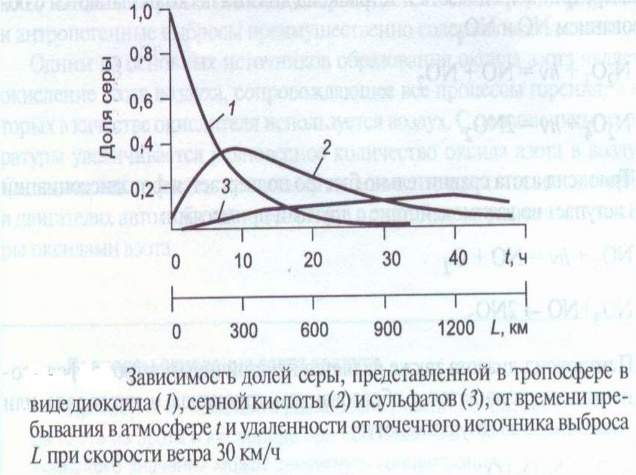 ринимая
во внимание скорость поступления
сероводорода в атмосферу и его содержание
в тропосфере, время его жизни в атмосфере
можно оценить в несколько часов
ринимая
во внимание скорость поступления
сероводорода в атмосферу и его содержание
в тропосфере, время его жизни в атмосфере
можно оценить в несколько часов
41. Основные реакции окисления диоксида серы в газовой фазе. SO2 + ОН + М = HSO3 + M*
HSO3 + HO2 = SO3 + 2OH
SO2 + HO2 = SO3 + OH
SO2 + CH3O2 = SO3 + CH3O
42. Какие катализаторы процессов окисления диоксида серы могут присутствовать в воздухе?
метан??????
Оксиды железа, алюминия, хрома и других металлов, которые также могут присутствовать в воздухе, резко ускоряют процесс окисления диоксида серы. Как показали лабораторные эксперименты, в присутствии, например, частиц Fe2O3, скорость процесса трансформации SO2 составляет примерно 100%•ч-1 .
43. Какие вещества являются основными окислителями соединений серы в воде?
В качестве окислителя в природных условиях часто выступает пероксид водорода. При высоких значениях рН, когда в растворе в основном находятся ионы SO3- скорость окисления заметно возрастает.
Конечным продуктом окисления, как и в случае окисления в газовой фазе, является серная кислота, которая в дальнейшем может перейти в сульфаты. Реагируя с аммиаком или ионами металлов, присутствующими в частицах атмосферной влаги, SO3 частично переходят в соответствующие сульфаты.
В основном это сульфаты аммония, натрия, кальция.
Образование сульфатов происходит и в процессе окисления сульфитов на поверхности твердых частиц, присутствующих в воздухе.
44. Какие пути стока соединений серы и других примесей из атмосферы Вы знаете?
СТОК ОН РАДИКАЛА
СО + ОН → СО2 + Н
СН4 + ОН → СН3 + Н2О
NO + OH + M → НNO2 + М*
Помимо процессов химической трансформации диоксида серы в серную кислоту и сульфаты, сток - вывод из атмосферы этих соединений происходит в результате процессов:
- мокрого осаждения, с атмосферными осадками;
- сухого осаждения - при контакте с поверхностью почвы, поверхностного водоема или растительностью.
45. Как выглядит зависимость доли соединений серы, поступающих в атмосферу в виде диоксида серы от времени?
46. В чем опасность трансграничного переноса соединений серы в атмосфере?
возможностью трансграничного переноса примесей (перенос примесей на большие расстояния, свыше 100 км).
Так, предположим, что над источником выбросов соединений серы дует ветер, имеющий скорость порядка 30 км/ч. В этом случае, спустя 10 часов с момента выброса примеси будут удалены на расстояние 300 км от источника выброса.
В этом воздухе доля диоксида серы уменьшится примерно в 5 раз, и основное количество соединений серы будет представлено серной кислотой.
В случае выпадения дождевых осадков над этой территорией практически все соединения серы будут выведены из атмосферы в виде кислотного дождя. Необходимо отметить, что, несмотря на наметившееся в последние годы сокращение общего количества диоксида серы, выбрасываемого в атмосферу,
серная кислота остается основным компонентом, приводящим к закислению атмосферных осадков.
47. Какие радиационные пояса земли Вы знаете? Какие частицы в них задерживаются?
внутренний радиационный пояс на высоте ? 4000 км, состоящий преимущественно из протонов с энергией в десятки МэВ;мегаэлектронвольт
внешний радиационный пояс на высоте ? 17 000 км, состоящий преимущественно из электронов с энергией в десятки кэВ.килоэлектронвольт
48. Что такое солнечные пятна?
Со́лнечные пя́тна — тёмные области на Солнце, температура которых понижена примерно на 1500 К по сравнению с окружающими участками фотосферы. Наблюдаются на диске Солнца в виде тёмных пятен. Солнечные пятна являются областями выхода в фотосферу сильных магнитных полей.
49. Что такое солнечный ветер?
Со́лнечный ве́тер — поток ионизированных частиц (в основном гелиево-водородной плазмы), истекающий из солнечной короны со скоростью 300—1200 км/с в окружающее космическое пространство. Является одним из основных компонентов межпланетной среды.
50. На какие части делят поток ультрафиолетового излучения от солнца? В чем их особенности по отношению к живым клеткам? Какой ультрафиолет не полностью поглощается в атмосфере?
УФ излучение простирается от 120 нм и делится на
УФ-С - 120 -280 нм, Область С содержит излучения, обладающие бактериальным действием, применяемые для стериализации воздуха и воды, для предохранения продуктов от порчи, излучения , обладающие свойством озонировать воздух, излучения, на использовании которых основано действие источников света - люминесцентных ламп.
УФ-В - 280 -320 нм, Средняя область В характеризуется антирахитным действием на организм, регулирует обмен веществ в живом организме , благотворным действием на рост домашней птицы и животных, а также эритемным эффектом, т.е. способностью вызывать покраснение и загар человеческой кожи.
УФ - А - 320 -400нм. содержит излучения, широко применяемые для люминесцентного анализа, а также возбуждения светящихся веществ в сигнальных, декоративных и других устройствах.
Излучение из диапазона УФ-A поглощается атмосферой слабо, поэтому радиация, достигающая поверхности Земли, в значительной степени содержит ближний ультрафиолет УФ-A и в небольшой доле — УФ-B.
ЗАДАЧИ
Объемные концентрации
Объемная доля – a
a = v / V, где v – объем примеси, V – объем газа, в котором она находится.
% об. = a * 100
ppm = млн -1 = a * 106
ppb = млрд-1 = a * 109
ЗАДАЧА 1
В помещении площадью 50 м2 высота стен 3 м лопнул воздушный шар наполненный гелием. Объем шара равен 5 л.
Определите объемную концентрацию гелия в воздухе помещения.
РЕШЕНИЕ
V=50*3=150
α=5/150=0.033
%объем = 0,033*100=3,3%
ppm=0,033*106
Для не стандартных условий число Лошмита надо умножить на дробь
T0 *Pi /Ti * P0.
Ni = 2,69 *10-19 * T0 *Pi /Ti * P0
Для определения количества молекул примеси в куб. сантиметре необходимо число Лошмита умножить на объемную долю примеси:
n = Ni*a
ЗАДАЧА 2
Сколько молекул гелия будет находиться в воздухе помещения (см. задачу 1) если температура равна 25оС давление 756 мм.рт.ст.
РЕШЕНИЕ
Ni=2,69 *10-19 *273*756/298*760=2.45*10-19
n = Ni*a=2.45*10-19 *0.033=8.085*1017
Концентрацию примесей можно измерять в парциальным давлением примеси:
Рi = Pобщее *a
Массовая концентрация примесей мг/м3
В стандартных условиях:
С (мг/м3) =С(ppm) * М / 22,4
Для не стандартных условий полученное число надо умножить на дробь
T0 *Pi /Ti * P0.
С (мг/м3) =С(ppm) * М * T0 * Pi / 22,4 * Ti * P0.
ЗАДАЧА 3
Определите парциальное давление гелия и его концентрацию в помещении (см. задачу 1,2)
РЕШЕНИЕ
Pi=Pобщ*α=756*0,033=24,948
С (мг/м3) =С(ppm) * М * T0 * Pi / 22,4 * Ti * P0.
С (мг/м3) =0,033*106*4*273*756/22,4*298*760=5370,07
ЗАДАЧА 4
Превышается ли и, если да, то во сколько раз, значение максимально разовой ПДК для аммиака, равное 0,2 мг/м3, ,при обнаружении его запаха, если порог обнаружения запаха для аммиака составляет 46,6 ppm. Атмосферное давление равно 100 кПа, температура 250 С.
РЕШЕНИЕ
Для ответа на вопрос необходимо привести значение ПДКм.р. и концентрацию, соответствующую порогу обнаружения запаха, к одинаковым единицам измерения и найти их отношение.
Выразим концентрацию аммиака в мг/м3:
С` (мг/м3) = С`` (ррm) * М.М. * Т0 * Р / 22,4 * Т * Р0,
где: С` и С`` - концентрация аммиака, выраженная в мг/м3 и ррm, соответственно;
М.М. – молекулярная масса аммиака (17 г/моль);
22,4 – объем (дм3), занимаемый одним молем газа при нормальных условиях ( температура Т0 = 273 К, давление Р0 =101,3 кПа);
Т и Р,- температура (К) и давление воздуха (кПа) в рассматриваемых условиях.
С` = 46,6 * 17 * 273 * 100/ 22,4 * 298 * 101,3
С`= 32,0 мг/ м3.
Найдем отношение концентрации аммиака при обнаружении запаха и ПДКм.р.:
r = С`/ ПДКм.р. = 32,0 / 0.2
r = 160
Ответ: при обнаружении запаха аммиака его концентрация в воздухе в 160 раз превысит значение ПДКм.р. .
ЗАДАЧА 5
Сколько молекул формальдегида присутствует в каждом кубическом сантиметре воздуха при нормальных условиях, если его концентрация достигает значения ПДКм.р., равного 0,035 мг/м3 .
РЕШЕНИЕ
Определим количество молей формальдегида в кубическом метре воздуха:
С (моль/м3) = С` (мг/ м3) / М.М. * 103 (г/моль)
где: С и С` - концентрация формальдегида в воздухе, выраженная в моль/м3 и мг/м3 , соответственно;
М.М. – молекулярная масса формальдегида (30 г/моль);
103 - коэффициент перевода молекулярной массы (г/моль) в мг/моль.
Количество молей формальдегида при концентрации, равной ПДКм.р., составит:
С = 0,035/30 * 103 (моль/м3)= 1,17 * 10-6 моль/м3
Количество молекул в кубическом сантиметре воздуха можно определить по уравнению:
N(см-3) = С (моль/м3) * 10-6 * Na(молекул/моль),
где: N - количество молекул формальдегида в кубическом сантиметре воздуха (молекул/ см3, обычно слово “молекула” опускается и значение размерности концентрации записывается в виде см-3);
С\- концентрация формальдегида в воздухе (моль/м3);
Na - число Авогадро;
10-6 - коэффициент перевода единиц измерения объема из м3 в см3 .
N = 1,17 * 10-6 * 10-6 * 6,02 * 1023
N = 7,02 * 1011 молекул/см3 = 7,02 * 1011 см-3 .
Ответ: при концентрации формальдегида, равной ПДКм.р., в каждом кубическом сантиметре воздуха присутствует 7,02 * 1011 молекул СН2О.
ЗАДАЧА 6
Масса атмосферы оценивается величиной
5 * 1015 m. Определите количество кислорода в атмосфере в кг, в допущении, что атмосфера состоит только квазипостоянных компонентов (азот, кислород и аргон), а объемная концентрация этих компонентов соответствует значениям, характерным для приземного слоя атмосферы
РЕШЕНИЕ
ищем среднюю молярную массу воздуха
берем первые три по составу вещества в %
М=для азота0,78*14*2+кислород0,2*16*2+для аргона 0,09*39=28,96
0,78, 0,2, 0,09 процентное содержание этих веществ в воздухе
Nвоздуха =Q/Mвоз
Nвоздуха – общее количество молей воздуха в атмосфере
Q-масса атмосферы в ГРАММАХ
М воз – средняя молярная масса воздуха
Nвоз=5*1015 *106 /28,96=1,7*1020 моль
поскольку мольные и объемные доли газов в смеси равны между собой можно найти количество молей кислорода
Nкисл= 1,7*1020 моль* 0,2= 3,4*1019
масса кислорода = 3,4*1019 *32=1,1*1021 грамм =11*1017
ЗАДАЧА 7
запасы угля в мире в пересчете на углерод 900 млрд т
Насколько бы изменилось содержание кислорода в атмосфере, если бы этот уголь сгорел в течение короткого времени?
РЕШЕНИЕ
900 млрд т = 9*1011 т = 9*1014 кг
C + O2 = CO2
12 - 44
9*1014 кг - X
X= 9*1014 кг *44 /12=33*1014кг
11,5*1017 из прошлой задачи типа – 100%
33*1014кг – У
У%=33*1014кг*100/11,5*1017 = 0,29%
ЗАДАЧА 8
При совместном присутствии СО и О2 в во в крови устанавливается равновесное отношение концентраций и карбоксигемоглобина и оксигемоглобина, которое пропорционально парциальному давлению газов
[COHb] /[O2Hb]=K * Pco/ Po2
Коэффициент пропорциональности для крови человека измеряется в пределах от 200 до 250
Содержание оксида углерода в сигаретном дыме составляет 400-450 млн-1
Какое среднее содержание карбоксигемоглобина может наблюдаться в организме курильщика который дышит сигаретным дымом, если количество кислорода в табачном дыме соответствует средним для приземного воздуха значениям?
РЕШЕНИЕ
К какимпосведствиям это может привести,
I. При концентрации в крови, равной 2-5% наблюдается воздействие на центральную первную систему и нарушение ряда
функций.
2. При содержании COHb в крови более 5% наблюдаются
изменения сердечной и легочной деятельности.
3. В случае 10-80% содержания COHb в крови наблюдаются головные боли
спазмы респираторные нарушения, может наступить смерть
РЕШЕНИЕ
Парциальное давление оксида углерода в сигаретном дыме (Pco) можно определить по уравнению
Pco=Pобщ*αco
где Pобщ – общее давление смеси (по условию равно давлению воздуха 101,3 кПа)
αco – объемная доля оксида углерода в табачном дыме (примем средне-арифметическое значение из интервала концентраций αco=400+450/2=425*10-6)
Pco=Pобщ*αco= 101,3*425*10-6=4,3*10-2
Парциальное давление кислорода в табачном дыме, по условию задачи, равно парциальному давлению кислорода в приземном воздухе и без учета содержания паров воды в воздухе составляет
Ро2= 101,3*0,2095=21,2 кПа
[COHb] /[O2Hb]=K * Pco/ Po2
К=200+250/2
Рсо= 4,3*10-2
Ро2=21,2 кПа
[COHb] /[O2Hb]=K * Pco/ Po2=
=225*4,3* 10-2/21,2=0,456
[COHb] /[O2Hb]
примем процентное содержание гемоглобина связанного с оксидом углерода (карбоксигемоглобин) в крови курильщика, вдыхающего лишь табачный дым, за Х%
тогда содержание гемоглобина
[O2Hb]=(100-Х)% а их отношение можно выразить уравнением
[COHb] /[O2Hb]=Х/100-Х=0,456
решая это уравнение найдем Х=31,3%
это значение находится в интервале 10-80% поэтому будут наблюдаться головные боли, респираторные нарушения, может наступить смерть
ЗАДАЧА 9
Оцените, во сколько раз скорость связывания атомарного кислорода в реакции синтезам озона выше, чем в реакции гибели озона, когда эти процессы протекают при нормальном атмосферном давлении у поверхности Земли.
Концентрация озона в приземном воздухе составляет 4*1011 см3.
Константа скорости реакции образования озона Кобр. равна 6,9*10-34 см6 молекула-2 c-1, если третье тело-молекула кислорода. Константа скорости процесса гибели озона при взаимодействии с атомарным кислородом составляет: Кгибели=8,4*10-15 см-3 молекула-1c-1.
РЕШЕНИЕ
О2+О+М=О3+М* (1)
О3+О=2О2 (2)
Скорости процессов образования и гибели озона по р-ям (1) и (2) можно представить уравнениями:
Vобр=Кобр [O(3 P)][O2][M]
Vгибели=Kгибели[O(3P)][O3]
Отношение скоростей р-ий образования и гибели озона можно определить по уравнению:
Vобр/ Vгибели= Кобр [O(3P)][O2][M]/ Kгибели[O(3P)][O3]
Vобр/ Vгибели= Кобр[O2][M]/ Kгибели[O3]
В случае, когда третье тело в процессе образования озона – молекулы кислорода ([O2]=[M]), отношение скоростей реакций (1) и (2) составит:
Vобр/ Vгибели= Кобр[O2]2/ Kгибели[O3]
Таким образом, для решения задачи необходимо найти содержание молекул кислорода в кубическом сантиметре воздуха.
Среднее значение температуры приземного воздуха соответствует средней температуре нижней границы тропосферы и равно 288К.
При нормальном атмосферном давлении концентрация молекул кислорода составит:
N=N*103*T0*α(O2)/Vm*T
N=6.02*1023*103*273*0.2095/22.4*288
N=5.34*1018см3
Отношение скоростей реакций (1) и (2) составит:
Vобр/Vгибели=6,9*10-14* (5,34*1018)2/8,4*1023*7*1011=5,86*106
Ответ: скорость связывания атомарного кислорода в реакции образования озона в 3,3*106 раз больше, чем в реакции гибели озона.
ЗАДАЧА 10
Определите среднее время пребывания паров воды в атмосфере, если, по оценкам специалистов, в атмосфере находится 12900 км3 воды, а на поверхность суши и океана выпадает в виде атмосферных осадков в среднем577*1012 м3 воды в год.
РЕШЕНИЕ
Среднее время пребывания компонентов в атмосфере в случае установления динамического равновесия можно определить по уравнению:
τ=A/Q
где τ- время пребывания вещ-ва в атмосфере в единицах времени,
А – количество вещества в атмосфере в единицах массы,
Q – скорость поступления или вывода вещества из атмосферы (в единицах массы на единицу времени).
Для условий задачи имеем:
τ=12900*109/577*1012
где 109 – коэффициент перевода куб км в куб м
τ=2,23*10-2 года=8,16 дня
Ответ: среднее время пребывания воды в атмосфере составляет 8,16 дня
ЗАДАЧА 11
Количество метана, поступающего ежегодно с поверхности Земли в атмосферу, составляет 550 млн. т. Среднее содержание метана в слое атмосферы, на который приходится 90% ее массы, составляет 1,7 млн-1. Определите время пребывания метана в этом слое атмосферы, если принять, что в других частях атмосферы он присутствует, а масса атмосферы составляет 5*1015т.
РЕШЕНИЕ
Для решения задачи на первом этапе необходимо определить среднюю молекулярную массу смеси газов или среднюю молекулярную массу воздуха:
Мвоз=Мазот*αазот+Мкис*αкис+Марг*αарг
Где М – средняя молекулярная масса воздуха, Мазот, Мкис, Марг – средняя молекулярная масса азота, кислорода и аргона, α – объемная доля соответствующего компонента смеси в воздухе
Мвоз = 28,01*0,7810+32,00*02095+39*0,0095=28,96
Зная общую массу воздуха и его среднюю молекулярную массу, определяем общее количество условных молей воздуха в атмосфере:
Nвоз = Q/Mвоз
Где Nвоз – общее количество молей воздуха в атмосфере, Q – масса атмосферы (г); Мвоз – средняя молекулярная масса воздуха (г)
Nвоз=5,0*1025*106/28,96 = 1,7*1030 молей
В слое, составляющем 90% массы атмосферы, будет содержаться:
nвоздуха=1,7*1020*90/100=1,53*1020 (молей воздуха)
Количество молей метана, содержащегося в этом слое атмосферы, составит:
n метана=nвоздуха*C*метана
где C*метана- объемная доля молекул метана в воздухе, по условию задачи C*метана=1,7млн-1=1,7*10-6
Тогда n метана=1,53*1020*1,7*10-6=2,6*1014 (молей)
Масса метана в рассматриваемом слое атмосферы составит:
А метана= n метана*М.М метана
Где М.М метана – молекулярная масса метана М.В. метана=16 г/моль
Мметана=2,6*1014*16=41,6*1014г=41,6*108г
Время пребывания метана в атмосфере составит:
τ=41,6*108/550*106=7,56 года
ЗАДАЧА 12
Во сколько раз количество молекул кислорода в кубическом сантиметре воздуха на высоте вершины Эльбрус (5621 м) меньше, чем среднее значение у поверхности Земли (на уровне моря) при нормальном атмосферном давлении?
РЕШЕНИЕ
Количество молекул, содержащееся в одном кубическом сантиметре воздуха (nв), можно определить по уравнению:
Nв = NAT0P1/(T1P0Vm),
где NA – число Авогадро;
Vm – молярный объем газа при стандартных условиях
(Vm = 22,4 . 103 см3);
Т0, Р0 и Т1, Р1 – значения температуры (К) и давления при стандартных условиях и в рассматриваемом случае соответственно.
Давление у поверхности Земли (на уровне моря) при нормальных условиях равно давлению при стандартных условиях (Р1 = P0). Средняя температура воздуха у поверхности Земли (на уровне моря) равна 288 К (таблица 2). В этом случае количество молекул газов в кубическом сантиметре воздуха составит:
nв.3 = 6,02 . 1023 . 273/ (288 . 22,4 . 103) = 2,55 . 1019 (см–3)
Количество молекул кислорода в кубическом сантиметре воздуха (nк) можно определить, зная его среднее содержание в воздухе:
nк = nвC*к,
где C*к – объемная доля кислорода в воздухе.
Количество молекул кислорода в кубическом сантиметре воздуха у поверхности Земли (на уровне моря) при нормальном атмосферном давлении, средней температуре у поверхности и концентрации кислорода в приземном слое атмосферы, равной среднему значению, составит:
nк.З = nв.ЗС*к
где С*к – среднее значение концентрации кислорода в приземном слое воздуха (таблица 1.1), выраженное в объемных долях.
nк.3 = 2 . 55 . 1019 . 0,2095 = 5,34 . 1018 (см–3)
Содержание молекул воздуха в атмосфере убывает с увеличением высоты над уровнем моря (уравнение 5):
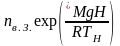 ,
,
где nв.H – концентрация молекул в воздухе на высоте H, см–3;
nв.з – средняя концентрация молекул в воздухе на уровне моря, см–3;
М – средняя молярная масса воздуха (М = 28,96 . 10–3 кг/моль – пример 7);
g – ускорение силы тяжести (g = 9,8 м/с2);
Н – высота над уровнем моря, м;
R – универсальная газовая постоянная, Дж/(моль . К);
Тн – средняя температура воздуха на высоте Н, К.
Температуру на заданной высоте в тропосфере можно оценить по уравнению:
ТН = Т3 + T . H ,
где Тн и Tз – температуры на заданной высоте H и у поверхности Земли соответственно, К;
T – температурный градиент в стандартной тропосфере (T = – 6,5К/км – таблица 2).
Средняя температура атмосферы на высоте вершины Эльбрус составит:
ТН = 288 + (–6,5) . 5,621 = 252 (К)
Концентрация молекул воздуха на высоте вершины Эльбрус составит:
nв.Н = 2,55 . 1019 ехр[–28,96 . 10-3 . 9,8 . 5621/(8,31 . 252)] = 1,19 . 1019(см–3)
Поскольку соотношение чисел молекул «квазипостоянных» компонентов воздуха в единице объема практически не меняется в атмосфере до высоты 100 км, можно определить концентрацию молекул кислорода на высоте вершины Эльбрус (nк.Н) по уравнению:
nк.Н = Nв.НС*к
nк.Н = 1,19 . 1019 . 0,2095 = 2,49 . 1018 (см–3)
Отношение количества молекул кислорода в воздухе у поверхности Земли (на уровне моря) и на вершине горы Эльбрус составит:
Х = nк.з/nк.H;
X = 5,34 . 1018/(2,49 . 1018) = 2,1.
Ответ: концентрация молекул кислорода в воздухе на вершине Эльбрус в 2,1 раза меньше, чем у поверхности Земли.
