
- •Контрольные вопросы
- •Какие проблемы гидросферы Вы отнесли бы к глобальным? Почему?
- •С какими аномальными свойствами воды связано влияние гидросферы на климат?
- •Почему вблизи океанов и морей климат более мягкий?
- •В каком виде может находиться вода в гидросфере?
- •Какие способы классификации природных вод Вы знаете?
- •На что, зачем и почему в мире ежегодно расходуется основное количество пресных вод?
- •Почему использование воды в сельском хозяйстве, в промышленности и в быту приводят к деградации воды? в чем сходство и различие этих причин?
- •Какие единицы используются для выражения концентрации воды при записи ее состава в виде формулы Курлова? Как их можно рассчитать, зная концентрацию, выраженную в весовых процентах?
- •Сформулируйте закон Дитмара. Для решения каких практических задач он используется?
- •Какие анионы и катионы, содержащиеся в природных водах, называют главными? Почему?
- •Как на основании термодинамических данных оценить растворимость минералов в воде? Какие критерии устойчивости минералов Вы знаете?
- •Что такое «агрессивность» природных вод?
- •Что такое «неустойчивость» минералов?
- •Для каких целей удобно использовать понятия: а) «агрессивности» природных вод; б) «неустойчивости минералов?
- •В чем отличие понятий «произведение растворимости» и «константа равновесия процесса растворения»?
- •Как связаны между собой значения произведения растворимости и константы равновесия процесса растворения?
- •Что такое жесткость воды и в каких единицах она измеряется?
- •Как классифицируют природные воды по величине жесткости? Какую жесткость имеют природные воды, наиболее широко представленные в Вашей местности?
- •Какие компоненты входят в состав карбонатной системы природных водоемов?
- •Равновесия между какими компонентами природных систем, определяются законом Генри?
- •Какие параметры природных систем определяют величину константы Генри?
- •Какое значение рН должны иметь атмосферные осадки, если «активные» примеси в атмосферном воздухе представлены только диоксидом углерода?
- •Как может измениться рН атмосферных осадков, если в атмосферном воздухе, помимо диоксида углерода, появится: а) аммиак; б) диоксид серы?
- •Что такое кислые дожди? с присутствием каких соединений в атмосферном воздухе связано их образование?
- •Какое значение рН будут иметь поверхностные воды, находящиеся в равновесии с карбонатными породами и диоксидом углерода, содержащимся в приземном слое воздуха?
- •Что такое щелочность природных вод?
- •Как экспериментально определяют щелочность природных вод?
- •Как рассчитать щелочность природных вод, зная содержание компонентов карбонатной системы и рН раствора?
- •При каких условиях и почему в процессе фотосинтеза, протекающего в природном водоеме, может увеличиться значение рН?
- •Какое значение щелочности будут иметь поверхностные воды, находящиеся в равновесии с карбонатными породами и диоксидом углерода, содержащимся в приземном слое воздуха?
- •Что может произойти в водоеме, если его щелочность уменьшится в десять раз?
- •Какие этапы закисления природных водоемов Вы знаете?
- •Что происходит с экологической системой водоема на различных этапах его закисления?
- •С чем связана особая опасность контакта закисленных природных вод, содержащих соединения алюминия и тяжелых металлов?
- •Назовите основные особенности протекания окислительно-восстановительных процессов в природных водах.
- •В каких единицах принято измерять величину окислительно-восстановительного потенциала природных вод?
- •Что такое редокс - буферность природных вод? с протеканием каких процессов она связана?
- •Что такое стратификация природных водоемов? с какими причинами может быть связана стратификация водоемов?
- •Чем отличаются олиготрофные и эвтрофные водоемы в период стратификации?
- •С протеканием каких процессов связана возможность появления сероводорода в зоне гиполимниона эвтрофного водоема в период стратификации?
- •Почему периоды водообмена в эвтрофном водоеме наиболее опасны для жизни рыб?
- •Почему, даже после прекращения поступления избытка питательных веществ, водоем медленно выходит из эвтрофного состояния?
- •Примеры задач
- •Выразите содержание главных катионов и главных анионов морской воды в промилле и миллимоль на литр,
- •Представьте средний состав морской воды, концентрация растворенного диоксида углерода в которой составляет 1000 мг/л, в виде формулы.
- •Оцените сколько грамм поваренной соли (NaCl) содержится в 1 кг морской воды, отобранной в одном из заливов Баренцева моря, если ее хлорность равна 15,00 0/00?
- •К какому классу вод по минерализации следует отнести природные воды, состав которых соответствует среднему составу речной воды?
- •Какая из двух природных вод более агрессивна по отношению к гипсу (CaSo4*2h2o), если активность катионов кальция и анионов so42- для первой и второй воды составляют:
- •298 К, давление равным 101,3 кПа, парциальное давление паров воды – 3,126 * 10-3 атм.
- •1. Что такое гидросфера? Оцените ее границы.
- •33. Как связано содержание ионов водорода в природных водах, находящихся в равновесии с карбонатными породами и диоксидом углерода, с парциальным давлением со2 в воздухе?
- •35. Какую минимальную жесткость будут иметь поверхностные воды, находящиеся в равновесии с карбонатными породами и диоксидом углерода, содержащимся в приземном слое воздуха?
- •39. Что такое распределительная диаграмма? Для характеристики каких параметров природных систем удобно использовать распределительные диаграммы?
- •45. Окислительно-восстановительное состояние природных вод. Растворимость кислорода.
- •46. Превращение органических соединений в анаэробных условиях.
- •Эвтрофикация озер. Вид зависимости количества растворенного кислорода в воде от глубины погружения в различные периоды года.
298 К, давление равным 101,3 кПа, парциальное давление паров воды – 3,126 * 10-3 атм.
Процесс растворения диоксида углерода в воде, приводящий к появлению ионов водорода и, следовательно, к изменению pH воды, может быть представлен уравнением: CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3 - .
Константа равновесия диссоциации угольной кислоты по первой ступени равна:
К1 = а(H+ )а(HCO32- )/ а(H2CO3).
Диссоциация угольной кислоты по второй ступени протекает значительно слабее и приводит к появлению карбонат-ионов:
HCO3 - ↔ H+ + CO3 2-
Константа диссоциации угольной кислоты по второй ступени имеет вид:
К2 = а(H+ )а(CO3 2-)/а(HCO3 - ).
При диссоциации угольной кислоты по первой ступени концентрации образующихся гидрокарбонат-ионов и ионов водорода равны между собой. Поскольку рассматриваемый раствор имеет низкую концентрацию ионов, можно принять, что коэффициенты активности ионов H+ и HCO3 - равны единице. Поэтому и активности этих ионов равны их концентрациям, а выражение для К1 можно представить в виде:
К1 = [H+ ]2 /[H2CO3].
Под концентрацией H2CO3 обычно подразумевают концентрацию растворенного диоксида углерода, которая в соответствии с законом Генри равна:
[CO2]р-р = KГ (CO2) P(CO2),
где [CO2]р-р − концентрация растворенного диоксида углерода, моль/л; KГ (CO2) − константа Генри для углекислого газа, моль/(л·атм); P(CO2) − парциальное давление диоксида углерода в воздухе, Па(атм).
Учитывая это, уравнение для К можно переписать в виде:
К1 = [H+ ]2 /[H2CO3] = [H+ ]2 /[CO2]р-р
К1 = [H+ ]2 /[KГ (CO2) P(CO2)].
Из полученного уравнения легко вывести зависимость концентрации ионов водорода от парциального давления диоксида углерода в атмосферном воздухе:
[H+ ] = [K1KГ(CO2)P(CO2)]1/2 ,
pH раствора, находящегося в контакте с воздухом, содержащим диоксид углерода
pH = − lg[H+ ] = − lg[K1KГ(CO2)P(CO2)]1/2 .
Необходимые для расчета значения константы диссоциации угольной кислоты по перовой ступни и константы Генри для диоксида углерода, которые зависят от температуры процесса, можно найти в справочной литературе:
K1 = 4,45 · 10-7 моль/л;
KГ(СO2) = 3,3 · 10-2 моль/(л · атм).
Парциальное давление диоксида углерода можно рассчитать, зная его концентрацию в воздухе, общее давление и давление паров воды в системе. В настоящее время парциальное давление диоксида углерода составляет:
P(CO2) =[Pобщ – P(H2O)] · φ(CO2) = =(1 – 3,12 · 10-3) · 0,035/100 = 3,5 · 10-4 атм.
Б) При увеличении содержания диоксида углерода в воздухе в два раза его парциальное давление удвоится и составит:
P*(CO2) = 7,0 · 10-4 атм.
В настоящее время pH атмосферных осадков при присутствии в воздухе только диоксида углерода составляет:
pH = -lg(4,45 · 10-7 · 3,3 · 10-2 · 3,5·10-4) = 5,6.
При удвоении содержания диоксида углерода в воздухе pH атмосферных осадков составит: pH* = -lg(4,45 · 10-7 · 3,3 · 10-2 · 7,0 ·10-4) = 5,5.
Изменение pH составит: ∆pH = pH – pH* = 5,6 -5,5 = 0,1
8. Какой процесс – растворение или осаждение гипса – будет происходить при его контакте с природной водой, в которой активности катионов кальция и анионов SO составляют 10–4 и 10–2 моль/л соответственно? Температура и давление соответствуют стандартным значениям.
Процесс растворения гипса, как было сказано, можно описать уравнением реакции:
CaSO4
.
2Н2О
= Са2+ +
SO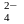 +
2Н2О
+
2Н2О
Направление процесса (осаждение или растворение) можно определить по значению показателя степени неравновесности (уравнение 13):
= (ПА)прод/Кравн.
Произведение активностей продуктов процесса растворения гипса в данном случае следует принять равным произведению активностей соответствующих ионов в природной воде, поскольку для этой воды и необходимо определить степень неравновесности. Произведение активностей составит:
(ПА)прод = aCa2+a SO = 10–4 . 10–2 = 10–6 (моль/л)2.
Значения константы равновесия реакции растворения гипса можно определить из термодинамических данных по уравнению (4):
 .
.
Значение
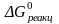 определим
из выражения:
определим
из выражения:
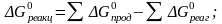

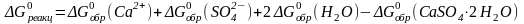 Подставив
значения энергии Гиббса образования
ионов и соединений в стандартных
условиях (таблица 5 Приложения) в данное
уравнение, получим:
Подставив
значения энергии Гиббса образования
ионов и соединений в стандартных
условиях (таблица 5 Приложения) в данное
уравнение, получим:
= (–561,0) + (–744) + 2(-237,6) – (–1799,8) =
= 19,6 (кДж/моль) = 19,6 . 103 (Дж/моль).
Логарифм константы равновесия равен:
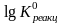 = –19,6 .
103/(2,3
.
8,31 .
298,3) = –3,44.
= –19,6 .
103/(2,3
.
8,31 .
298,3) = –3,44.
Константа равновесия процесса растворения гипса равна:
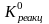 = 3,6 .
10–6.
= 3,6 .
10–6.
Значение показателя неравновесности составит:
= 10–6/(3,6 . 10–6) =2,6 . 10-3
Поскольку < 1, раствор ненасыщен относительно гипса, и идет процесс ого растворения.
Ответ: будет происходить растворение гипса.
