
Лекция_4_Химия
.pdf
Лекция № 4. Понятие о методе молекулярных орбиталей. Энергетические диаграммы молекулярных орбиталей для бинарных гомоядерных молекул. σ - и π- молекулярные орбитали. Диа - и парамагнитные молекулы. Ионная связь.
Межмолекулярные взаимодействия. Водородная связь.
Метод валентных связей достаточно наглядно объясняет образование и строение многих молекул, однако он не может объяснить многие факты, например, существование молекулярных ионов (Н2+, Не2+) или радикалов (·СН3, ·NH2 ), парамагнетизм молекул с четным числом электронов (О2, NO), которые находят объяснение в рамках метода молекулярных орбиталей (ММО).
Метод молекулярных орбиталей
Метод молекулярных орбиталей, разработанный Малликеном и Хундом, основан на допущении, что каждый электрон в молекуле находится в поле всех ядер и электронов атомов, образующих молекулу, и его состояние характеризуется волновой функцией Ψ, называемой молекулярной орбиталью. Каждой МО соответствует волновая функция, характеризующая область наиболее вероятного пребывания электронов определенной энергии в молекуле. Атомным s- , p -, d -, f - орбиталям соответствуют молекулярные σ -, π - , δ - , … орбитали, заполнение которых происходит в соответствии с принципом Паули, правилом Хунда, принципом наименьшей энергии.
Самым простым способом формирования молекулярной орбитали (МО) является
линейная комбинация атомных орбиталей (АО) (метод ЛКАО – МО).
Если в поле двух атомных ядер А и В находится один электрон, то он может находиться то у одного ядра, то у другого, и его состояние можно описать двумя молекулярными орбиталями Ψ и Ψ*, которые образуются линейной комбинацией атомных орбиталей:
Ψ = ΨА + ΨВ и Ψ* = ΨА – ΨВ
Молекулярная орбиталь называется связывающей Ψ, если она отвечает повышению электронной плотности в области между ядрами и тем самым усилению их притяжения, и разрыхляющей Ψ*, если электронная плотность понижается между ядрами и увеличивается за ядрами, что эквивалентно увеличению отталкивания ядер. Энергия связывающей МО ниже энергии исходной АО, энергия разрыхляющей МО выше энергии исходной атомной орбитали.
На рис. 1 изображены контурные диаграммы электронной плотности связывающей Ψ
(а) и разрыхляющей Ψ* (б) молекулярных орбиталей в частице Н2+.
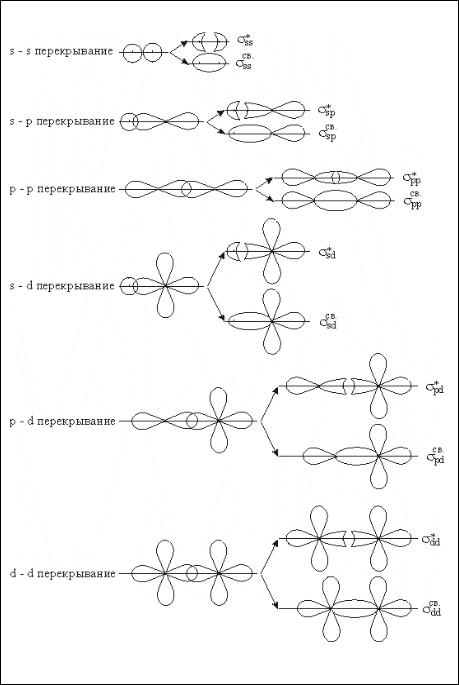
Как и в МВС, симметрия молекулярных орбиталей относительно линии связывания приводит к образованию σ - МО, в направлении, перпендикулярном линии связывания, — π - МО.
При перекрывании d -орбиталей образуются δ-
МО.
На рис. 2 показано образование σ — связывающих и σ — разрыхляющих МО при комбинации разных атомных орбиталей, на рис. 3 соответственно π -МО и π* - МО.
Перекрывание s –орбиталей приводит к образованию двух молекулярных орбиталей: σs-связывающей и σ *s -разрыхляющей.
Перекрывание р-орбиталей приводит к образованию шести молекулярных орбиталей разной симметрии. Из двух р-орбиталей взаимодействующих атомов, направленных вдоль линии связи, например оси X, образуются связывающая σ pz- и разрыхляющая σ*pz-орбитали, вдоль осей Z и Y — πрz - и πpy - связывающие и π* рz — и π* py - разрыхляющие МО.
Заселение электронами МО происходит в соответствии с принципом Паули, принципом наименьшей энергии и правилом Хунда.
Рис. 2. Образование σ – связывающих и σ – разрыхляющих молекулярных орбиталей
В связи с тем, что для однотипных орбиталей величина области перекрывания орбиталей уменьшается в ряду σ > π > δ , то и расщепление энергетических уровней при образовании МО из АО уменьшается в этом же порядке (рис.4), что приводит к изменению порядка заполнения σр − и π — МО в молекулах.
Для гомоядерных двухатомных молекул второго и последующих периодов, у которых p – подуровни атомов заполняются непарными электронами с одинаковыми значениями спинов, например B, С, N и их электронные аналоги, последовательность заполнения МО следующая:
σ ( 1s) < σ*(1s) < σ(2s) < σ*(2s) < π (2pz)= π (2py) < σ(2px) < π*(2pz)= π*(2py) < σ* (2px)....

Рис. 3. Образование π - связывающих и π - разрыхляющих молекулярных орбиталей
Рис. 4. Уменьшение степени расщепления энергетических уровней в ряду σ > π > δ
Для гомоядерных двухатомных молекул второго и последующих периодов, у которых p – подуровни атомов заполняются cпаренными электронами с антипараллельными значениями спинов, например (O – Ne) и их электронные аналоги, последовательность заполнения МО несколько изменяется:
σ ( 1s) < σ*(1s) < σ(2s) < σ*(2s) < σ(2px) < π (2pz)= π (2py) < π*(2pz)= π*(2py) < σ* (2px)....
Электронную конфигурацию молекулы можно изобразить в виде энергетической диаграммы или электронной формулы.
На рис. 5 приведена энергетическая диаграмма молекулярных орбиталей для молекулы водорода H2, электронная формула которой запишется так: [σ(1s)]2 или (σ 1s)2.

Рис. 5. Энергетическая диаграмма молекулы H2
Заполнение связывающей молекулярной орбитали σ 1s приводит к повышению электронной плотности между ядрами и определяет существование молекулы H2.
Метод МО обосновывает возможность существования молекулярного иона водорода H2 + и невозможность существования молекулы Hе2, поскольку в последнем случае заполнение связывающей и разрыхляющей σ 1s — орбиталей двумя электронами не приводит к изменению энергии изолированных атомов: [(σ 1s)2(σ *1s)2] (рис. 6). Следовательно, молекулы He2 не существует.
Рис. 6. Энергетическая диаграмма, подтверждающая невозможность существования молекулы He2
На рис. 7 приведена энергетическая диаграмма молекулярных орбиталей, образованных перекрыванием s – и р-орбиталей второго энергетического уровня для двухатомных гомоядерных молекул типа А2 .
Стрелками показано изменение порядка заполнения МО молекул, образованных атомами, у которых 2p -подуровень заполнен непарными электронами (B2, C2, N2), для которых связывающие π св(2py) и π св(2pz) расположены ниже σсв(2px), и спаренными электронами (O2, F2, Ne2), для которых связывающие π св(2py) и π св(2pz) расположены выше σсв(2px),

Рис. 7. Энергетическая диаграмма МО для гомоядерных молекул 2-го периода (стрелками показано изменение порядка заполнения связывающих σ- и π -МО)
В ММО используется понятие - порядок связи, который определяется как разность между количеством электронов на связывающих МО и количеством электронов на разрыхляющих МО, поделенная на число атомов, образующих связь.
|
|
|
|
N − N* |
||||
Для двухатомных молекул порядок связи n равен: n = |
|
|
, где N – количество |
|||||
2 |
|
|||||||
|
|
|
|
|
|
|
||
электронов на связывающих МО, N * - количество электронов на разрыхляющих МО. |
||||||||
Для молекулы H2 порядок связи соответственно равен |
n= |
2−0 |
=1 , для He2 |
|||||
2 |
||||||||
|
|
|
|
|
|
|||
n= |
2−2 |
=0 |
, что подтверждает невозможность существования двухатомной |
|||||
2 |
|
|
|
|
|
|||
молекулы. Известно, что инертные газы существуют в виде одноатомных молекул. Используя при заселении электронами молекулярных орбиталей те же правила, что и
при заполнении атомных орбиталей в изолированных атомах (принцип Паули, принцип минимума энергии и правило Хунда)), можно определить электронное строение двухатомных молекул, например N2 и O2 .
Запишем электронные конфигурации атомов в основном состоянии:
N |
- |
[1s22s22p3] |
или [K2s22p3]. |
O |
- |
[1s22s22p4] |
или [K2s22p4]. |
Электронные конфигурации молекул N2 и O2 можно записать следующим |
|||
образом: |
|
N [K2s22p3] + N [K2s22p3] → N2 [KK (σ2s)2 (σ*2s)2 (π(2py)2 (π2pz)2 (σ2px)2 ] |
|
N2 : |
|||
O2: O[K2s22p4] +O[K2s22p4] → O2 [KK (σ2s)2(σ*2s)2 (σ2px)2 (π2py)2 (π2pz)2 (π*2py)1(π*2pz)1]

На рис. 8 показана энергетическая диаграмма образования молекулы кислорода.
Рис.8. Энергетическая диаграмма молекулы кислорода
В молекуле O2 два электрона с параллельными спинами оказались на двух
вырожденных (с одинаковой энергией)  *-разрыхляющих молекулярных орбиталях. Наличие неспаренных электронов обусловливает парамагнитные свойства молекулы кислорода, которые особенно становятся заметными, если охладить кислород до жидкого состояния.
*-разрыхляющих молекулярных орбиталях. Наличие неспаренных электронов обусловливает парамагнитные свойства молекулы кислорода, которые особенно становятся заметными, если охладить кислород до жидкого состояния.
Молекулы парамагнетиков обладают собственным магнитным моментом, обусловленным внутренним движением зарядов. При отсутствии внешнего магнитного поля магнитные моменты молекул ориентированы беспорядочно, поэтому обусловленное ими результирующее магнитное поле равно нулю. Равен нулю и суммарный магнитный момент вещества.
Если же вещество поместить во внешнее магнитное поле, то под его действием магнитные моменты молекул приобретают преимущественную ориентацию в одном направлении, и вещество намагничивается - его суммарный магнитный момент становится отличным от нуля.
Молекулы диамагнетиков не имеют собственных магнитных моментов и при внесении в магнитное поле намагничиваются слабо.
Парамагнетиками являются все вещества, состоящие из химических частиц с нечетным числом электронов, например молекула NO, молекулярные ионы N2+, N2- и др.
Большинство веществ, молекулы которых содержат четное количество электронов, обладают диамагнитными свойствами (N2 , CO).
Объяснение парамагнитных свойств молекул кислорода и бора, содержащих четное количество электронов, дано на основании ММО. Молекула О2 имеет два непарных электрона на  *-разрыхляющих молекулярных орбиталях, молекула В2 имеет два непарных электрона на
*-разрыхляющих молекулярных орбиталях, молекула В2 имеет два непарных электрона на  *-связывающих молекулярных орбиталях (см. табл. 1).
*-связывающих молекулярных орбиталях (см. табл. 1).
Химические частицы, имеющие неспаренные электроны на внешних орбиталях, называют свободными радикалами. Они обладают парамагнетизмом и высокой реакционной способностью. Неорганические радикалы с локализованными неспаренными электронами, например (.Н), (.NН2), обычно являются короткоживущими. Они образуются при фотолизе,

радиолизе, пиролизе, электролизе. Для их стабилизации используют низкие температуры. Короткоживущие радикалы - промежуточные частицы во многих реакциях, особенно цепных и каталитических.
Порядок связи в молекуле N2 , у которой имеется избыток шести электронов на
связывающих МО, равен n = |
6 − 0 |
= 3 ; в молекуле O2 |
n = |
6 − 2 |
= 2. |
|
2 |
|
|
2 |
|
Понятие порядка химической связи в методе МО совпадает с понятием кратности связи в методе ВС (О2 - двойная, N2 -тройная связь). Величина порядка связи влияет на прочность связи. Чем выше порядок связи, тем больше энергия связи и меньше ее длина.
В табл. 1 приведены электронные конфигурации и характеристики связи для гомоядерных молекул первого и второго периодов. Как видно из таблицы, с увеличением порядка связи в ряду B2 - C2 - N2 увеличивается энергия и уменьшается длина связи.
Таблица 1. Электронные конфигурации и некоторые свойства молекул первого и второго периодов
|
|
|
Порядок |
Энергия |
Длина |
Магнитные |
|
Молекула |
Электронная конфигурация |
разрыва связи, |
связи, |
||||
связи |
свойства |
||||||
|
|
|
кДж/моль |
пм |
|||
|
|
|
|
|
|||
H2 |
[(σ1s )2] |
1 |
432,0 |
74,2 |
диамагнитная |
||
He2 |
[(σ1s)2 (σ*1s)2] |
0 |
Молекула не существует |
||||
Li2 |
[KK(σ2s)2] |
1 |
105 |
267,2 |
диамагнитная |
||
Be2 |
[KK(σ2s)2 (σ*2s)2] |
0 |
Молекула не существует |
||||
B2 |
[KK (σ2s)2 (σ*2s)2 (π2px)1(π2py)1 ] |
1 |
289 |
159 |
парамагнитная |
||
C2 |
[KK(σ2s)2 (σ*2s)2 (π2px)2(π2py)2 ] |
2 |
602 |
124 |
диамагнитная |
||
N2 |
[KK(σ2s)2 |
(σ*2s)2 (π2px)2(π2py)2 (σ2pz)2] |
3 |
941 |
110 |
диамагнитная |
|
O2 |
[KK(σ2s)2 |
(σ*2s)2 (σ2pz)2 (π2px)2(π2py)2 |
2 |
494 |
121 |
парамагнитная |
|
(π*2px)1(π*2py)1] |
|||||||
F2 |
[KK(σ2s)2 |
(σ*2s)2 (σ2pz)2 (π2px)2(π2py)2 |
1 |
155 |
142 |
диамагнитная |
|
(π*2px)2(π*2py)2] |
|||||||
Ne2 |
[KK(σ2s)2 |
(σ*2s)2 (σ2pz)2 (π2px)2(π2py)2 |
0 |
Молекула не существует |
|||
|
(π*2px)2(π*2py)2 (σ*2pz)2 ] |
|
|
|
|
||
Метод МО допускает нецелочисленные значения порядка связи. Это имеет место в молекулярных ионах, например, в молекулярнм ионе Н2+, для которого n = 0,5.
Закономерности в изменениях порядка, энергии и длины связи можно проследить на примерах молекулы и молекулярных ионов кислорода.
Электронная конфигурация и порядок связи молекулы кислорода приведены в табл. 1. Электронные конфигурации и порядок связи молекулярных ионов кислорода
следующие: |
[KK (σ2s)2(σ*2s)2 |
|
|
|
|
|
n = 2,5 ; |
O2+ - |
(σ2px)2 |
(π2py)2 |
(π2pz)2 |
(π*2py)1(π*2pz)0], |
|||
O2- - |
[KK (σ2s)2(σ*2s)2 |
(σ2px)2 |
(π2py)2 |
(π2pz)2 |
(π*2py)2(π*2pz)1], |
n = 1,5 . |
|
Понижение порядка связи в ряду частиц O2+, O2, O2- определяет уменьшение |
|||||||
прочности связи и находит экспериментальное подтверждение: |
|
||||||
O2+ : |
n = 2,5, Есв=629 кДж/моль, |
dсв=112 пм; |
|
||||
O2 : |
n = 2,0, Есв=494 кДж/моль, |
dсв=121 пм; |
|
||||
O2- : |
n = 1,5, Есв=397 кДж/моль, |
dсв=126 пм. |
|
||||
Все частицы имеют неспаренные электроны, проявляют парамагнитные свойства. Молекулы, имеющие одинаковое количество валентных электронов , называют
изоэлектронными частицами. К ним относятся молекулы CO и N2 , имеющие в сумме 14 электронов; молекулярный ион N2+ и молекула CN, имеющие 13 электронов. Изоэлектронным частицам ММО приписывает одинаковый порядок заполнения

электронами молекулярных орбиталей, одинаковый порядок связи, что позволяет объяснить близость физических свойств молекул.
При образовании гетероядерной молекулы типа АВ комбинация орбиталей двух разных атомов, приводящая к образованию молекулы, возможна только при близости энергий электронов, при этом орбитали атома c большей электроотрицательностью на энергетической диаграмме всегда располагаются ниже.
На рис. 9 приведена энергетическая схема образования молекулы CO.
На связывающие π - и σ - МО переходят четыре 2р-электрона атома кислорода и два 2р-электрона атома углерода. Энергия 2р-электронов соединяющихся атомов неодинакова: у атома кислорода заряд ядра и электроотрицательность выше по сравнению с атомом углерода, поэтому 2р-электроны в атоме кислорода сильнее притягиваются ядром и их положение на энергетической схеме соответствует более низкой энергии в сравнении с 2р- орбиталями атома углерода. Все шесть электронов, участвующих в образовании связи, размещаются на трех связывающих МО, следовательно, кратность связи равна трем, что объясняет значительное сходство в свойствах свободного азота и оксида углерода (II) (табл. 2).
Рис. 9. Энергетическая схема образования молекулы CO
Таблица 2. Некоторые физические свойства молекул CO и N2
Молекула |
Тпл, К |
Ткип, К |
Есв, кДж/моль |
dсв, пм |
|
|
|
|
|
CO |
66 |
83 |
1071 |
113 |
|
|
|
|
|
N2 |
63 |
78 |
941 |
110 |
|
|
|
|
|
Невалентные типы химической связи
Ионная связь.
При разности электроотрицательностей взаимодействующих атомов больше двух единиц смещение валентных электронов настолько велико, что можно говорить об их переходе от одного атома к другому с образованием заряженных частиц – катионов и анионов. Эти частицы взаимодействуют друг с другом по законам электростатики. Образующаяся при этом связь называется ионной. Соединения с ионной связью значительно

менее распространены, чем соединения с ковалентной связью, характерны для веществ, существующих в обычных условиях в кристаллическом состоянии и обладающих ионной проводимостью в расплавленном или растворенном состоянии. К соединениям с ионной связью относятся прежде всего типичные соли - галогениды щелочных металлов, имеющие ионную кристаллическую решетку. Ионные молекулы существуют только при высоких температурах в пара х ионных соединений.
Ионная связь в отличие от ковалентной ненаправленна, т. к. ионы образуют сферически симметричные силовые поля, не обладает насыщаемостью, т. к. взаимодействие ионов противоположного знака происходит по разным направлениям, делокализована, т. к. в области связывания не наблюдается повышенной электронной плотности.
Электростатическая модель ионной связи рассматривает ее образование как взаимодействие противоположно заряженных ионов, каждый из которых характеризуется
своим потенциалом Φi= |
ze |
, где ze – заряд иона, r- радиус иона. |
r |
Энергию образования молекулы АВ можно определить как алгебраическую сумму нескольких энергий: энергии притяжения ионов Аz+ и Вz-, энергии отталкивания ионов, энергии сродства к электрону атома В и энергии ионизации атома А.
Для однозарядных ионов А+В- |
энергия образования ЕАВ молекулы АВ выражается |
|||
уравнением: |
e2 |
1 |
|
|
-ЕАВ = |
|
где e - заряд электрона, d — расстояние между |
||
|
(1 - n |
) + EB – IA , |
||
d |
||||
ионами в молекуле, n - учитывает долю энергии отталкивания, которая обычно составляет 10% энергии притяжения, EB - энергия сродства к электрону атома В, IA - энергия ионизации атома А.
Для газообразной молекулы KСl проведен расчет энергии ЕАВ без учета поляризации
ионов: d =2,67·10-10 эВ, ECl =3,61 эВ, IK = 4,34 эВ и энергия связи равна Есвязи = -ЕАВ= 4,06 эВ ~ 391 кДж..
Экспериментально определенная энергия ионизации молекулы KСl равна 422 кДж/моль.
В газах, жидкостях и кристаллах каждый ион стремится окружить себя наибольшим числом ионов противоположного заряда.
Расположение ионов в пространстве определяется соотношением их радиусов. Если отношение радиуса катиона к радиусу аниона находится в пределах
r+/r- = 0,41-0,73, то вокруг центрального атома - катиона или аниона координируется шесть ионов противоположного заряда. Такая координация называется октаэдрической, а тип кристаллической решетки обозначается как тип NaCl.
Если отношение радиуса катиона к радиусу аниона находится в пределах
r+/r- = 0,73-1,37, то вокруг центрального атома - катиона или аниона координируется восемь ионов противоположного заряда. Такая координация называется кубической, а тип кристаллической решетки обозначается как тип CsCl.
При сближении ионов происходит деформация их сферических электронных оболочек, что приводит к смещению электрического заряда и появлению у частицы индуцированного электрического момента. Это явление называется поляризацией иона. Поляризация ионов – двухсторонний процесс, в котором сочетаются поляризуемость ионов и поляризующее действие, зависящие от электронного строения, заряда и размера иона. Поляризуемость минимальна у ионов с конфигурацией инертного газа (ns2np6), которые в то же время обладают наибольшим поляризующим действием. Значительная поляризуемость ионов d – элементов объясняется наличием большого количества валентных электронов, в результате увеличивается ковалентная составляющая связи.
Эффектом поляризации объясняются многие различия в свойствах веществ, например, плохая растворимость в воде хлорида серебра по сравнению с хлоридами щелочных

металлов, различия в температурах плавления, например, Т пл, AgCl =4550С, T пл, NaCl= 8010С. Электронные конфигурации ионов: Ag+ - [Kr]4d 105s0 ; Na+ - [Ne]3s0.
Менее симметричная электронная конфигурация иона Ag+ вследствие наличия 4d 10 -электронов вызывает более сильную его поляризацию, что приводит к появлению
направленной ковалентной составляющей связи по сравнению с NaCl, у которого степень ионности связи выше.
Металлическая связь.
Важнейшим свойством металлов является высокая электрическая проводимость, которая уменьшается с ростом температуры. Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому в кристаллической решетке металла эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. "Обобществленные" электроны передвигаются в пространстве между катионами и удерживают их вместе. Межатомные расстояния в металлах больше, чем в их соединениях с ковалентной связью. Такая связь существует не только в кристаллах металлов, но и в их расплавах и в аморфном состоянии. Она называется
металлической, определяет электронную проводимость металлов.
Электроны в металле беспорядочно движутся, переходя от одного атома к другому, образуя электронный газ. Положительно заряженные ионы металла лишь слегка колеблются около своего положения в кристаллической решетке, при нагревании металла колебания катионов усиливаются и электрическое сопротивление металла увеличивается. Благодаря наличию свободных, не связанных с определенными атомами электронов, металлы хорошо проводят электрический ток и тепло.
Такие физические свойства металлов как высокая тепло- и электропроводность, пластичность и ковкость, металлический блеск можно объяснить исходя из представлений об электронном газе.Металлическая связь является достаточно прочной, т. к. большинство металлов имеет высокую температуру плавления.
Более строгую интерпретацию металлической связи позволяет дать метод молекулярных орбиталей. Напомним, что при взаимодействии двух атомных орбиталей образуются две молекулярные орбитали: связывающая и разрыхляющая. Происходит расщепление энергетического уровня на два. Если взаимодействуют одновременно четыре атома металла, образуются четыре молекулярные орбитали. При одновременном взаимодействии N частиц, содержащихся в кристалле, образуется N молекулярных орбиталей, причем величина N может достигать огромных значений, сравнимых с числом
Авогадро (6 ·1023). Молекулярные орбитали, образованные атомными орбиталями одного подуровня, находятся настолько близко, что практически сливаются, образуя определенную
энергетическую зону (рис. 10).
Рис. 10. Образование энергетической зоны в кристалле
Рассмотрим образование энергетических зон на примере металлического натрия,
