
Методы исследования в медицинской бактериологии
.pdf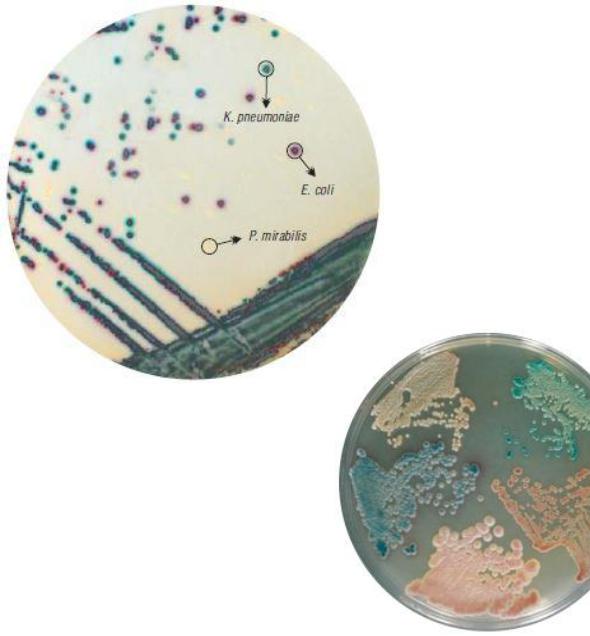
101
ультрафиолетовом облучении. Хромогенные питательные среды используют уже при первичном посеве исследуемого материала для выделения чистой культуры. Поэтому идентификация культуры возможна уже в течение первых суток исследования. Использование хромогенных питательных сред ускоряет процесс идентификации бактерий до 24 часов при первичном посеве до рода и вида.
Основными производителями хромогенных питательных сред являются
компании HiMedia, CHROMagar,ИспользованиеMerck, Oxoid. Разработ ые хромогенные питательные среды предназначены для быстрого бнаружения сследуемом
материале кишечной палочки, сальмонелл, энтерококков, стафилококковхро,
клостридий, синегнойной палочки, устойчивого к метициллину стафилококка и
других бактерий. На рисунке 93 представлс селективнымивариант использования хромогенной питательной среды для выявления кишечной па очки, лебсиеллы и протея.
Рисунок 93 – Использование хромогенных сред для первичной идентификации
бактерий. Заимствовано из Интернет-ресурсов. Идентификация
Лидером производителеймикробоввысококачественныхдо рода, хромогенных сред для микробиологических исследований является компания HiMedia (Индия). Эта компания поставляет навидарынок хромогенные среды для выделения в течение 24 часов целого ряда микроорганизмов: Escherichia coli и других колиформных
бактерий, |
сальмонелл, |
энтерогеморрагических |
эшерихий, |
энтерококков, |
||
Staphylococcus aureus, клостридий, синегнойной палочки, Candida |
albicans и др. |
|||||
(таблица 14). |
|
|
|
|
|
|
Таблица 14 – Примеры выпускаемых компанией HiMedia хромогенных сред |
||||||
|
|
|
|
|
|
|
Обозначение |
|
|
Наименование |
|
Назначение |
|
М1078/М1082 |
|
Salmonella Differential Agar/ Modified |
|
Для идентификации и |
||
|
|
102 |
|
(RajHans Medium) Дифференциальный агар |
дифференциации сальмонелл |
|
для сальмонелл |
от других энтеробактерий, |
|
Дифференциальный агар для сальмонелл, |
особенно протеев |
|
модифицированный (среда Радж-Ханса) |
|
М1293 |
HiCrome ECC Agar |
Для предварительной |
|
Хромогенный агар ECC |
идентификации Escherichia coli |
|
|
и других колиформных |
|
|
бактерий в пищевых продуктах |
|
|
и в пробах из окружающей |
|
|
среды |
М1294 |
HiCrome ECC Selective Agar Base |
Для обнаружения Escherichia |
|
Основа хромогенного селективного агара |
coli и других колиформных |
|
ECC |
бактерий в пищевых продуктах |
|
|
и пробах воды |
М1295/ |
HiCrome E. coli Agar |
Для обнаружения и подсчета |
М12951 |
Хромогенный агар для обнаружения и |
Escherichia coli в пищевых |
|
подсчета E. coli |
продуктах без дальнейшего |
|
|
подтверждения на мембранных |
|
|
фильтрах или реактивом на |
|
|
индол |
Компания Merck выпускает хромогенные питательные среды для выявления сальмонелл, листерий, кишечной палочки и колиформных бактерий.
Агаризованную питательную среду асептически разливают в чашки Петри в расплавленном состоянии при температуре 45-50°С. Среду, разлитую в чашки Петри, больше не стерилизуют.
5.2.2. Системы создания специальных атмосферных условий культивирования
Для культивирования некоторых бактерий (облигатных анаэробов, микроаэрофилов, капнофилов) необходимо создать специальные атмосферные условия. Посевы анаэробов культивируют в атмосфере с содержанием кислорода не более 0,1%. Инкубирование посевов анаэробных бактерий проводят в термостатах в герметически закрытых емкостях – эксикаторах, микроанаэростатах, анаэробных пакетах или в специальных анаэробных камерах, снабженных термостатом.
Просто устроенные системы для культивирования анаэробных бактерий представлены на рисунке 94.

103
а б в Рисунок 94 – Системы для выращивания анаэробных бактерий: а – эксикатор, б –
анаэростат, в – использование стеклянной емкости и зажженной свечи. Заимствовано из Интернет-ресурсов.
Для поглощения кислорода в замкнутой воздушной среде таких систем используют раствор пирогаллола, гидросульфит натрия, для получения углекислого газа применяют смесь лимонной или серной кислоты с бикарбонатом натрия. Например, при использовании эксикатора на дно помещают открытую чашку Петри с химическими веществами, связывающими кислород (например, пирогаллол с едким натром). Сверху на специальный выступ эксикатора ставят фарфоровую решетку, а на нее – пробирки или чашки с посевами. Крышку эксикатора плотно закрывают. Для герметичности края эксикатора смазывают вазелином. После этого эксикатор помещают в термостат.
В настоящее время для создания анаэробных или микроаэрофильных условий в основном применяют герметичные контейнеры и специальные газогенерирующие пакеты. Производителями подобных герметичных контейнеров и газогенерирующих пакетов являются специализированные компании.
Контейнеры представляют собой пластиковые герметически закрывающиеся емкости, в которых сохраняется создаваемая с помощью генерирующих пакетов газовая атмосфера (рисунок 95).
Рисунок 95 – Герметичные контейнеры для создания специальной атмосферы. Заимствовано из Интернет-ресурсов.

104
Газогенерирующие пакеты содержат химические соединения, способные создавать определенную атмосферу (таблица 15). В газогенерирующих системах водород генерируется таблетками боргидрида натрия, углекислый газ вырабатывается при взаимодействии лимонной кислоты с бикарбонатом натрия и т.д.
Таблица 15 – Примеры газогенерирующих пакетов фирмы GasPak для создания специальных атмосферных условий для культивирования бактерий
Тип пакета |
Создаваемая атмосфера |
Тип микроорганизмов |
GasPak |
17-19% О2 |
Аэробные капнофилы |
|
5-10% СО2 |
|
CampyPak |
5-8% О2 |
Микроаэрофилы |
|
5-10% СО2 |
|
GasPak Н2/СО2 |
<1,2% О2 |
Строгие анаэробы |
|
5-10% СО2 |
|
Внешний вид газогенерирующих пакетов представлен на рисунке 96.
Рисунок 96 – Газогенерирующие пакеты. Заимствовано из Интернет-ресурсов.
Анаэробная камера (рисунок 97) представляет собой герметичный бокс, оснащенный термостатом, системой подачи “анаэробного газа”. “Анаэробный газ” может быть трехкомпонентным (смесь азота, углекислого газа и водорода) или двухкомпонентным (смесь азота и водорода). Все манипуляции в такой камере выполняются в бескислородных условиях. Вместимость анаэробной камеры – до 200 чашек Петри. В основном такими камерами оснащаются референс-лаборатории.

105
Рисунок 97 – Анаэробная камера. Заимствовано из Интернет-ресурсов.
Микроанаэростат (рисунок 98) представляет собой герметично закрывающуюся емкость объемом 3-7 л и вместимостью 10-12 чашек Петри. Бескислородные условия в микроанаэростате создаются путем создания в нем вакуума и последующего заполнения “анаэробным газом” или путем химического связывания кислорода газогенерирующими системами. Создание бескислородных условий в микроанаэростатах контролируется с помощью индикаторной тестполоски, импрегнированной метиленовой синью, которая обесцвечивается в случае образования бескислородной атмосферы.
Рисунок 98 – Микроанаэростаты. Заимствовано из Интернет-ресурсов.
В лабораторной практике часто используются СО2-термостаты, позволяющие создавать атмосферу углекислого газа (рисунок 99).

106
Рисунок 99 – СО2-инкубатор. Заимствовано из Интернет-ресурсов.
Анаэробные пакеты представляют собой пластиковые прозрачные герметически закрывающиеся пакеты вместимостью 1-2 чашки Петри. Анаэробные условия в пакете создаются путем химического связывания кислорода. Анаэробные условия также контролируются тест-полоской. Анаэробные пакеты удобны для использования в небольших лабораториях, для транспортировки материалов в лабораторию, в полевых условиях.
5.2.3. Получение чистой культуры бактерий
Классический культуральный (бактериологический) метод остается “золотым стандартом” диагностики большинства инфекционных заболеваний. Он осуществляется в несколько этапов.
1 этап. Посев исследуемого материала на питательные среды.
2 этап. Пересев изолированных колоний на скошенный агар в пробирки для получения чистой культуры бактерий.
3 этап. Идентификация чистой культуры бактерий (определение рода и вида), определение чувствительности чистой культуры к антибиотикам и бактериофагам.
4 этап. Выдача заключения.
Основной недостаток культурального метода – длительность исследования. Например, для быстрорастущих микроорганизмов результат может быть получен через 2-3 суток после посева на плотную питательную среду, а для медленно растущих бактерий и микроскопических грибов – от 5-7 до 21 суток.
Чистой культурой называют популяцию микроорганизмов одного вида, выращенную из изолированной колонии на плотной или в жидкой питательной среде.
Методы получения чистой культуры бактерий:
- методы механического разобщения бактерий;

107
-биологический метод (заражение чувствительных лабораторных животных);
-методы, основанные на избирательной чувствительности бактерий к физическим факторам (высокая и низкая температура) или химическим веществам (кислотам, щелочам, солям, антибиотикам, красителям).
Наиболее часто для получения чистой культуры бактерий используют принцип механического разобщения. При этом исследуемый материал высевают на плотную питательную среду таким образом, чтобы получить изолированные колонии для последующего их пересева на скошенный агар в пробирках.
Методы механического разобщения бактерий:
-посев исследуемого материала на питательный агар в чашки Петри с помощью бактериологической петли, шпателя, пипетки. При таком способе материал, находящийся на петле (шпателе, пипетке), расходуется постепенно и переносится на среду по линиям посева все в меньшем и меньшем количестве;
-посев исследуемого материала путем последовательных разведений в питательной среде;
-посев подвижных бактерий в конденсационную воду на скошенный агар.
В настоящее время исторический интерес представляют методы получения
изолированных колоний, предложенные Пастером и Кохом. Однако эти методы до сих пор описывают в учебной литературе, хотя в практической работе они не используются.
Метод Пастера представляет собой последовательные разведения исследуемого материала в жидкой питательной среде до тех пор, пока в среде не окажется одна микробная клетка, давшая рост.
Метод Коха представляет собой последовательные разведения исследуемого материала в расплавленном агаре с последующим переносом агара с разведенной культурой в чашку Петри (рисунок 100).
Разведения
Исследуемый
материал
1:10 |
1:100 |
1:1000 |
1:10000 |
1:100000 |
Рисунок 100 – Получение изолированных колоний методом Коха.
В настоящее время посев исследуемого материала на питательные среды для получения чистой культуры проводится методом механического разобщения бактерий путем посева исследуемого материала на поверхность плотной питательной среды штрихом или с помощью шпателя Дригальского.

Посев однократным истощающим
108
Чаще проводят посев , для этого различные варианты
штрихомрихомпосевыиспользуя секторам
посева (рисунок 101).
а б Рисунок 101 – Посев однократным истощающим штрихом (а) и посевы по секторам
(б). Заимствовано из Интернет-ресурсов.
Техника посева штрихом представлена на рисунке 102.
Рисунок 102 – Посев бактериологической петлей по поверхности питательного агара в чашке Петри для выделения чистой культуры (Воробьев А.А. и
др., 2006).
Результаты посева штрихом представлены на рисунке 103.
Рисунок 103 - Результаты посева штрихом. Заимствовано из Интернет-ресурсов.

109
При посеве методом Дригальского используют несколько чашек с питательной средой. Исследуемый материал наносят на первую чашку, растирают шпателем круговыми движениями по поверхности агара, а затем этим же шпателем
последовательно наносят та шийся на шпателе материал на другие чашки |
|
(рисунок 104). |
Посев по Дригальскому |
|
|
Рисунок 104 – Посев по Дригальскому: 1 – шпатель; 2 – техника посева; 3 – результат посева. Заимствовано из Интернет-ресурсов.
Всовременных микробиологических диагностических системах используются новые инновационные принципы посева исследуемого материала на плотные питательные среды в чашках Петри: посев по кругу с помощью пластикового аппликатора или посев магнитным крутящимся шариком.
Вчастности, посев по кругу с помощью пластикового аппликатора применяется в системе PREVI Isola (рисунок 105).
Рисунок 105 - Система PREVI Isola. Заимствовано из Интернет-ресурсов.

110
В системе PREVI Isola посев осуществляется с помощью одноразового пластикового аппликатора, автоматически производящего круговое движение по поверхности агара. В результате этого обеспечивается хорошая изоляция колоний (рисунок106).
1 2
Рисунок 106 – Ручной посев штрихом (1) и посев с помощью PREVI Isola (2). Заимствовано из Интернет-ресурсов.
Система PREVI Isola позволяет засевать исследуемый образец одновременно на различные среды, подаваемые в аппарат автоматически по заранее установленной программе (до 10 сред).
Посев магнитным крутящимся шариком используется в высокотехнологичной системе WCA-3 (BD Kiestra). В этой системе металлический шарик с исследуемым материалом на своей поверхности под действием магнитных сил совершает вращение и движение по пластинке агара, покрывая до 95% площади чашки (рисунок 107).
Рисунок 107 – Высокотехнологичная система WCA-3 (BD Kiestra). Заимствовано из Интернет-ресурсов.
