
Методы исследования в медицинской бактериологии
.pdf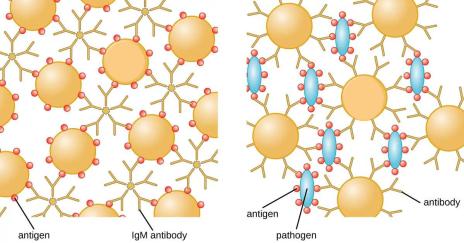
171
диагностикумы представляют собой препараты, содержащие белок А стафилококков, сенсибилизированный кроличьими О1 и О139 холерными сыворотками. Холерные антитела, сорбированные на стафилококковом белке, при соединении с холерными антигенами вызывают реакцию коагглютинации.
9.1.4. Реакция латекс-агглютинации
Реакция агглютинации латекса или реакция латекс-агглютинации (РАЛ или РЛА) предусматривает использование латексного диагностикума. Латексный диагностикум представляет собой частицы латекса (полистирола), покрытые антигенами (латексный антигенный диагностикум) для выявления антител или антителами (латексный антительный диагностикум) для выявления антигенов.
Частицы латекса, используемые в серологических реакциях, имеют размер 0,79-0,81 мкм. Взвесь таких частиц латекса разводится в соотношении 1:10 боратным или глициновым буфером (рН 8,2). Приготовленную взвесь “нагружают” антигеном или антителами в соотношении 1:10 и выдерживают в течение 2 часов при температуре
37ОС.
Частицы латекса, нагруженные антигеном или антителами, используют в реакции определения неизвестного антигена по известной сыворотке или неизвестных антител по известному антигену. Реакция латекс-агглютинации проявляется в течение 2-3 минут. Наступившая реакция латекс-агглютинации хорошо видна невооруженным глазом особенно на темном фоне или под малым увеличением микроскопа. При положительной реакции наблюдают образование фестончатого осадка - “розетки агглютинации”. При отрицательном результате отмечается образование “пуговки”.
Структура и механизм действия латексных диагностикумов представлены на рисунке 172.
Частица
латекса
Частица
латекса
|
|
Антиген |
Антитело |
Антиген |
Антитело |
Патоген |
|
|
|
||
а |
|
|
б |
Рисунок 172 – Структура и механизм действия антигенного (а) и антительного (б) латексных диагностикумов. Заимствовано и адаптировано из Интернет-ресурсов.

172
Наборы для идентификации и дифференциации бактерий из клинического материала методом латексной агглютинации выпускаются в жидком или сухом виде. Сухие наборы предпочтительнее, так как латексный реагент нанесен на реакционную карточку и лиофилизирован. Такие наборы можно хранить при температуре плюс 2-25ОС в течение 2 лет.
Механизм взаимодействия антительного латексного диагностикума с бактериальными антигенами представлен на рисунке 173.
Бактериальные антигены
Антитела к бактериальным антигенам Частицы латекса
Рисунок 173 – Механизм взаимодействия антительного латексного диагностикума с бактериальными антигенами. Заимствовано из Интернет-ресурсов.
Учёт результатов латекс-агглютинации проводят через 10-15 минут при косом освещении лучше на тёмном фоне. Результат латекс-агглютинации представлен на рисунке 174.
а б Рисунок 174 – Отрицательный (а) и положительный (б) результат реакции латекс-
агглютинации. Заимствовано из Интернет-ресурсов.
Латекс-агглютинация используется для выявления антигенов в небольшом объеме материала при индикации S. pneumoniae, H. influenzae, N. meningitides в
различных биологических жидкостях (ликвор, сыворотка крови, моча), при диагностике сальмонеллезов, иерсиниозов и других заболеваний. Разработаны также наборы для выявления антигенов стрептококков группы А в мазках из зева; для первичной экспресс-идентификации колоний стрептококков групп А, В, С, F, энтерококков, золотистого стафилококка, Neisseria gonorrhoeae, кампилобактера,

173
Clostridium difficile, хеликобактера, кишечной палочки, легионелл и других бактерий (рисунок 175).
Рисунок 175 – Наборы для выявления Staphylococcus aureus и Salmonella spp.
методом латекс-агглютинации. Заимствовано из Интернет-ресурсов.
Чувствительность метода латекс-агглютинации составляет 103-106 клеток в 1
мкл.
9.2. Реакция прямой гемагглютинации
Реакция прямой гемагглютинации представляет собой способность эритроцитов склеиваться при адсорбции на них определенных антигенов. Так как это склеивание происходит без участия иммунной сыворотки (антител), реакция прямой гемагглютинации не является серологической.
К реакциям прямой гемагглютинации относятся реакции определения групп крови в системе АВ0 и вирусная гемагглютинация.
Самой распространенной реакцией прямой гемагглютинации является гемагглютинация, применяемая для определения групп крови в системе АВО (реакция гемагглютинации – РГА). Для определения агглютинации (или её отсутствия) используют стандартные антисыворотки с анти-А и анти-В- агглютининами. Реакция называется прямой, так как исследуемые антигены являются естественными компонентами эритроцитов.
Компоненты РГА: исследуемая кровь (антигены), стандартные сыворотки (антитела) групп Оab(I), Ab(II) и Ba(III). На стекло или планшет наносят по 2 капли стандартной сыворотки разных групп. Рядом со стандартными сыворотками наносят по 1 капле исследуемой крови. Встряхиванием перемешивают сыворотку с кровью, периодически покачивают и через 5 минут учитывают результат:
-нет агглютинации во всех сыворотках - Оab(I) группа крови;
-агглютинация в сыворотках Оab(I) и Ba(III) - Ab(II) группа крови;
-агглютинация в сыворотках Оab(I) и Ab(II) - Ba(III) группа крови;

174
- агглютинация во всех сыворотках – Ab0(IV) группа крови.
Результат РГА при определении групп крови представлен на рисунке 176.
а б Рисунок 176 – Результат РГА при определении групп крови: а – отрицательная РГА;
б – положительная РГА. Заимствовано из Интернет-ресурсов.
Общие с прямой гемагглютинацией механизмы имеет вирусная гемагглютинация. Например, вирусы гриппа способны спонтанно агглютинировать эритроциты птиц и млекопитающих в результате наличия на поверхности вирусных частиц гемагглютинина. При добавлении таких вирусов к суспензии эритроцитов наблюдается образование сгустков, состоящих из эритроцитов и вирусных частиц (рисунок 177).
Эритроциты |
Вирусы |
Гемагглютинация |
Рисунок 177 – Вирусная гемагглютинация. Заимствовано из Интернет-ресурсов.
9.3. Реакция непрямой гемагглютинации
Реакцию непрямой или пассивной гемагглютинации (РНГА или РПГА) с танизированными (обработанными танином) эритроцитами проводят в двух вариантах: с известным антигеном для обнаружения антител и с известными антителами (сывороткой) для выявления неизвестного антигена. Поэтому в РНГА используют эритроцитарные диагностикумы: эритроцитарный антигенный диагностикум (для обнаружения антител) или эритроцитарный антительный диагностикум (для обнаружения антигенов).
РНГА для обнаружения антител в сыворотке крови проводят с помощью
эритроцитарных антигенных диагностикумов, представляющих собой фиксированные на эритроцитах антигены возбудителя (рисунок 178).

175
Антигены
Эритроцит
Рисунок 178 – Структура антигенного эритроцитарного диагностикума и схема РНГА. Заимствовано из Интернет-ресурсов.
РНГА для обнаружения антигенов в исследуемом материале проводят с помощью эритроцитарных антительных диагностикумов, представляющих собой фиксированные на эритроцитах антитела. Такая разновидность РНГА называется реакцией обратной непрямой гемагглютинации (РОНГА). В
эритроцитарных антительных диагностикумах антитела соединены с эритроцитами своими Fc-фрагментами (рисунок 179).
Рисунок 179 – Структура антительного эритроцитарного диагностикума и схема РОНГА. Заимствовано из Интернет-ресурсов.
Приготовление эритроцитарных диагностикумов для РНГА включает сле-
дующие этапы:
1 этап - фиксация эритроцитов формальдегидом, глютаровым или акриловым альдегидами. Такие обработанные эритроциты длительно сохраняются. Для изготовления диагностикумов используют эритроциты барана, человека, кур и др.
2 этап - обработка фиксированных эритроцитов раствором танина. В результате этого эритроциты приобретают свойство необратимо адсорбировать на своей поверхности антигены или антитела.
3 этап - сенсибилизация танизированных эритроцитов антигенами или антителами.
РНГА может осуществляться в следующих вариантах:
-определение титра антител в сыворотке крови больного с использованием соответствующего эритроцитарного антигенного диагностикума;
-выявление в сыворотке крови больного антигенов возбудителя с
использованием соответствующего эритроцитарного антительного диагностикума.

176
При постановке РНГА для определения титра антител в сыворотке крови используют агглютинационные пробирки или полистироловые планшеты. С этой целью к разведениям сыворотки крови больного добавляют эритроцитарный антигенный диагностикум. При положительной реакции склеенные антителами эритроциты выпадают на дно в виде фестончатого осадка (“перевернутого зонтика”). При отрицательной реакции эритроциты оседают на дно в виде плотного осадка (“пуговки”). Результаты РНГА представлены на рисунке 180.
Рисунок 180 – Результат РНГА в планшетах при установлении титра антител в сыворотке крови больного. Заимствовано из Интернет-ресурсов.
Отличительные особенности осадка при положительной и отрицательной РНГА представлены на рисунке 181.
1:20 |
1:40 |
1:80 |
1:160 |
1:320 |
1 :640 Контроль |
“Зонтик” |
“Пуговка” |
Рисунок 181 - Особенности осадка при положительной и отрицательной РНГА. Заимствовано из Интернет-ресурсов.

177
РНГА используется с целью обнаружения ботулинического токсина в исследуемых пробах, например, в сыворотке крови больного. Возбудитель ботулизма вырабатывает токсины семи типов, однако чаще других у человека вызывают поражения токсины типов А, В и Е. Для постановки РНГА используют сыворотку больного и эритроциты, нагруженные антителами антитоксических противоботулинических сывороток типов А, В и Е (эритроцитарные антительные диагностикумы). В качестве контроля используют нормальную сыворотку крови. Схема РНГА представлена в таблице 21.
Таблица 21 – Постановка РНГА при диагностике ботулизма
Компоненты |
|
|
Лунки |
|
|
|
|
|
1 |
2 |
3 |
|
4 |
5 |
6 |
Исследуемая сыворотка, мл |
0,5 |
0,5 |
0,5 |
|
|
|
|
Нормальная сыворотка, мл |
|
|
|
|
0,5 |
0,5 |
0,5 |
Диагностикум ботулинический |
|
|
|
|
|
|
|
эритроцитарный антительный: |
|
|
|
|
|
|
|
- тип А |
0,1 |
|
|
|
0,1 |
|
|
- тип В |
|
0,1 |
|
|
|
0,1 |
|
- тип Е |
|
|
0,1 |
|
|
|
0,1 |
Результат |
- |
- |
+ |
|
- |
- |
- |
Вположительном случае эритроциты оседают на дно лунки в виде зонтика,
апри отрицательной реакции эритроциты оседают в виде пуговки. Результаты реакции представлены на рисунке 182.
1 |
2 |
3 |
4 |
5 |
6 |
Рисунок 182 – Результаты РНГА при установлении типа ботулинического токсина. Номера лунок соответствуют номерам, представленным в таблице. Положительный результат в 3 лунке. Заимствовано из Интернет-ресурсов.
РНГА при диагностике ботулизма исключает использование лабораторных животных (белых мышей), издавна используемых в установлении типа ботулинического токсина (реакция нейтрализации токсина в биопробе на лабораторных животных).
9.4. Реакция торможения гемагглютинации
Реакция торможения гемагглютинации (РТГА) широко используется при исследовании гемагглютинирующих вирусов. Она основана на том, что некоторые вирусы (в частности, вирусы гриппа) обладают гемагглютинирующей способностью за счет наличия у них гемагглютининов. При контакте таких вирусов с эритроцитами наступает гемагглютинация (рисунок 183).
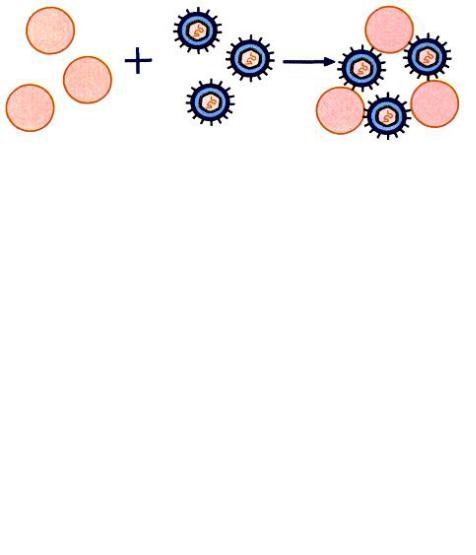
178
Эритроциты |
Вирусы |
Гемагглютинация |
|
|
Рисунок 183 – Реакция гемагглютинации (Воробьев А.А., Быков А.С., 2003).
При наличии в сыворотке крови соответствующих антител гомологичный вирус (антиген) связывается с этими антителами и утрачивает свою гемагглютинирующую активность, так как образуется комплекс антиген + антитело. В результате этого вирусы нейтрализуются антителами и теряют способность агглютинировать эритроциты. В РТГА эритроциты являются индикатором наличия вируса в смеси. Агглютинация эритроцитов указывает на наличие в смеси свободного вируса, а отсутствие гемагглютинации (торможение гемагглютинации) - на нейтрализацию вируса антителами (рисунок 184).
Эритроциты |
|
Вирусы |
|
Антивирусные |
Нейтрализация вирусов |
|
антителами, |
|
|
антитела |
|
|
торможение гемагглютинации |
|
|
|
Рисунок 184 – Схема реакции торможения гемагглютинации (Воробьев А.А., Быков А.С., 2003).
РТГА применяют для диагностики многих вирусных болезней, возбудители которых могут агглютинировать эритроциты различных животных (вирусы гриппа, кори, краснухи, клещевого энцефалита).
РТГА ставят в пробирках (макрометод) или в специальных полистироловых планшетах (микрометод). РГТА позволяет обнаружить и определить титр антител в сыворотке крови больного с помощью известного вируса или идентифицировать неизвестный вирус путем постановки реакции с заведомо известными сыворотками (антителами).
Определение титра антител в сыворотке крови больного с помощью РТГА. Для постановки реакции используют пластиковые планшеты. В лунках готовят 2-кратные разведения исследуемой сыворотки в объеме 0,25 мл. Затем в лунки добавляют по 0,25 мл взвеси вируса и инкубируют 2 часа при температуре 37°С. Затем добавляют по 0,5 мл 1% взвеси эритроцитов, инкубируют еще 2 часа и оценивают результат по наличию гемагглютинации.

179
При положительной реакции (торможении гемагглютинации) образуется плотный осадок эритроцитов на дне лунки в виде “пуговки”. Отрицательная реакция (гемагглютинация) проявляется образованием фестончатого осадка в виде “зонтика”. Титр антител определяют по последней лунке с положительной РТГА (рисунок 185).
|
Разведение сыворотки |
|
||
1:10 |
1:20 |
1:40 |
1:80 |
1:160 |
Рисунок 185 – Определение титра противовирусных антител с помощью РТГА. Заимствовано из Интернет-ресурсов.
Идентификация (типирование) вируса с помощью РТГА проводят с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации.
Достоинства РТГА - простота техники постановки и быстрый результат. Однако эту реакцию можно использовать только для гемагглютинирующих вирусов.
9.5. Иммуноферментный анализ
Иммуноферментный анализ (ИФА, enzyme-linked immunosorbent assay, ELISA) представляет собой метод, основанный на специфическом связывании антигена с антителом. При этом один из компонентов (антиген или антитело) конъюгирован (связан) с ферментом (так называемый конъюгат). В качестве маркировочных ферментов используют пероксидазу, щелочную фосфатазу или бетагалактозидазу. При добавлении в реакционную смесь хромогенного субстрата (вещества, меняющего цвет под влиянием фермента) образуется окрашенный продукт. В частности, при использовании пероксидазы среда окрашивается в желтокоричневый цвет, а при использовании щелочной фосфатаза – в желто-зеленый цвет. Интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител, что учитывается с помощью фотометра. При работе с тест-системами ИФА кроме фотометра используются термостат-встряхиватель (шейкер) и автоматический промыватель планшетов (вошер). Оборудование, используемое в ИФА, представлено на рисунке 186.

180
а |
б |
в
Рисунок 186 – Оборудование для ИФА: шейкер (а), вошер (б) и фотометр (в). Заимствовано из Интернет-ресурсов.
Для осуществления этого анализа коммерческие фирмы выпускают наборы, в которых предварительно на твердом носителе (лунки пластикового планшета) сорбируют антигены (для выявления антител) или антитела (для выявления антигенов). Затем в лабораторных условиях в лунки добавляют остальные ингредиенты (сыворотку или антиген, конъюгат, субстрат). В положительном случае антитела соединяются с антигенами, ферменты разлагают субстрат и проявляются окрашенные продукты реакции (рисунок 187).
Методика постановки ИФА для определения антител. Исследуемый материал (сыворотка крови) вносят в лунки планшета, содержащие фиксированный антиген. Если в сыворотке присутствуют антитела к фиксированному на дне лунок антигену, после непродолжительной инкубации происходит их связывание. Затем лунки промывают буферным раствором, чтобы убрать несвязанные антитела, и добавляют конъюгат (антииммуноглобулины, меченные ферментом). При этом антииммуноглобулины связываются с искомыми иммуноглобулинами из исследуемой сыворотки (если таковые имелись, если нет – реакция дальше не протекает). Промывают лунки, чтобы убрать несвязанные антииммуноглобулины, и добавляют субстрат. После инкубирования учитывают результаты. Под действием фермента, конъюгированного на антииммуноглобулинах, происходит преобразование субстрата в цветной продукт, что сопровождается изменением окраски индикатора.
