шпоры_к_экзу_по_БХ1
.doc|
1)Предмет и задачи БХ: БХ изуч. химич состав живых организмов,вкл человека, и природы химич процессов происходящих как в целостном организме, так и в изолированных органах и тканях на клеточном, субклеточном и молекулярном уровнях. БХ,изучающая химич основы жизнедеятельности организмов в норме и при патологии, призвана установить связь между молекулярной структурой и биологич фу-ей химич компонентов живой материи. 4)Обмен в-в и Э., как важн. Признаки жив. материи. Питание, метаболизм. Состав пищи, компоненты: живые существа могут существовать только при пост обновлении их структур. Для синтеза нов структур нужны исходные материалы и энергия, это все получают из окр среды. Даже в сост покоя каждой клетке необходима Э. для обновления струтур,т е для выживания. Источник Э. у животных - распад органич в-в Питании - в N приход калорий соотв энергозатратам, поэтому нет необходимости ни в запасании, ни в использ имеющихся запасов, процентное поступл калорий в виде белков, липилов, у глеводов, соотносится как 15:35:50. Минорные компоненты пищи - биофлавоноиды, индолы, фитостеролы, изотиоционаты и др. Метаболизм - совокупность химических реакций и сопутствующих им химических процессов в организме, в результате которых происходит поступление веществ, их усвоение, использование в процессах жизнедеятельности и выделение ненужных соединений в окружающую среду. N: 100–120 г белка в сутки 100—150 г жира в сутки 430—630 г углеводов в сутки. 5) Незаменимые факторы питания,их значение: Среди факторов питания обычно различают два класса пищевых в-в — макронутриентов, кот вкл белки, жиры и углеводы и микронутриентов или класс минорных пищевых в-в, присутств в пище в мин концентрациях, миллиграммах и микрограммах. Макронутриенты присутств в пище в относительно больших кол-ах и явл основн источниками Э. и строительных компонентов. Микронутриенты выполн широкий круг важных регуляторн, метаболич и защитных ф-ий. К микронутриентам относ: - аминокислоты; - витамины; - макроэлементы; - микроэлементы; - полиненасыщенные жирные кислоты и фосфолипиды; - пищевые волокна; - различные органические растительные продукты. 6)Незаменимые аминокислоты. Потребность в них: Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме (человека). |
Поэтому их поступление в организм с пищей необходимо. Отсутствие или недостаток незаменимых аминок-т приводит к остановке роста, падению массы, нарушениям обмена в-в, при острой недостаточности - к гибели организма. Незамен аминок-ты: Аргинин содержится в твороге, морепрод, кур мясе, грецк орехах, печени, шоколаде. Валин в зерновых, мясе, грибах, молочных прод, арахисе, сое Гистидин в тунце, лососеговяжьем филе, куриных грудках, сое, арахисе, Изолейцин в миндале, кешью, кур мясе, яйцах, рыбе, чечевице, печени, Лейцин в мясе, рыбе, бур рисе, чечевице, орехах, в семянах. Лизин в рыбе, мясе, молочн прод, пшенице,орехах. Метионин в молоке, мясе, рыбе, яйцах, бобах, фасоли, чечевице и сое. Треонин в молочных продуктах и яйцах, в умеренных количествах в орехах и бобах. Триптофан в мясе, овсе, бананах, сушёных финиках, арахисе, кунжуте, кедровых орехах, молоке, йогурте, твороге, рыбе, курице, индейке. Фенилаланин в говядине, кур мясе, рыбе, бобах, яйцах, твороге, молоке. 7)Азотистый баланс- (белковый баланс): это соотнош между суточным приходом и суточным расходом белка (азота) -о приходе и расходе белка судят по приходу и расходу азота, для этого кол-во азота умножают на 6,25 (напр с мочой выделилось 12 г азота, суточный расход равен = 12*6,25=75 г) Возможны 3 варианта баланса - азотистое равновесие, отриц.(расход > приход – опухолевый рост) и положительный азот баланс(приход>расхода – рост, беременность, наращивание мыш массы). 8) Аминокислотный состав белков, пептидная связь, ее характ-ка: Белки-высокомолекулярные биологич полимеры,составленные из 21 разл мономера- альфа аминокислотных остатков, соединенных пептидной связью. Если аминокислотн цепь содержит менее 10-20 остатков аминокислот, ее наз- пептидом, если более –полипептидом. Полипептиды сост из 50 и более аминокислотных остатков, наз – белками. Общ форм. аминок-т:
Пептидные связи соедин аминогруппу одной аминок-ты с карбоксильной гр др аминок-ты. (т о - образование полимера). Пепт. сязи оч. прочные,для их разруш вне организма требуются выс температуры и давл, сильно кислая или сильно щелочная среда и длит время. В клетках ораганизма пепт |
связи разры-ся протеолитич ферментами.Вращение вокруг связи C-N треб больш затрат Э. и затруднено. Пепт цепь имеет одно направление и два разн конца – N-конец несет свободную аминогр первой аминок-ты (начало белк цепи) и C-конец несет карбокс гр последнего аминокисл остатка. 9)Уровни организации бел молекул. Структуры белка, их характ-ка: Б. представл собой сложные полипептиды,аминок-ты в кот связаны пептидн связми,образ-мися при взаимод Альфа-карбоксильных и Альфа-аминогрупп аминок-т.
К дипептиду могут присоедин др аминок-ты, образуя три-, тетра-, пентапептид и т д вплоть до образ крупн полипептида.Последоват-сть расположения аминок-т в полипептиде предстал собой первичную структуру белка. Всего сущ 4 уровня структурной организации белка- первичная, вторичн, тетичн, четвертичная структура. Структура большинства белков сост из 3 уровней. Первичная: Последовательность расположения аминокислотн остатков в полипептиде. Особенности: -первичн структура Б. генетически детерминирована и уникальна,замена аминок-т внутри полипетидной цепи привод к изменению структуры и фу-ии белка - она стабильна,это обеспеч-ся дипептидными и дисульфидными связями -число комбинаций аминок-т в полипептиде оч. велико,повторяющ-ся последоват-сти аминок-т редки. Идентичные последоват-стя аминок-т м встреч-ся в обл активных центров ферментов -она детерминирует торичную,третичную и четвертичную структуру белк молекулы. Вторичная: -конфигурация полипептидной цепи,более компактная ее упаковка в спиральную или какую-л др конформацию. Процесс конфигурации идет в соотв с программой,заложенной в первичн структуре Б. Сущ две осн конфигурации полипептидной цепи: Альфа-спираль и Бета-сладчатый слой. Третичная: -это пространственная ориентация полипептидной спирали, следующий за вторичн структурой способ компактизации белк. молекулы. Процесс укладки полипептидной цепи-фолдинг.Третичн струк Б формир-ся самопроизвольно и полностью детерминир-ся первичн структ Б.Основной движущий момент-взимод радикалов |
|
аминок-т с мол воды,сост в том,что гидрофобные радикалы аминок-т ориентир-ся внутрь мол Б, в то время как гидрофильные ридикалы ориентир-ся наружу. Четвертичная: -пространственная ориентация нескольких полипептидных цепей, облад. собственной первичной, вторичн или третичной структурой, с образ макромолекулярного образования. 10) Лабильность пространственной структуры Б. Факторы вызывающие денатурацию Белка. Лабильность-св-во белков незначительно изменять конформацию посредством разрыва одних и образ др слабых связей без потери биологич активности. Связи участв в формир трехмерной простаранств структуры и четвертичн структ олигомерных белков относ к числу слабых: Э. водородных, ионных и гидрофоьбных связей при комнатн тмпературе сопоставима с Э. теплового движения атомов.Тепл движ атомов,вход в состав Б,вызыв разрыв одних и образ др слабых связей,что привод к наруш биологич фу-ии Б.Конформация Б м незначит измен-ся в некотор диапазоне физич(температ,давл), химич (pH, концентр ионов) параметров, при взаимод с др молекулами. При экстремальн знач pH,выс температ или под действ денатурирующ факторо происх разрыв слаб сязей, наступ денатурация Б – изменение натиной конформации Б, сопровожд потерей его биологич активности. Разруш активн центр Б. измен-ся трехмерная структура Б,но первичн структура не разруш,пептидн связи не разрыв-ся. Факторы,вызыв Денатурацию: Выс температ –выше 60 градусов (разруш слабые сязи-стерилизация ); кислоты и щелочи; мочевина гуанидинхлорид; спирт и фенол разруш гидрофобные и водородные связи; соли тяж металлов образ нераствор соли Б и этих металлов. 11)Тип связей формир третичную и четвертичн структуру Б: Третичная структура: -гидрофобные взимодействия (слаб взаимод между неполярными радикалами, кот привод к тому,что гидрофобныерадикалы аминок-т оказываются внутри глобулярной структуры Б,образовав гидрофобное ядро) -ионные и водородные связи (между гидрофильными гр радикалов аминок-т,оказавшихся внутри гидрофобного ядра. Ионные и вобородные связи, а также гидрофобные взаимод относ-ся к числу слабых,их Э. не намного превышает Э тепл движ мол при комн температуре.) -ковалентные дисульфидные связи –S-S (между цистеиновыми остатками,наход в разных местах полипепт цепи).это инсулин и иммуноглобулины. |
Четвертичная структура: -это пространственное взаиморасположение полипептидных цепей (субединиц или протомеров), объединенных слабыми (гидрофобными,ионными, водородными) взаимодействиями.Б,сост из 2 и более субъединиц,наз олигомерами. Белк субъединица -протомер, может сост из одной,так и дух полипептидных цепей. 12) Четвертичная структура: -пространственная ориентация нескольких полипептидных цепей, облад. собственной первичной, вторичн или третичной структурой, с образ макромолекулярного образования. У олигомерных Б появл св-ва,отсутствующие у мономерных Б. Формирование четвертичн структуры ведет к усложнению фу-ии,появл возможность регуляции этих фу-ий. При взаимод одного из протомеров со специфич лигандом происх конформационные изменения всего олигомерного Б и меняется сродсто остальных протомеров к лигандам. Напр олигомерный белок гемоглобн,сост из 4 протомеров - родственен миоглобину, глбулярному Б,сост из 1 полипепт цепи. Вторичн и третичн структура этих Б имеетмного общего, несмотря на различия в первин структуре. Миоглобин и кажд субъединица гемоглобина содержит 8 Альфа-спиральных участков,образ глобулу и связанных с небелковой частью- геном, в центре кот наход железо Fe. Гидрофобные части генма окружены гидрофобнымирадикалами аминокислотн остатков,кроме Гис F8 и Гис E7,располаг-ся с двух сторон от плоскости гемма. Миоглобин депонир кислород в красных мыш волокнах и освобожд его при интенсивной мыш работе,после чего кислород использ для получ Э, необход мышцам. Ф-ии гемоглобина сложнее,главная- транспорт кислорода из легких в ткани, т е связывание кислорода в лугких и его диссоциация в капиллярах ткани. 13) Белки различаются по следующим физико-химическим св-вам: - молекулярная масса, которая зависит от кол-ва аминокислотных остатков в полипептидной цепи, а у олигомеров - и от числа протомеров, входящих в его состав; ее величина колеблется в пределах 6000 - 1000000 Д, но может быть и выше; -форма мол, кот м б глобулярной (компактной за счет того, что гидрофобные радикалы аминокислот сгруппированы в гидрофобное ядро) или фибриллярной. Форма белковой мол зависит от рН. В изоэлек-трич точке молекула наиболее компактна, а при изменении рН увеличивается; -суммарный заряд мол, зависящий от соотношения ионизированных анионных радикалов глутаминовой и |
аспарагиновой кислот и катионных радикалов лизина, аргинина и гистидина. Степень ионизации зависит от рН среды: - при рН=7 практически все ионогенные гр б ионизированы; - в кислой среде увеличение концентрации Н+ подавляет диссоциацию карбоксильных гр и уменьш отрицат заряд б: -СОО- + Н+ -СООН - в щелочной среде избыток ОН- приводит к уменьш полож заряда б: -NH3+ + ОН- -NH2 +H20 Величина рН среды, при кот суммарный заряд б равен нулю, наз изоэлектрич точкой. Б, облад кислотными св-ми (альбумины, глобулины, пепсины) имеют в составе больше анионогенных (—СООН) гр, их изоэлектрич точка лежит в слабокислой среде, а в нейтральной среде они имеют отрицат заряд. Б, обладающ основными св-ми (гистоны, протамины), имеют в составе больше катионо-генных гр, их изоэлектрич точка лежит в щелочной среде, в нейтральной среде они имеют полож заряд. -растворимость в водной среде, кот определ-ся гидрофильностью (способностью образовывать гидратную оболочку). На растворимость так же влияет форма мол и состав растворителя: больш-во б лучше раствор-ся в слабом солевом р-ре, чем в дистиллиров воде. Б, имеющ любой, отличный от нуля заряд, лучше раствор, чем белки, находящ в изоэлектрич точке. Легкость осаждения белков в изоэлектрич точке - результат исчезновения их электростатич отталкивания, что приводит к агрегации мол б и выпадению их в осадок.Б, поверхности кот обогащены гидрофобными радикалами, лучше раствор-ся в липидах, чем в воде. 14)Методы выделения индивид б: избирательное осаждение солями и органич. растворителями В дистиллир воде белки раствор-ся плохо. При незначит повыш концентр соли некот кол-во гидратированных неорганич ионов связыв-ся с поверхн-ю б, уменьшая его агрегацию.При выс концентрации соли мол б лишаются гидратных оболочек, агрегируют и выпад в осадок. Выделение индивидуальных б производят, использ различие в их растворимости при разной конц соли в р-ре и различн знач рН. После удаления соли б могут раствор-ся, сохраняя нативные св-ва. Осаждение б из р-ра (без их денатурации) м осуществл с помощью добавл дегидратирующих агентов - органич растворителей (этанол, ацетон). Современные методы фракционирования б:гель-фильтрация, электрофорез, ионообменная хроматография, аффинная хроматография на основе специфичн связывания лиганда,специфичн ости катализа.
|
|
. 15) Методы количественного измерения б. Измен-я белк состава органов. Изменения белк состава при онтогенезе и болезнях: Различия в белк составе органов- Складыв-ся на стадии дифференцировки кл многокл организмов. Каждый тип специализированных кл ха-ся определ набором б. Преобладающие белки-скелетных мышц - актин и миозин; в соединит, хрящ и костн тканях преоблад межклеточный матрикс, кот содержит коллагены (19 разл типов, в завис от ткани или органа, что составляет 25-33% от общего кол-ва б), а также адгезивные б и протеогликаны. Печень содержит множество специфич ферментов, обеспеч выполн её метаболич, депонирующих, барьерных, экскреторных и гомеостатич фу-й. Трансферрин - б перенос железо, содержится преимуществ в крови. Кровь также содержит б-переносчики гормонов, кот нет во внутр органах.
Изменения в синтезе белков в онтогенезе выражаются в резком сниж образования в связи с падением темпов роста организма, в различной ск накопления специфич б в период роста и на поздних этапах онтогенеза. Этим, и обусловлены возраст изменения в белкспектре органов и тк. В первой половине онтогенеза резко умен-ся возможность обновления организма за счет размнож и смены кл и ведущим стан обновление, обусловл распадом и послед ресинтезом отдельных б. Обновление тотальных б с возрастом в отдх орг меняется неодинаково. Его замедление частично м б вызвано более огранич использ некот б в метаболических проц, но преимущественно - увелич массы медленно обновляющихся бв. Наиб важной чертой, характ-щей сост анаболич проц белк обмена в онтогенезе, явл разная степень количеств изменений синтеза отд б. С возр происх изменение активности ферментов, поскольку происх измен-е их концентраций. Активность лактазы изменяется в завис от возраста: она макс к мом рождения, сниж к 3-5 годам, у взр она составл 10% от ур активности, характерной для. Лактазная недостаточность взр не явл проявл патологии, она отражает естественный проц инволюции активности фермента. Большое кол-во забол сопровожд воспалением. Воспаление представл собой защитно-приспособит реакц организма, направл на вывед патогена. Мех-мы воспалит проц универсальны, и закономерности развития явл общими, независ от структурно-функцональных различий тк. В период благоприятного завершения воспалительного процесса секретируются гормоны, препятствующие развитию воспаления (АКТГ,глюко)
|
. 16)Многообразие Белков: В любом жив организме содерж тысячи б, выполн разн ф-и. У члка более 50000 индивид б. Эволюция отобрала те варианты структур, кот способны поддерживать единств конфигурацию активного центра, а этовозможно только если нативное сост б хар-ся единств стабильной конформацией. Б различ первичн структурой, конформацией, кот полностью завис от аминокислотной последов-сти пептидной цепи, и ф-ми. Б имеет индивид форму (глобулярную, фибриллярную), массу, продолжит-ть жизни в кл; некот б м содержать небелковую часть. Глобулярным б свойственна сферич (глобулярная) форма, они отлич высокоупорядоченной конформацией и обычно несут в клетке динамические ф-ии., внутрь глобулы собраны гидрофобные радикалы, образующ гидрофобное ядро, а на поверхности экспонированы гидрофильные остатки, обеспеч хорошую раствор-ть глобулярных б. К глоб. б относ почти все ферменты, at, некот гормоны (инсулин) и транспортные б. Фибриллярные б хар-ся вытянутой нитевидной структурой, они устойчивы, нераствор в воде и разбавленных солевых р-ах. Эти б - основные структурные элементы соединит тк. По своему составу б раздел на : Простые белки содержат в своем составе только полипептидные цепи. При гидролизе они дают аминок-ы и не образ никаких др органич или неорганич прод (альбумины, глобулины облад кислым характером); протамины, гистоны (облад основным характером). Сложные белки (холопротеины) состоят из белковой части (апопротеина) и небелковой части (простетическая группа). Простетическая группа - ионы металлов или органич мол, присоедин-ся к б слабыми или ковалентными связями. Структура фибриллярных белков обладает особенным св-м - в формир-и их пространственной структуры участв, кроме слабых связей, ковалентные непептидные связи, тогда как в глобулярных белках основн вклад, стабилизирующий конформацию мол, вносят слабые взаимод. К фибриллярным бм относятся коллагены, альфа-кератин и эластин. Самыми распространенными белками организма являются коллагены - семейство родственных фибриллярных белков, секретируемых клетками соединительной ткани и образующих во внеклеточном матриксе полимеры - фибриллы коллагена. Строение коллагена имеет ряд особенностей. 1. Одну третью чь аминокислот состава представляет глицин одну десятую -пролин, а также гидроксипролин и гидроксилизин.
|
18) Белковые фракции крови общий белок – 64-85 г/л • альбумины – 35-50 г/л • α1 глобулины – 3,5-6,5% • α2 глобулины – 6,9-10,5% • β глобулины – 7,3-12,5% • γ глобулины – 12,8-19% Общий белок: Сильное понижение (Недостаточность функции печени) Альбумины: Пониж ур (Болезни печени и почек, м б Новообразования) Глобулины: Альфа-1-глобулины: Повыш ур (возможна Патология паренхимы печени, Острые воспалит проц, Опухоли) Альфа-2-глобулины: Повыш ур (возможны Забол, связ с вовлечением в патологич проц соединит ткани (коллагенозы, аутоиммунные заболевания, ревматические забол), возможен Цирроз печени) Бета-глобулины: Повышение уровня (возможна Механическая желтуха), Сниже ур (возможны Злокачеств новообразования) Гамма-глобулины: Повыш ур (Хронич активный гепатит, возможен Цирроз печени), Пониж ур (возможны Иммунодефицитные сост) 18)Молекулы ДНК особым образом закреплены в ядре, так что каждой молекуле (хромосоме) соответствует определенная хромосомная территория, участок внутри ядра. Иногда при повреждении клетки, например под действием радиации, хромосомы с двух сторон ядра двигаются навстречу друг другу и с помощью специальных белков сравниваются и исправляют повреждение. Это все мало изучено, известно только, что ДНК прикреплена. Мол ДНК имеют нитевидную форму. Длина мол ДНК в кл члка достигает нескольких см (от 2 до 6 см). ДНК каждой хромосомы представл собой единую гигантскую мол. 19)Нуклеиновые кислоты –сложн ысокомолекулярн соедин,обеспеч хранение,передачу наследств инфы и реализацию этой инфы.Их структурные компоненты выполн фу-ию кофакторов,аллостерич эффекторов,вход в состав коферментов, приним участие в обмене ве-в и Э.
β-рибоза β-дезоксирибоза (C5H10O5) (C5H10O4) Азотистые основания : пиримидиновые (цитозин,урацил,тимин) и пуриновые (аденин, гуанин) Структурными единицами нукл кислот явл нуклеотиды,сост из азотист основания,углевода(заним центр место) и фосфорной к-ты. |
|
Нуклеозиды- соединения, сост из остатка азотистого основания и углевода — рибозы (рибонуклеозиды) или дезоксирибозы (дезоксирибонуклеозиды):
ДНК — Дезоксирибонуклеиновая к-та. Сахар — дезоксирибоза, азотистые основания: пуриновые — гуанин (G), аденин (A), пиримидиновые — тимин (T) и цитозин (C). ДНК часто состоит из двух полинуклеотидных цепей, направленных антипараллельно 20) Вторичная структура ДНК образ-ся за счет взаимод нуклеотидов (в большей степени азотистых оснований) между собой, водородных связей. Классич пример вторичн структуры ДНК - двойная спираль ДНК – это сам распростр в природе форма ДНК, сост из двух полинуклеотидных цепей ДНК. Построение каждой новой цепи ДНК осуществл по принципу комплементарности, т.е. каждому азотистому основанию одной цепи ДНК соотв строго опред основание др цепи: в комплемнтарной паре напротив A стоит T, а напротив G располагается C и т.д. Вторичная структура матричных и рибосомных РНК. Относительно вторичной структуры тРНК наиб вероятной представл-ся модель, предложенная Р. Холли, плоское изображение в форме клеверного листа. Последовательность почти всех природных тРНК укладывается в эту схему «клеверного листа». При сравнении этих структур выявл ряд закономерностей, имеющих опред биол смысл. Принцип комплементарности используется в синтезе ДНК. Это строгое соответствие соединения азотистых оснований, соединёнными водородными связями, в котором: А-Т (Аденин соединяется с Тимином) Г-Ц (Гуанин соединяется с Цитозином) Денатурация ДНК происходит при нагревании раствора до 70-100 °С, а также в сильнокислой или щелочной средах, или в растворе мочевины. В результате разрушения водородных и гидрофобных связей цепи расходятся и принимают конфор-мацию беспорядочного клубка. Температура денатурации зависит от состава ДНК: чем больше в ДНК нуклеотидных пар ГЦ, тем выше температура денатурации. Денатурация данного образца ДНК происходит в довольно узком интервале температур, поэтому ее часто называют плавлением.
|
Денатурация сопровождается увеличением поглощения при 260 нм (т. н. гиперхромный эффект). Поглощение может увеличиться примерно в 1,5 раза. Это дает удобный метод наблюдения за ходом денатурации. Денатурацию можно обнаружить также по уменьшению вязкости раствора. Относительное поглощение — это отношение поглощения УФ-излучения раствором ДНК при комнатной температуре к поглощению при температурах, указанных на графике. Гибридизация ДНК, гибридизация нуклеиновых кислот - комбинирование комплементарных одноцепочечных нуклеиновых кислот в одну молекулу. При полной комплементарности объединение происходит легко, а в случае отличий слияние цепочек замедляется, что позволяет оценить степень комплементарности. Возможна гибридизация ДНК-ДНК и ДНК-РНК. 21) Реплика́ция ДНК — это проц синтеза дочерней мол дезоксирибонуклеиновой к-ты , кот происх в проц деления кл на матрице родительской мол ДНК. При этом генетич материал, зашифрованный в ДНК, удваивается и делится между дочерними кл. Структура двойной спирали позволяла представить простой механизм репликации ДНК: двойная спираль сначала раскручивается, цепи расходятся, а затем каждая одноцепочечная половина молекулы ДНК достраивается до целой, двухцепо-чечной молекулы: Последовательность нуклеотидов вновь синтезирующихся цепей определ правилом комплементарности оснований и последовательностью нуклеотидов имеющейся цепи. Иначе говоря, имеющиеся нуклеотидные цепи служат матрицей для синтеза новых цепей; в результате получаются две двухцепочечные молекулы ДНК, идентичные исходной молекуле. Такой способ репликации получил название полуконсервативного (в принципе возможен и другой механизм — консервативный, при котором вновь синтезируемая нуклеотидная цепь образуется прямо на двойной спирали ДНК, без ее раскручивания). Полуконсервативный механизм репликации ДНК нашел подтверждение в экспериментах с клетками кишечной палочки. Синтез новых полинуклеотидных цепей при репликации катализирует фермент ДНК-полимераза. 22)Адаптивная регуляция экспрессии генов у про- и эукариот. Теория оперона. Регуляция на ур транскрипции (образование первичного транскрипта) — наиболее распространенный механизм регуляции синтеза б. |
Этот проц иначе наз регуляцией действия генов или регуляцией экспрессии белков. Различают 2 формы регуляции: индукция синтеза (положительная регуляция) и репрессия синтеза (отрицательная регуляция). Понятия индукции и репрессии предполагают изменение ск синтеза по отнош к некот исходному, базальному ур. Синтез в базальном сост наз конститутивным синтезом. Если ск конститутивного синтеза некоторого б высока, то такой б обычно регул-ся по механизму репрессии синтеза, и наоборот — при низкой баз ск бывает индукция синтеза. При промежуточной базальной ск синтез б м регул-ся и путем индукции, и путем репрессии. Понятия «положит регуляция» и «отриц регуляция» относ к регуляции активности б — ингибированию или активации уже имеющегося б. Опероном наз отрезок ДНК, содерж структурные гены определенных белков и регуляторные участки. С участком оперона, называемым промотор, связ-ся РНК-полимераза. При ее движ по оперону происх транскрипция структурных генов.При этом получается одна мол мРНК, содерж матрицы для всех трех б. Послед трансляция этой мРНК ведет к образ указанных б. В результате транскрипции гена-регулятора образ мРНК, служащая матрицей для синтеза б-регулятора. Этот б м присоед-ся к оператору и блокировать транскрипцию структурных генов. Б-регулятор м соедин с лактозой, при этом утрачивается его сродство к оператору. 23) Св-ва генетич кода, трпплетность, специфичность, вырожденность, универсальность Однонаправленность и неперекрываемость, сигналы терминации. Отсутствие комплементарности между нуклеотидами мРНК и аминокислотами. Из 64 триплетов 61 использ для кодирования аминок-т. Каждый триплет кодирует только какую-л одну аминок-ту. Это св-во кода наз специфичностью или однозначностью. Одна аминок-та м кодироваться двумя или большим числом (до шести) разных триплетов, т. е. код вырожденный. Если ген код читается неперекрывающимися триплетами, возможны три способа трансляции нуклеиновой к-ты в б, в завис от стартовой точки, т.е. три рамки считывания. Последовательность нуклеотидов, записанная условно в направлении от 5'-конца к 3'-концу, соответствует аминокислотной последовательности, записанной в направлении от N-конца к C-концу. 24) Типы РНК: рибосомные, транспортные, матричные. Их структура и функция. Кажд кл содержит небольшое число мол ДНК, по одной гигантской молекуле на кажд хромосому.
|
|
Размеры молекул РНК гораздо меньше, от неск десятков до неск тысяч нуклеотидов. РНК отличаются большим разнообразием мол. Содержание РНК в кл в 5-10 раз больше, чем ДНК. По особенностям структуры и функций различают три основные типа РНК: 1. Рибосомные РНК (рРНК) — компоненты рибосом (см. ниже). На долю рРНК приходится около 80 % всей РНК кл. Имеется три вида рРНК 2. Транспортные РНК (тРНК) составляют около 15 % всей РНК кл. Имеется неск десятков видов тРНК, различающихся первичной структурой. Молекулярная масса тРНК около 25 000. 3. Матричные РНК (мРНК) составл 2 % всей РНК кл. Число мРНК, различающихся по первичной структуре, так же велико, как число разных б в организме. Матричные РНК иначе называют информац-ые РНК (иРНК). 25)Процессинг РНК - Комплекс процессов образования зрелых молекул РНК и белков в клетке; включает ряд последовательных расщеплений молекулы-предшественника эндонуклеазой или протеазами с образованием конечных, функционально активных продуктов 26) Адапторная функция тРНК .Взаимод кодонов мРНК с антикодонами тРНК. Биосинтез аминоацил-тРНК. Субстратная специфичность аминоацил-тРНК-синтетаз. Изоакцепторные тРНК.
Между аминок-ми и нуклеотидами (или триплетами нуклеотидов) невозможны специфические, комплементарные взаимодействия по типу образования нук-леотидных пар А«»Т (или A«»U) и G«»C. Поэтому было сделано предположение о существовании молекул-адапторов, каждая из которых может взаимодействовать с определенным кодоном — с одной стороны, и с определенной аминокислотой — с другой стороны. В 1957 г. такие молекулы обнаружены, ими оказались транспортные РНК (тРНК). Очевидно, что для адаптирования 20 разных аминокислот нужно не менее 20 разных тРНК: для каждой аминокислоты своя. Эти тРНК обо- значают следующим образом: тРНКala тРНКhis, тРНКval и т. д. (аланиновая тРНК, гистидиновая тРНК и т. д.). Однако, поскольку код вырожденный, число разных тРНК больше 20. 27) Строение рибосом: Рибосомы эукариот представляют собой субклеточные частицы, сост из двух субъединиц: большой и малой. Каждая из субъединиц содержит РНК и белки. Субъединицы распадаются на составные части в растворах с низким значением рН и в присутствии детергентов.
|
Нуклеиновые к-ты субъединиц выполняют, в частности, роль каркаса для объединения б в определенном порядке. Рибосома в целом функционирует как устройство для синтеза б. 28)Трансляция(биосинтез белков): Каким образом гены контролируют синтез белков? Можно представить два механизма: а) ген просто включает и выключает синтез б; б) ген содержит инструкцию о строении б. ДНК в клетках эукариот сосредоточена главным образом в ядре, а синтез б обнаруж-ся и в частях кл, не содержащих ДНК. Роль промежуточного переносчика инфы от ДНК к местам синтеза б выполняют рибонуклеиновые к-ты. Направление потока инфы в кл от генотипа к фенотипу представляют так: ДНК -> РНК -> белки. Иначе говоря, ДНК служит матрицей для синтеза РНК, а РНК — матрицей для синтеза белков. Это положение наз осн постулатом молекулярной биологии Важное значение для изучения механизмов трансляции имеет использ бесклеточных систем биосинтеза б. Если инкубировать гомогенаты тканей со смесью аминок-т, из кот хотя бы одна меченая, то по включению метки в б м регистрировать биосинтез б. Первичная структура синтезируемого б определяется первичной структурой мРНК, добавленной в систему. Если бесклеточная система составлена с глобиновой мРНК (ее можно выделить из ретикулоцитов), синтезируется глобин (альфа- и бета-цепи глобина); если с альбуминовой мРНК, выделяемой из гепатоцитов, синтезируется альбумин, и т. д. 29)Синтез б на рибосомах Сам механизм "сборки" белковой мол в рибосомах осуществляется следующим образом. В кажд рибосому, входящую в состав полирибосомы, т. е. движущуюся по и-РНК, из окр среды непрерывным потоком идут молекулы т-РНК с "навешанными" на них аминокислотами. Они проходят, задевая своим кодовым концом место контакта рибосомы с и-РНК, кот в данный момент находится в рибосоме. Противоположный конец т-РНК (несущий аминок-ту) оказывается при этом вблизи пункта "сборки" б. Однако только в том случае, если кодовый триплет т-РНК окажется комплементарным к триплету и-РНК, аминок-та, доставленная т-РНК, попадет в состав мол б и отделится от т-РНК. Дальше рибосома делает "шаг" вперед по и-РНК на один триплет, а свободная т-РНК выбрасывается из рибосомы в окружающую среду. Здесь она захватывает новую мол аминок-ты и несет ее в любую из работающих рибосом. Так , триплет за триплетом, движется по и-РНК рибосома и растет звено за звеном - полипептидная цепь. |
Так работает рибосома - этот органоид кл, кот с полным правом наз "молекулярным автоматом" синтеза б. 30) Посттрансляционный процессинг б, частичный протеолиз, присоединение небелк компонентов, модификация аминок-т, формир пространственной конформации мономерных и олигомерн мол. В результате трансляции не всегда сразу образуется функционально активный б. Во многих случаях необходимы дополнительные посттрансляционные изменения. Напр, мол инсулина построена из 2 пептидных цепей, соединенных между собой 2дисульфидными мостиками. В геноме члка содержится ген препроинсулина; в результ действия этого гена образуется препроинсулин — предшественник инсулина. Синтез препроинсулина происх на полирибосомах, связанных с эндоплазматическим ретикулумом. Препроинсулин проникв люмен ретикулума, где от него отщепл лидирующая последовательность — N-концевой фрагмент, содержащий 24 аминокислотных остатка. Образовавшийся проинсулин (86 остатков) перемещ в люмене к аппарату Гольджи, где упак-тся в секреторные гранулы.Сходным образом, т. е. путем частичного протеолиза, активируются многие б. Присоединение простетической гр с образ сложных б и объединение протомеров олигомерных белков также относ к посттрансляционным изменениям. Вторичная и третичн структуры б формир-ся в проц трансляции по мере удлинения пептидной цепи. Транскрипция и трансляция происх во все фазы клеточного цикла; лишь во вр митоза резко замедляется синтез многих б, но ускоряется синтез тех б, кот участвуют в проц митоза.
31) История открытия и изучения ферментов. Ферменты (энзимы, enzymes) - самый крупн и наиб специализированный класс белк молекул. Они представляют собой тот рабочий аппарат, при помощи кот реализуется генетическая информация кл. История биохимии - это в значительной степени история изучения ферментов. Первым обнаруженным ферментом, полученным в чистом кристаллическом виде, была уреаза - фермент, разрушающий мочевину. Особенности ферментативного катализа. Ферменты (биологич катализаторы) - мол, ускоряющие химич реакции во многие миллионы раз. В ходе реакции ферменты не расходуются и после реакции они остаются в неизмененном виде, хотя в ходе самой реакции их структура может претерпевать временные изменения. Ферменты, как и все катализаторы, сниж э активации катализируемой ими реакции. |
|
Ферменты, как и все катализаторы, сниж э активации катализируемой ими реакции и направляют медленно текущую реакцию по иному пути, характер-ся более низкой энергией переходного состояния. Ферменты обладают уникальным св-м - субстратной специфичностью. благодаря кот только один или несколько субстратов связ-ся в активном (преимущественно гидрофобном) центре фермента. При фермент-субстратном взаимодействии происходит: 1) сближение и необходимая ориентация субстратов или реагирующих групп одного субстрата 2) удаление гидратной обол субстрата(в итоге внутри активного центра создаются совсем др усл, чем в р-ре); 3) ослабляется разрываемая связь между атомами субстрата. 32) Изоферменты - ферменты, катализирующие одну и ту же реакцию и облад одинаковой субстратной специфичностью, но различающ каталитич активностью, усл активации, видом связи апофермента с коферментом, физико-химическими свойствами (мол массой, изоэлектрической точкой, электрофоретической подвижностью. Существование изоферментов чаще всего имеет генетич природу - они кодируются разными генами (как у а-амилазы), или сост из разных наборов субъединиц (например у лактатдегидрогеназы). 33) Классификация и номенклатура ферментов: ОКСИДОРЕДУКТАЗЫ - сложные белки, В качестве акцептора электронов используются коферменты НАД+, НАДФ+, ФАД, ФМН, гем, дигидробиоптерин, ионы металлов. ТРАНСФЕРАЗЫ - как сложные, так и простые белки, ГИДРОЛАЗЫ - большинство ферментов - простые белки, лишь немногие содержат ион металла. Подразделяются на подклассы в зависимости от расщепляемой связи. , ЛИАЗЫ -как простые, так и сложные белки; коферментами могут быть пи-ридоксальфосфат, ТДФ, . ИЗОМЕРАЗЫ - большая их часть является простыми белками, но есть и сложные , ЛИГ АЗЫ (СИНТЕТАЗЫ).- большинство этих ферментов простые белки но некот (образующие С—С связи) содержат биотин. Подклассы зависят от природы образующейся связи). 34) Специфичность действия ферментов. Для ферментов характерна высокая специфичность по отнош к катализируемой реакции (реакционная или каталитическая специфичность) и соответствующим субстратам (субстратная спе цифичность). Реакционная специфичность заключается в том, что фермент катализирует определенный тип каталитических превращений одного или нескольких |
субстратов по одному из возможных путей его превращения. Различают специфичность: -Абсолютную (Фермент имеет активный центр, кот комплементарен только 1субстрату. Аргиназа, катализ-щая расщепление аргинина на орнитин и мочевину, аспартаза, катализирующая реакцию), -групповую (относительную)- (Фермент способен катализировать однотипные реакции с небольшим кол-вом структурно схожих субстратов. -Стереоспецифичность (Фермент способен катализировать превращения только одного из двух стереоизомеров.), -Двойственную(Фермент взаимодействует с резко различающимися по структуре субстратами). Зависимость ск ферментативной реакции от величины рН обусловлена влиянием рН р-ра на ионизацию функциональных гр в активном центре фермента, поверхностных группировок фермента и функциональных гр субстрата. Отклонение рН от оптимального значения приводит к изменению конформации фермента и его активного центра, а также субстрата, в итоге наруш-ся взаимодействие субстрата и кофермента с активным центром фермента. При значительном отклонении от оптимального значения рН ферментативная активность утрачивается из-за денатурации фермента. 35) Завис-ть ск ферментативной реакции от концентр фермента и субстрата. При увелич концентр фермента (если конц субстрата значит превыш концентр фермента и не изменяется) ск реакции увелич линейно. Зависимость между ск реакции и конц фермента прямо пропорц V=k([S]). При пост концентр фермента ск реакции по мере увеличения конц субстрата увелич-ся гиперболически. Зависимость V=k(l/[S]), достигая предельной макс ск (кривая Михаэлиса). Константа Михаэлиса (Кm) численно равна той концентрации субстрата, при кот ск реакции составл половину макс. Величина Кm - харак-ка каталитич активности фермента,чем она меньше, тем выше активность ферм. Уравнение Михаэлиса-Ментен: V= Vmax [S]/ Km+[S] При низк концентрации субстрата [S] ск ферментат реакции V опред-ся частотой столкновений мол субстрата S и фермента Е. Уравнение Михаэлиса-Ментен: V= Vmax [S]/ Km+[S] При низк концентрации субстрата [S] скорость ферментативной реакции V определяется частотой столкновений мол субстрата S и фермента Е. При повыш [S] кол-во фермент-субстратных комплексов [ES] возрастает и увелич и ск реакции. |
При полн насыщении субстратом мол фермента увеличение конц субстрата [S] уже не вызыв увелич ск реакции. Графич такая кинетич зависимость описывается гиперболической кривой. Кинетич зависимость такого вида назт кинетикой Михаэлиса-Ментен, а все подчиняющиеся этой модели ферменты - ферментами Михаэлиса-Ментен. Кажд фермент характ-ся макс ск Vmax и константой Михаэлиса Кm. Это главные количеств хар-ки фермента. Для практич определения этих кинетич параметров всегда использ координаты Лайнуивера-Бэрка. Главн причина этого сост в том,что в прямых координатах никогда невозможно точно определить Vmax и Кm. 36) Ингибиторами ферментов, снижающ их каталитич активность, явл ионы или небольш мол, составл часть ферментативной регуляторной сист, а также фармакологич препараты. 1. Необратимое ингибирование - стойкое ингибирование фермента, возник в рез ковалентного связывания мол ингибитора с акт центром фермента либо с особым центром, кот изменяет конформацию фермента. Сопровожд разруш или модификацией 1или неск функц гр фермента. Преодолеть последствия ингибирования такого типа организм может, только синтезировав нов мол фермента. Пример необратимого ингибирования - действие ионов тяж металлов (Hg 2+), мышьяка (As 3+). Неспецифич необратимое ингибир-ие - действие алкилирующих агентов, необратимо реагир с активными - SH - гр остатков цистеина б, в т ч и ферментов. 2. Обратимое ингибирование. Большинство ингибиторов образуют нековалентные связи с ферментом, и при определ усл диссоциируют с восстановлением его активности. Сущ 2 вида обратим ингибирования: конкурентное мигрирование и неконкурентное (или бесконкурентное). Конкурент ингиб-ие - проц торможения ферментативной активности, вызванный присутств ингибитора, структурно схожего с субстратом. Бесконкурентное ингиб-ие отлич от конкурентного тем, что оно не м б ослаблено или устранено увеличением конц субстрата. 37) Энзимодиагностика: - определ активности ферментов в биологич жидкостях (плазме кр, моче, секретах пищеварит тракта) для постановки диагноза. Для диагн-ки в клинике исследуют ферменты второй группы. В N их активность в плазме незначит, но увелич при поврежд тк - источника ферментов, или при избыточной клеточной пролиферации (в период акт роста костей, особенно у детей и подростков, и при онкопролиферативных проц).
|
|
38) Кофакторы ферментов: ионы металлов и коферменты. Активность ряда ферментов (прост б) в N завис только от их структуры, тогда как для др, названных холоферментами (сложн б), требуются кофакторы – ве-ва небелк природы, в роли кот м б сложн органич соедин-я (коферменты) и ионы металлов. Кофактор м образовывать с апоферментом прочн ковалентные связи. В этом случае кофермент наз простетической гр фермента. Примерами могут служить ФАД, ФМН, биотин. Коферментные формы вит В6 включ в реакции, катализируемые почти всеми кл ферментов. Наиб значительная гр пиридоксалевых ферментов – аминотрансферазы. PP - предшественник коферментов -никотинамидадениндинуклеотида (НАД+) и никотинамидадениндинуклеотид-фосфата (НАДФ ), вход в сост дегидрогеназ и редуктаз. НАД+ и НАДФ+ приобр коферментные фу-ии после присоедин к никотинамиду радикала, включ остаток рибозы, пирофосфат и нуклеотид - аденин. Вит РР такими фу-ми не обладает. B2 Кофермент ФМН и ФАД 1. ФМН и ФАД - коферменты оксидаз,перенос электроны с окисляемого субстрата на О2. Это ферменты распада аминок-т (оксидазы D- и L-аминокислот), нуклеотидов (ксантиноксидаза),биогенных аминов (моно- и диа-минооксидазы). 2. ФАД - кофермент пируват- и альфа-кетоглутаратдегидрогеназных комплексов. 39) Витамины: Большинство вит вход в сост коферментов,и поэтому они необход организму. Вит А служит кофактором б неферментной природы — родопсина, или зрительного пурпура; этот б сетчатки глаза участвует в восприятии света. Вит D (точнее, его производное — кальцитриол) регулирует обмен Ca; по механизму действия он сходен с гормонами — регуляторами обмена и фу-ий организма. Вит Е (токоферол) выполн роль антиоксиданта. Вит делят на 2 гр: жирорастворимые — витамины A, D, Е, К и водорастворимые - все остальные. Водораств вит вкл аскорбиновую к-ту (вит С)и витамины гр В. Гиповитаминозы- сост, при кот снижена концентр вит в тк организма, При леч аб-ми, СА и др лекарствами, угнетающими кишечную флору, м возникать гиповитаминоз Гипервитаминозы - Избыточное потребл вит приводит к нар обмена и фу-й организма, кот связаны со специфич ролью вит в обмене ве-в, носят характер неспецифич отравления. Гипервит-ы возник редко, т к сущ мех-мы устранения избытка вит из тк, и лишь потребл больших кол-в вит м б опасным. Более токсичны жирораствор вит, особенно А и D. |
40) Вит - низкомолекулярные органич соединения различной хим природы, необход в незначит кол-вах для N обмена ве-в и жизнедеятельности живых организмов. Многие вит — предшественники коферментов, в составе кот участвуют в различных ферментативных реакциях. + см предыдущий вопрос 41) Витамин В1 (тиамин)
- хорошо раствор воде. Его водные р-ры в кислой среде выдерживают нагрев до выс t без сниж биологич активности. В нейтр и щелочн среде вит B1, быстро разруш при нагревании. (частичное или полное разруш B1 при кулинарной обработке пищи).Вит B1 легко всасывается в ки-ке, но не накапл-ся в тк и не облад токсич св-ми. Избыток выводится с мочой. Тиамин помогает организму эффективно использовать сахара и крахмал. При отсутствии или недостаточности развив тяж забол – бери-бери распростр в ряде стран Азии и Индокитая,где основнпродуктом пит явл рис. 42)Тиаминпирофосфат - это активн форма тиамина(или тиаминдифосфат)-образ-ся при участии специфич АТФ-зависимого фермента тиаминпирофосфокиназы(содерж в печени и тк мозга)
43)Витамин РР(Никотиновая к-та) -соединение пиридинового ряда, содерж карбоксильную гр (никотинамид отлич наличием амидной гр).
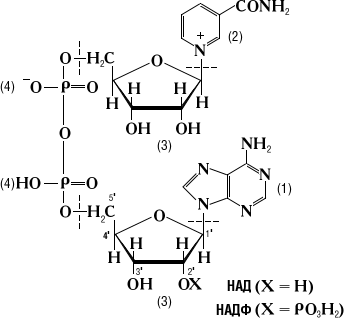
РР малорастворим в воде (примерно 1%), но хор растворим в водных р-рах щелочей. Вит кристаллизуется в виде белых игл. Наиб характерными признаками авитаминоза РР, т.е. пеллагры явл поражения кожи (дерматиты), пищеварит тракта (диарея) и нар нервн деятельности (деменция). Биологическая роль-РР вход в состав НАД или НАДФ, явл коферментами многих обратимо действ в окисл-восстановит. реакциях дегидрогеназ. 44)НАДФ и НАД: Никотинамидадениндинуклеотидфосфат (НАДФ)- участв в реакциях окисл — восстановл. Структура НАДФ служит акцептором водорода при окисл углеводов; в восстановленной форме явл донором водорода при биосинтезе жирных к-т. В хлоропластах растит кл НАДФ восстанавл-ся при световых реакциях фотосинтеза. |
НАД
(никотинамидадениндинуклеотид)-
кофермент, присутств во всех живых
кл; входит в состав ферментов гр
дегидрогеназ, катализирующих
окисл-восстановительные реакции.
Во
многих окисл-восстанов реакциях НАД
или НАДФ присоедин протон и 2 электрона,
переносимые от окисляемого субстрата
к окисленному коферменту; в обратной
реакции водород переносится от
восстановл кофермента к субстрату.
При этом водород отщепл-ся и присоед-ся
к атому углерода амида никотиновой
кислоты в 4-м положении:
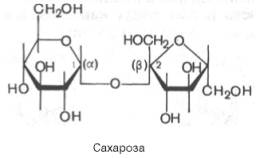
45)
Витамин
В2
(рибофлавин)- В
основе лежит гетероциклич
соединение
изоаллоксазин (сочет бензольного,
пиразинового и пиримидинового колец),
к кот в полож 9 присоединен пятиатомный
спирт
риби-тол. Рибофлавин
хор раствор в воде,
устойчив в кислых р-рах,но
легко разруш-ся в нейтр и щелочных
р-рах.
Он весьма чувствителен к видимому и
УФ-излучению и сравнит легко подвергается
обратимому восстан-ию,
присоединяя водород
по месту двойных
связей
и превращаясь в бесцветную лейкоформу.
Это свойство
рибофлавина
легко окисляться и восстанавливаться
лежит в основе его биологического
действия в клеточном метаболизме.
Клинич проявл недостаточности
рибофлавина
на эксперимент животных.Помимо
остановки роста, выпадения волос(алопеция),
характерных воспалит проц слизистой
оболочки языка (глоссит), губ, особенно
у углов рта, эпителия
кожи.
|
|
46) Во флавиновых коферментах (ФАД-флавинмононуклеотид или ФМН-флавинаденинуклеотид), активной частью мол кот явл изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюд присоедин 2 протонов и 2 электронов одновременно:
47)
Витамин
В6
(пиридоксин, антидерматитный)- самост
независ пищевой фактор.Термином вит
В6,
обознач все три производных
3-оксипиридина, облад-х одинаковой вит
активностью:
пиридоксин
(пиридоксол), пиридоксаль и пиридоксамин:
У члка недостаточность вит В6 встреч редко, хотя некот пеллагроподобные дерматиты, не поддающиеся леч никотиновой к-той,проходят при введении пиридоксина. Все три производных 3-оксипиридина наделены витаминными св-ми, коферментные ф-и выполн только фосфорилированные производные пиридоксаля и пи-ридоксамина. 48)
Пантотеновая кислота (вит В3)-
явл комплексным
соединением
β-аланина и 2,4-диокси-3,3-диметил масляной
к-ты.
Пантотеновая к-та представляет собой вязкую светло-желтую жидкость, хорошо раствор в воде; она малоустойчива и легко гидролизуется поместу пептидной связи под действием слабых кислот и щелочей. |
Биологическая роль. Пантотеновая к-та вход в состав кофер-мента А, или коэнзима А (КоА). Название «коэнзим А» (кофермент ацилирования) связано с тем,что это соед-ие участвует в ферментативных реакциях, катализирующих активирование и перенос ацетильного радикала СН3СО; что КоА активирует и перенос также др кислотные остатки (ацилы). ЛИПОЕВАЯ
КИСЛОТА-кофермент,
участв в каталитич. р-циях переноса
атомов
Н и ацильных гр; незаменимый фактор
роста (вит) для молочнокислых бакт,
кот его не синтезируют.
49)
БИОТИН
(вит Н)- один
из гр витВ; кофермент,
участв в карбоксилировании
орг. к-т. С ферментами
связан пептидной
связью,
образованной его карбоксильной грй
и аминогр остатка лизина
в мол
апофермента.
Витамин В12 (кобаламин антианемический вит)- В моле В12 центр атом кобальта соединен с атомами азота четырех восстановленных пиррольных колец, образ порфириноподобное корриновое ядро, и с атомом азота 5,6-диметил-бензимидазола . У члка и жив недостаток В12 приводит к развитию злокач макроцитарной, мегалобластической анемии. Помимо изменений кроветв ф-и, для авитаминоза В12 специфичны также нар деятельности НС. Биологическая роль. Выявлены ферментные системы, в составе кот в качестве простетической гр участвуют не свободный В12,а В12-коферменты, или кобамидные коферменты. Хим реакции, в кот В12 приним участие как кофермент, условно делят на 2 гр в соответствии с его хим природой. К 1 гре относ реакции трансметилирования, в кот метилкобаламин выполн роль промежуточного переносчика метильной гр (реакции синтеза метионина и ацетата). 50) (УТФ) уридинфосфорная кислота, молекула кот содержит 3 остатка фосфорной кислоты; участвует, напр., в биосинтезе рибонуклеиновой кислоты. Пути биосинтеза пиримидиновых нуклеотидов сложнее, чем пути синтеза пуриновых нуклеотидов. Прежде всего исходный УМФ фосфорилируется до ди-, затем трифосфата УТФ . УТФ превращается цитидинтрифосфат в (ЦТФ ). 51)Аскорбиновая к-таВитамин С (аскорбиновая к-та; антискорбутный витамин) получил название антискорбутного, антицинготного фактора, предохр от развития цинги. По хим структуре С представл собойлактон к-ты со структурой, близкой структуре |
L-глюкозы; оконч
строение вит
С
было установлено после синтеза его
из L-ксилозы.
Наиб характерным признаком недостаточности вит С явл потеря способности депонировать межкл «цементирующие» ве-ва, что вызыв пораж сосудистых стенок и опорных тк. Биологическая роль. Вит С участвует в окисл-восст проц, хотя до сих пор не выделены ферментные сист, в состав простетических гр кот он входит. 52) Фолиевая к-та (фолацин) –Витамин Вс. Фолиевая
к-та
сост из 3 структурных единиц: остатка
2-амино-4-окси-6-метилптеридина (I),
парааминобензойной (II) и L-глута-миновой
(III) к-т и имеет след структуру:
Фолиевая к-та ограниченно раствор в воде, но хор растворима в разбавл р-рах спирта; В организме фолиевая к-та восст-ся до тетрагидрофолиевой к-ы, явл коферментом, участвв разных метаболич проц. Она необходима для N образования кл крови, включ проц созрев мегалобластов и образов нормобластов. Недостаток фолиевой к-ты тормозит переход мегалобластической фазы кроветворения в нормобластическую. 53)
К
вита
гр К(жирораствор)
относ 2 типа хинонов
с боковыми цепями, представленными
изопреноидными звеньями (цепями): вит
К1
и К2
. В основе циклич структуры обоих вит
лежит кольцо 1,4-нафтохинона.
Биологич роль. Вит К приним участие в синтезе протромбина в печени, вероятно, через ферментную сист, необходим как стимулятор биосинтеза в печени мин 4 белков-ферментов, участв в слож проц свертывания крови. |
|
54)Токоферол
(Витамин Е)-жирораствор.- Активное
в-во,
предохр от бесплодия, было выделено
из масла пшеничных зародышей и
хлопкового
масла.
В наст вр известно
5 природных соединений, облад биологич
активностью
вит
Е.
55)Витамин А (ретинол, антиксерофтальмич вит)-жирораствор.- явл предшественником гр "ретиноидов", к кот принадл ретиналь и ретиноевая к-та. Ретинол образ при окислит расщепл провит β-каротина. Ретиноиды содержатся в животных продуктах(в печени животных), а β-каротин — в свеж фруктах и овощах (в моркови). Ретиналь обуславл окраску зрит пигмента родопсина.Ретиноевая к-та выполн ф-и ростового фактора. При недостатке вит А развив ночн ("куриная") слепота, ксерофтальмия (сух роговой оболочки глаз), наблюд наруш роста.
56) Вит
D (кальциферол; антирахитический вит)-
сущ в виде неск
соедин, различ-ся как по хим строению,
так и по биолог активности.
Для члка и животных активными препаратами
считаются вит
D2и
D3.
С хим точки зрения эргостерин(ол) представл собой одноатомный ненасыщ циклич спирт, в основе структуры кот лежит конденсированная кольцевая сист циклопентанпергидрофенантрена. Под действ УФ-лучей эргостерин ч/з ряд промежуточных продуктов (люмистерин, тахистерин) превращ в вит D2. Недостаток вит D в рационе детей привод к возникн шир известного забол–рахита, в основе кот лежат измен фосфорно-кальциевого |
обмена и нар отложения в костной тк фосфата Са. Поэтому основ симпт рахита обусловл нар N проц остеогенеза. Развивается остеомаляция – размягчение костей. Кости стан мягкими и под тяжестью тела приним О- или Х-образные формы. 57)Углеводы. (сахара) - обширная гр полигидроксикарбонильных соед., вход в состав всех живых организмов; Классификация - принято делить на моносахариды (углеводы, представл собой полигидроксиальдегиды (альдозы) и полигидроксикетоны (ке-тозы) общей ф-лы СnН2nОn (п = 3-9), в к-рых кажд атом С (кроме карбонильного) связан с группой ОН, и производные этих соед., содержащие разл. др. функц. группы, а также атом Н вместо одного или неск. гидроксилов.), олигосахариды (углеводы, мол кот построены из неск. моносахаридных остатков (от 2 до 10-20), соедин гликозидными связями (экзоциклич. связь ано-мерного атома С моносахарида с атомом О соседнего моносахаридного остатка). В соответствии со степенью полимеризации различают дисахариды (биозы), трисахари-ды (триозы), тетрасахариды (тетраозы)) и полисахариды((гликаны), полимерные углеводы, мол кот построены из моносахаридных остатков, соединенных гликозидными связями.). У члка и животных углеводы выполн важн ф-и: энергетич (главн вид клеточного топлива), структурную (обязат компонент большинства внутриклеточных структур) и защитную (участие углеводных компонентов иммуноглобулинов в поддержании иммунитета). С нар обмена углеводов тесно связан ряд забол: сах диабет, галактоземия, нар в сист депо гликогена, нетолерантность к молоку. в организме чла и животного углеводы присутс в меньшем кол-ве (не более 2% от сухой массы тела), чем белки и липиды; в растит организмах за счет целлюлозы на долю углеводов приходится до 80% от сухой массы, поэтому в целом в биосфере углеводов больше, чем всех др органич соединений вместе взятых. Моносахарид-глицериновый альдегид
Олигосахарид- мальтоза,лактоза Полисахарид- манноза,галактоза 58) По своему функц назначению гомополисахариды м б разделены на 2 гр: структурные и резервные полисахариды. Важным структурным гомополисахаридом явл целлюлоза, а главными резервными – гликоген и крахмал (у животных и растений соответственно). |
Крахмал, как отмечалось, является основным резервным материалом растительных организмов
Целлюлоза:
Гетерополисахариды: Важн представители в органах и ткх животных и члка – гликозаминогликаны (мукополисахариды). Они сост из цепей сложных углеводов, содержащих аминосахара и уроновые к-ты. гликозаминогликаны – основ компонент внеклеточного в-ва – желатинообразного вещества, заполн межклеточное пространство тканей. Они также содержатся в больших кол-вах в синовиальной жидкости – это вязкий материал, окруж суставы, кот служит смазкой и амортизатором. Гиалуроновая
кислота (Гиалуронат):
59) Биосинтез Мукополисахаридов. включает построение полимерных предшественников и их послед. модификацию путем эпимериза-ции остатков D-глюкуроновой к-ты в L-идуроновую, N-де-ацетилирования и послед. N-сульфатирования остатков N-ацетил-D-глюкозамина, а также сульфатирования гидро-ксильных групп. Этим объясняется образование "гибридных" структур, содержащих в одной молекуле дисахаридные звенья неск. типов (напр., хондроитинсульфата-дерматан-сульфата, гепарансульфата – гепарина. 60) Гликоген-депонированная форма глюкозы,высвобождает эту гексозу при участии гликогенфосфорилазы.Фермент катализирует фосфоролиз 1,4-гликозидной связи с высвобожд остатков глюкозы. Биосинтез и распад гликогена: Биосинтез осуществл с помощью ферментов гликозилтрансфераз. Исходным в-вом для синтеза м служить |
|
мол олигосахарида, сост из остатков глюкозы, или б, глюкозилированный в резе переноса на него остаткаглюкозы с уридиндифосфатглюкозы. Гликоген расщепл с помощьюфермента фосфорилазы, перенос остаток
глюкозы
на фосфорную к-ту с образ Синтез и распад гликогена в тканях, прежде всего в печени. В присутствии фосфорилазы гликоген распадается с образ фосфорного эфира глюкозы (глюкозо-1-фосфата) без предварительного расщепл на более крупные обломки мол полисахарида. Синтез гликогена:
61)Дисахариды-
При образ
гликозидной связи между аномерной
гидроксильной гр 1 моносахарида
и ОН-гр др моносахарида
получ дисахарид.
Поскольку синтез природных дисахаридов
с участием ферментов
строго стереоспецифичен, гликозидная
связь м находиться только в одной из
возможных конфигураций (α или β).
Дисахариды
– сложн сахара,
кажд мол
кот при гидролизе
распад на 2 мол
моносахаридов.
Дисахариды наряду с полисахаридами
явл одними из основных источников
углеводов
в пище члка и животных. По строению
дисахариды – это гликозиды,
в кот 2 мо
моносахаридов
соединены гликозидной связью.
|
Многие дисахариды — ценные пищевые продукты. Примен в микробиологии и медицине. 62)Наследственные нарушения обмена дисахаридов: Непереносимость дисахаридов — наследственная или приобрет недостаточность активности дисахаридаз, обусловливающая нар расщепл и всас дисахаридов; вызыв непереносимость лактозы, сахарозы и/или мальтозы; проявл расстройствами пищевар и питания в виде хронич ферментативной диспепсии. |
|






 Биологич роль-Рибофлавин
входит в состав флавиновых коферментов,
в частности ФМН и ФАД , являющ в свою
очередь простетическими гр ферментов
ряда других сложн б
– флавопротеинов.
Биологич роль-Рибофлавин
входит в состав флавиновых коферментов,
в частности ФМН и ФАД , являющ в свою
очередь простетическими гр ферментов
ряда других сложн б
– флавопротеинов. Восстановл формы
этих кофакторов способны транспортировать
водород
и электроны
к дых цепи митох
или иных энерго-сопрягающих мембран.
Восстановл формы
этих кофакторов способны транспортировать
водород
и электроны
к дых цепи митох
или иных энерго-сопрягающих мембран.






 Недостаточность вит
Е
вызыв нар эмбриогенеза
и дегенеративные изм репродукт органов-
стерильности.У
самок в большей степени поражается
плацента,
чем яичники;
проц оплодотворения яйца не нарушен,
но скоро плод
рассасывается.У самцов происх атрофия
половых желез,
привод к полной или частичной
стерильности.
Токоферолы
явл наиб активными и главн природн
жирораствор антиоксидантами:
разруш наиб реактивные формы кислорода
и соответственно предохр от окисления
полиненасыщенные жирные к-ты.
Недостаточность вит
Е
вызыв нар эмбриогенеза
и дегенеративные изм репродукт органов-
стерильности.У
самок в большей степени поражается
плацента,
чем яичники;
проц оплодотворения яйца не нарушен,
но скоро плод
рассасывается.У самцов происх атрофия
половых желез,
привод к полной или частичной
стерильности.
Токоферолы
явл наиб активными и главн природн
жирораствор антиоксидантами:
разруш наиб реактивные формы кислорода
и соответственно предохр от окисления
полиненасыщенные жирные к-ты.