
- •Введение в обмен веществ. Биологическое окисление.
- •Дыхательная цепь
- •Блок-схема дыхательной цепи
- •Переносчики электронов
- •Железо-серные белки (FeS) – негемовые белки, функционируют совместно с флавиновыми ферментами (1, 2, 3-й комплексы)
- •Механизм окислительного фосфорилирования
- •Строение дыхательной цепи и механизм окислительного фосфорилирования
Введение в обмен веществ. Биологическое окисление.
Общие представления об обмене: катаболизм и анаболизм.
Общие представления о биоэнергетике.
Представления о термодинамике биосистем.
Биологическое окисление.
Современные представления о тканевом дыхании.
Живые организмы находятся в постоянной и неразрывной связи с окружающей средой. Эта связь осуществляется в процессе обмена веществ. Обмен веществ включает 3 этапа:
- поступление веществ в организм,
- метаболизм,
- выделение конечных продуктов из организма.
Поступление веществ в организм происходит в результате дыхания (кислород) и питания. В ЖКТ продукты питания перевариваются (расщепляются до простых веществ). При переваривании происходит гидролиз полимеров (белков, полисахаридов и других сложных органических веществ) до мономеров, всасывающихся в кровь и включающихся в промежуточный обмен.
Промежуточный обмен (внутриклеточный метаболизм) включает 2 типа реакций: катаболизм и анаболизм.
Катаболизм - процесс расщепления органических молекул до конечных продуктов. Конечные продукты превращений органических веществ у животных и человека - СО2, Н2О и мочевина H2N-(CO)-NH2. В процессы катаболизма включаются метаболиты, образующиеся как при пищеварении, так и при распаде структурно-функциональных компонентов клеток.
Реакции катаболизма сопровождаются выделением энергии - экзергонические реакции.
Анаболизм - процессы биосинтеза, объединяет биосинтетические процессы, в которых простые строительные блоки соединяются в сложные макромолекулы, необходимые для организма.
В анаболических реакциях используется энергия, освобождающаяся при катаболизме - эндергонические реакции.
Общая схема обмена веществ и энергии. 1 - пищеварение; 2 - катаболизм; 3 - анаболизм; 4 - распад структурно-функциональных компонентов клеток; 5 - экзергонические реакции; 6,7 - эндергонические реакции; 8 - выведение из организма.

После всасывания аминокислот, жирных кислот и глицерола, нуклеотидов, транспорта и распределения их по всем клеткам организма начинаются специфические пути катаболизма.
Специфические пути катаболизма Жирные кислоты в процессе |3-окисления (в митохондриях) превращаются в ацетил-КоА. Глицерол через стадию глицеральдегида превращается в глицеральдегид-3-фосфат и поступает в гликолиз. Моносахариды, поступая в клетку, преобразуются в форму глюкозы, а затем вступают в гликолиз в цитозоле.
Аминокислоты, после удаления аминогруппы, превращаются в кето-кислоты. Первая реакция распада аминокислот это отделение аминогруппы. Часть аминокислот (1) затем превращается в пируват (они называются гликогенные), часть в молекулу ацетил-КоА (2) (они называются кетогенные) и промежуточные продукты цикла трикарбоновых кислот (3). Специфическими путями катаболизма называют внутриклеточное превращение жирных кислот, моносахаров и аминокислот в универсальные молекулы пирувата и ацетил-КоА.
Общий путь катаболизма. Начинается с пирувата CH3-(CO)-COOH, который превращается в молекулу ацетил-КоА CH3-(CO)~KoA под действием сложного мультифетментного пируватдегидрогеназного комплекса в митохондриях. Затем молекула ацетил-КоА подвергается полному окислению в цикле трикарбоновых кислот (цикл Кребса), где из неё извлекаются высокоэнергетические электроны. Эти электроны в составе молекул НАДН и ФАДН2 вовлекаются в дыхательную цепь (цепь переноса электронов), расположенную на внутренней мембране митохондрий. Энергия электронов расходуется на синтез АТФ – 40-40%, на транспорт веществ через мембраны – 25%, остальная энергия расходуется на тепло и на поддержание температуры тела.
Если организму необходимо, то часть энергии, которая идет на синтез АТФ, может пойти на тепло. Этот процесс называется разобщением дыхания и фосфорилирования. Этот процесс наблюдается при охлаждении тела, для поддержания температуры у новорожденных, у впадающих в зимнюю спячку животных. У последних существует особая ткань, специализирующаяся на теплопродукции - бурый жир. Эта ткань содержит большое число митохондрий, что влияет на его цвет.


Таким образом, обмен веществ тесно связан с обменом энергии.
Биоэнергетика — раздел биохимии, который изучает биохимические механизмы, приводящие к генерации различных форм биологической энергии. Каждое органическое соединение обладает определённым запасом внутренней энергии (Е). Часть этой внутренней энергии молекулы может быть использована для совершения полезной работы. Эту энергию называют свободной энергией (G) молекулы. Она представляет собой энергию валентных электронов, участвующих в образовании химических связей. Источники энергии для организма - это химические реакции, в которых молекулы, содержащие атомы углерода в восстановленном состоянии, подвергаются окислению. При этом специальные дыхательные переносчики (молекулы НАД+ и ФАД) присоединяют протоны и электроны (восстанавливаются) и в таком виде транспортируют атомы водорода к дыхательной цепи.
Реакции катаболизма, сопровождающиеся уменьшением свободной энергии (-ΔG), являются донорами не только структурных предшественников, но и обеспечивают энергетически процессы анаболизма (+ΔG).
Если ΔG – отрицательно, то реакция протекает самопроизвольно и сопровождается уменьшением свободной энергии (экзергонические реакции) – катаболические превращения.
Если ΔG – положительно, реакции протекают только при поступлении свободной энергии извне (эндергонические) – анаболические реакции.
Если ΔG = 0, то система находится в равновесии.
Внутриклеточные химические реакции могут быть представлены в виде:
катаболических (экзергонических) реакций;
анаболических (эндергонических) реакций.
Свободную энергию (G) при стандартных условиях обозначают как ΔG0'. Изменение стандартной свободной энергии (ΔG0') можно вычислить, зная константу равновесия (K'eq) химической реакции.
Соотношение между величинами К'eq и ΔG0' и направлением химических реакций:
|
K'eq |
ΔG0' |
Направление реакции при исходных концентрациях компонентов 1 М |
|
>1,0 |
Отрицательно |
Слева направо |
|
1,0 |
Равно нулю |
Состояние равновесия |
|
<1,0 |
Положительно |
Справа налево |

В биоэнергетике живых организмов имеют значение 2 основных момента:
- химическая энергия запасается путем образования АТФ, сопряженного с экзергоническими катаболическими реакциями окисления органических субстратов,
- химическая энергия утилизируется путем расщепления АТФ, сопряженного с эндергоническими реакциями анаболизма и другими процессами, требующими затраты энергии.

В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
Энергетика сопряжённых реакций на примере фосфорилирования глюкозы.
Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической:
(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).
Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы.
(2) АТФ → АДФ + Н3РО4 (ΔG = -30,5 кДж/моль).
При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой, фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима:
(3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль).
В живых организмах существует целая группа органических фосфатов, гидролиз которых приводит к освобождению большого количества свободной энергии. Такие соединения называют высокоэнергетическими фосфатами или макроэргическими соединениями.
Свободная энергия гидролиза некоторых органических фосфатов:
|
Соединение |
Продукты реакции |
- ΔG0' , ккал/моль |
- ΔG0', кДж/моль |
|
Фосфоенолпируват |
Пируват + Н3РО4 |
14,8 |
61,86 |
|
1 ,3-Бисфосфоглицерат |
3-фосфоглицерат + Н3РО4 |
13,0 |
54,34 |
|
Карбамоилфосфат |
Карбамат + Н3РО4 |
12,0 |
51,83 |
|
Креатинфосфат |
Креатин + Н3РО4 |
10,3 |
43,05 |
|
Ацетилфосфат |
Уксусная кислота + Н3РО4 |
10,3 |
43,05 |
|
АТФ |
АДФ + Н3РО4 |
7,3 |
30,51 |
|
АДФ |
АМФ + Н3РО4 |
6,6 |
27,59 |
|
Дифосфат(Н4Р2О7) |
2 Н3Р04 |
6,6 |
27,59 |
|
Глюкозо- 1 -фосфат |
Глюкоза + Н3РО4 |
5,0 |
20,90 |
|
Фруктозо-6-фосфат |
Фруктоза + Н3РО4 |
3,8 |
15,88 |
|
Глюкозо-6-фосфат |
Глюкоза + Н3РО4 |
3,3 |
13,79 |
|
Глицеролфосфат |
Глицерин + Н3РО4 |
2,2 |
8,36 |
Соединения, расположенные ниже АТФ, составляют группу низкоэнергетических фосфатов. Центральное место среди соединений занимает АТФ. В молекуле АТФ две высокоэнергетические (макроэргические) связи β и γ, они обозначены на рисунке знаком ~ (тильда).

АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч.
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений. Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах, а АТФ - универсальная "энергетическая валюта":


Некоторые анаболические реакции осуществляются с участием других нуклео-зидтрифосфатов. К ним относятся
гуанозинтрифосфат (ГТФ) - участвует в рибосомальном синтезе белка, уридинтрифосфат (УТФ) - участвует в синтезе гликогена,
цитидинтрифосфат (ЦТФ) - участвует в синтезе мембранных липидов.
Окислительно-восстановительные реакции. Окислительно-восстановительный потенциал.
Под окислением понимают отщепление электронов, а под восстановлением - присоединение электронов. Окисление донора электронов всегда сопровождается восстановлением акцептора электронов. Этот принцип окислительно-восстановительных процессов применим и к биохимическим системам. В любой окислительно-восстановительной реакции участвует акцептор электронов (окислитель) и донор электронов (восстановитель). Например:
(1) Сu + О → Сu2+О2-.
Суммарную реакцию (1) можно условно разделить на 2 полуреакции (2), (3):
(2) Сu - 2е → Сu2+. (3) О + 2е → О2-.
В каждой из них участвует окисленная и восстановленная форма одного соединения; их называют сопряжённой парой, или редокспарой.
Разные редокс-пары обладают различным сродством к электрону. Т.е., у которых это сродство меньше, отдают электрон тем, у кого оно больше. Мерой сродства редокспары к электрону служит окислительно-восстановительный потенциал, или редокс-потенциал (Е0'), величина которого непосредственно связана с изменением свободной энергии. Величину Еº' выражают в вольтах; чем она меньше (отрицательнее), тем меньше сродство вещества к электронам. Чем больше сродство к электрону, тем больше восстановительный потенциал.
Редокс-потенциалы Е0' связаны с изменением свободной энергии уравнением Нернста:
ΔG0´ = - nFΔEº´
где n - число перенесённых в реакции электронов; F - постоянная Фарадея (23 061 ккал B-1 моль-1); ΔЕо' - разность редокс-потенциалов электрондонорной и электронакцепторной пар.
Величина ΔЕо' - стандартная величина окислительно-восстановительного потенциала; её определяют в стандартных условиях, когда концентрации всех веществ равны 1 М, давление газов составляет 1 атм, а рН 7,0
Стандартные окислительно-восстановительные потенциалы некоторых сопряжённых пар:
|
Окислительно-восстановительная пара |
E0',V |
|
2Н+/Н2 |
-0,42 |
|
NAD+/NADH |
-0,32 |
|
NADP+/NADPH |
-0,32 |
|
NADH-дегидрогеназа (FMN-форма) |
-0,30 |
|
NАDН-дегидрогеназа(FМNН2-форма) |
|
|
FАD-белок/FАDН2-белок |
-0,05 |
|
Сукцинат/фумарат |
+0,03 |
|
Убихинон/убихинол |
+0,04 |
|
цит. b Fе3+/цит. b Fe2+ |
+0,07 |
|
цит. c1 Fе3+/цит. c1 Fe2+ |
+0,23 |
|
цит. с Fе3+/цит. с Fе2+ |
+0,25 |
|
цит. а Fе3+/цит. а Fе2+ |
+0,29 |
|
цит. a3 Fе3+/цит. а3 Fе2+ |
+0,55 |
|
½ O2 + 2Н++2е/Н20 |
+0,82 |
Биологическое окисление.
В зависимости от вида использования энергии все организмы делятся на фототрофы (используют солнечную энергию непосредственно, это растения) и хемотрофы (используют энергию химических веществ, т.е. пищевых продуктов - это человек, животные и некоторые бактерии). Пища - это законсервированная солнечная энергия. Доступная энергия химических веществ - это энергия электронов. Распад пищевых веществ используется на 2 главных направления:
а) энергия,
б) на получение новых молекул для обмена веществ.
Эта двойственность называется амфиболичность.
Биологическое окисление - это совокупность реакций окисления органических веществ (субстратов), выполняющих функцию энергетического обеспечения потребностей организма,
- это распад молекул уже внутри клетки.
Биологическое окисление протекает в митохондриях, микросомах и пероксисомах – аэробно, и в цитоплазме – анаэробно.
Окисление идет 2 путями:
Дегидрирование - отщепление от субстрата атомов водорода:
Н-S-H -2H ------ S (где S - субстрат)
Присоединение к веществу кислорода (одного атома или двух):
S + O ------SO SO2 (где S - субстрат)
Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием,
Углеводы, жирные кислоты и большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до СО2 и Н2О, но прежде, их углеродный скелет превращается в двухуглеродный фрагмент ацетил-КоА. Главным источником ацетил-КоА служит пировиноградная кислота, образующаяся в реакциях катаболизма глюкозы и некоторых аминокислот.
Окислительное декарбоксилирование пирувата
Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Транспорт пирувата в митохондриальный матрикс через внутреннюю мембрану митохондрий осуществляется при участии специального белка-переносчика по механизму симпорта с Н+:

Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением. Реакция необратима, поскольку ΔG0' = -33,5 кДж/моль.
СН3-СО-СООН + NAD+ + HSKoA → CH3-CO ∼SKoA + NADH + H+ + CO2
Строение пируватдегидрогеназного комплекса
Процесс окислительного декарбоксилирования пирувата катализирует сложноорганизованный пируватдегидрогеназный комплекс, состоящий из 3 ферментов:
- пируватдекарбоксилаза (Е1),
- дигидролипоилтрансацетилаза (Е2),
- дигидролипоилдегидрогеназа (Е3),
а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота, FAD, NAD+ и КоА. Кроме того, в состав комплекса входят регуляторные субъединицы: протеинкиназа и фосфопротеинфосфатаза.
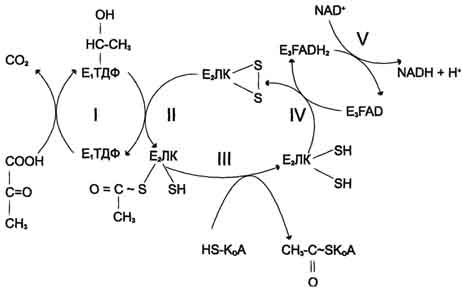
Последовательность реакций, катализируемых ПДК, включает 5 стадий:
I - Е1 катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ;
II - Е2 катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на липоевую кислоту (ЛК);
III - ацетилированная дигидролипоилтрансацетилаза взаимодействует с КоА с образованием восстановленной формы липоевой кислоты и ацетил-КоА;
IV - окисленная форма трансацетилазы Е2 регенерируется при участии E3;
V - окисленная форма Е3 регенерируется при участии NAD+.
Пируватдегидрогеназный комплекс (ПДК) млекопитающих
|
Фермент |
|
Число мономеров |
Кофермент |
Витамин |
|
1. Пируватдекарбоксилаза (пируватдегидрогеназа) |
E1 |
120 (30 тетрамеров) |
ТДФ |
B1 |
|
2. Дигидролипоилтрансацетилаза |
Е2 |
180(60тримеров) |
Липоамид |
Липоевая кислота (ЛК) |
|
KoA |
Пантотеновая кислота | |||
|
3. Дигидролипоилдегидрогеназа |
Е3 |
12 (6 димеров) |
FAD NAD+ |
В2 РР |
В центре комплекса располагается дигидролипоилтрансацетилаза (Е2), образуя его ядро. К дигидролипоилтрансацетилазе присоединены молекулы: пируватдекарбоксилазы (Е1) и дигидролипоилдегидрогеназы (Е3).

Пируватдекарбоксилаза содержит прочно связанный с белковой частью ТДФ, а дигидролипоилдегидрогеназа - FAD.
Липоиллизиновые группы центрального фермента (Е2) функционируют как поворотные "кронштейны", переносящие атомы водорода и ацетильные группы от одной ферментной молекулы комплекса к другой.
Окислительное декарбоксилирование пирувата
Превращение пирувата в ацетил-КоА
Стадия I. Реакция декарбоксилирования пирувата.
Значение декарбоксилирования пирувата в отношении извлечения энергии из молекулы исключительно велико. Три углеродных атома пирувата имеют разную степень окисления. Углерод метильной группы (-СНз) не окислен и, следовательно, в дальнейшем при его окислении можно получить полезную энергию. Углерод кето-группы (>С=О) окислен частично. При его дальнейшем окислении можно также извлечь некоторое количество дополнительной энергии. А углерод карбоксильной группы окислен почти полностью. Поэтому карбоксильная группа - это до некоторой степени балластная часть молекулы с позиции извлечения энергии. Её необходимо удалить. Удаление карбоксильной группы (т.е. реакцию декарбоксилирования) катализирует фермент пируватдегидрогеназа, в активном центре которого локализован тиаминдифосфат - кофермент декарбоксилирования.
Пируват + Е1-ТДФ → Гидроксиэтил-ТДФ + CO2.


Тиаминдифосфат (ТДФ) и гидроксиэтил-ТДФ. Рабочей частью ТДФ служит тиазоповое кольцо, к которому присоединяется продукт декарбоксилирования пирувата - гидроксиэтил. В активном центре фермента происходит прямое взаимодействие двух атомов углерода с образованием между ними ковалентной связи. Это взаимодействие обусловлено частичными разноименными зарядами, которыми обладают углерод кето-группы пирувата с одной стороны и атом углерода тиазолового кольца тиаминпирофосфата с другой.
На этой стадии E1 (пируватдегидрогеназа) переносит атом водорода и двухуг- леролеродный ацетильный фрагмент (СН3-СО-) на молекулу липоевой кислоты, локализованную в активном центре фермента Е2 (дигидролипоамидацетилтранс- феразы). При этом в активном центре фермента образуется ацетилтиоэфир липое вой кислоты.
В этой реакции KoA-SH атакует тиоэфирную связь в активном центре фермента Е2, разрывает её и присоединяет к себе двухуглеролеродный ацетильный фрагмент (СНз-СО-). Происходит образование ацетил~КоА, который покидает активный центр фермента Е2 (дигидролипоамидацетилтрансферазы). При этом оба атома серы липоевой кислоты полностью восстановлены.
В этой реакции фермент Е3 (дигидролипоамиддегидрогеназа) катализирует
перенос двух атомов водорода с восстановленной липоевой кислоты, находящейся в активном центре фермента Е2 на кофермент ФАД, локализованный в своём актив ном центре. При этом в активном центре фермента Е3 образуется ФАДН2.
В активный центр дегидрогеназы (Е3) пируватдегидрогеназного комплекса входит НАД+ и присоединяет к себе 2 электрона и протон от кофермента ФАДН2 и в форме НАДН переносит их в процесс окислительного фосфорилирования.
Связь окислительного декарбоксилирования пирувата с процессом окислительного фосфорилирования
При превращении пирувата в ацетил-КоА происходит образование НАДН, транспортирующего электроны в дыхательную цепь. Из пары высокоэнергетических электронов в процессе окислительного фосфорилирования может синтезироваться до 3 молекул АТФ. Усиление распада АТФ в клетке ведет к повышению концентрации АДФ и ускорению окисления НАДН в дыхательной цепи. Повышение концентрации НАД+, в свою очередь, стимулирует окислительное декарбоксили-рование пирувата. Напротив, повышение концентрации АТФ и НАДН снижает скорость этого процесса.
Таким образом, изменения отношений АДФ/АТФ и НАДН/НАД+ - важнейшие внутриклеточные регуляторные сигналы, отражающие энергетические потребности клетки и регулирующие скорость окислительного декарбоксилирования пирувата. Каталитическая активность пируватдегидрогеназного комплекса снижается, когда в клетках имеется достаточно "топлива" в виде жирных кислот и аце-тил~КоА.
Структурное объединение 3 видов ферментов создаёт возможности для координации отдельных этапов сложной ферментативной реакции. Все промежуточные продукты реакции окислительного декарбоксилирования пирувата прочно связаны с комплексом, что увеличивает суммарную скорость процесса и сводит к минимуму побочные реакции.
Пируватдегидрогеназный комплекс, как и все белки, участвующие в реакциях ЦТК, кодируется ядерной ДНК. Транспорт субъединиц ПДК в митохондрии происходит сложным путём за счёт энергии АТФ или трансмембранного электрохимического потенциала при участии белков теплового шока (или шапперонов), предотвращающих их преждевременный фолдинг до поступления в митохондриальный матрикс или внутреннюю мембрану митохондрий.
.
Регуляция пируватдегидрогеназного комплекса
Регуляция пируватдегидрогеназного комплекса (ПДК) имеет важное значение для обеспечения цикла трикарбоновых кислот "топливными" молекулами ацетил-КоА. Точная регуляция этого комплекса имеет важное значение в связи с невозможностью обратного преобразования ацетил-КоА в пируват, т.к. ферменты, необходимые для этого в организме человека отсутствуют.
Активность ПДК регулируется различными способами:
- доступностью субстратов,
- ингибированием продуктами реакции,
- аллостерическим путём,
- путём ковалентной модификации.
|
|
|
|
Регуляция
активности пируватдегидрогеназного
комплекса (ПДК)

Активность пируватдегидрогеназного комплекса увеличивается при повышении концентрации АДФ, внутриклеточного кальция, под влиянием гормонов: инсулина и адреналина.
При повышении концентрации АДФ ПДК находится в нефосфорилированной активной форме. Этот эффект усиливается при повышении концентрации внутриклеточного кальция, который активирует фосфатазу ПДК. Такой механизм активации ПДК особенно важен в мышцах и жировой ткани. Активация ПДК происходит также под влиянием инсулина. Один из эффектов инсулина - повышение концентрации внутримитохондриального кальция, это приводит к активированию ПДК. В клетках миокарда ПДК активируется адреналином.
Фермент фосфатаза, активируясь ионами кальция или инсулином, отщепляет фосфат и активирует пируватдегидрогеназу:

Таким образом, работа пируватдегидрогеназы подавляется при избытке в митохондрии (в клетке) АТФ и НАДН, что позволяет снизить окисление пирувата и, следовательно, глюкозы, в случае когда энергии достаточно.
Если АТФ мало или имеется влияние инсулина, то образуется ацетил-SКоА. Последний в зависимости от условий будет направляться либо в цикл трикарбоновых кислот с образованием энергии АТФ, либо на синтез холестерина и жирных кислот.
Сущность образования восстановленных НАДН и ФАДН2
Молекулы НАДН и ФАДН2, образуемые в реакциях окисления углеводов, жирных кислот, спиртов и аминокислот, далее поступают в митохондрии, где ферментами дыхательной цепи осуществляется процесс окислительного фосфорилирования.
Окислительное фосфорилирование
Окислительное фосфорилирование – это многоэтапный процесс, происходящий во внутренней мембране митохондрий и заключающийся в окислении восстановленных эквивалентов (НАДН и ФАДН2) ферментами дыхательной цепи и сопровождающийся синтезом АТФ.
Впервые механизм окислительного фосфорилирования был предложен Питером Митчеллом (хемиосмотическая теория): перенос электронов, происходящий на внутренней митохондриальной мембране, вызывает выкачивание ионов Н+ из матрикса митохондрий в межмембранное пространство, что создает градиент концентрации ионов Н+. Н+ в норме способны возвращаться в матрикс митохондрий только одним способом – через специальный фермент, образующий АТФ – АТФ-синтазу.
Внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты называют дыхательными ферментами, а последовательность их расположения в мембране – дыхательной цепью.
Принцип работы дыхательной цепи
В целом работа дыхательной цепи заключается в следующем:
Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи.
Электроны движутся по ферментам дыхательной цепи и теряют энергию.
Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу.
При этом они теряют энергию, которая используется для синтеза АТФ.

Общий принцип окислительного фосфорилирования
Восстановленные формы НАД и ФАД окисляются ферментами дыхательной цепи, благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование. Поэтому весь процесс целиком получил название окислительное фосфорилирование.
