
- •Влияние температуры на скорость химической реакции.
- •(Интегральная форма уравнения Аррениуса)
- •Катализ. Общие сведения.
- •Гомогенный катализ
- •Ферментативный катализ
- •1 Молекула фермента каталазы при 00с в 1 мин обеспечивает разложения молекул н2о2 (на определенной стадии метаболизма н2о2 образуется в живых клетках и губительно влияет на них)
(Интегральная форма уравнения Аррениуса)
Для одностадийных реакций предэкспоненциальный множитель имеет простой физический смысл – отражает вероятность взаимодействия молекул, обладающих необходимой энергией
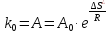
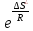 имеет вероятностную, т.е. энтропийную
природу, связанную с пространственными
факторами взаимодействия и элементами
симметрии;
имеет вероятностную, т.е. энтропийную
природу, связанную с пространственными
факторами взаимодействия и элементами
симметрии;
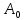 - для мономолекулярных газовых реакций
это частота колебаний разрываемой связи
вдоль пути реакции (для бимолекулярных
реакций – частота межмолекулярных
столкновений).
- для мономолекулярных газовых реакций
это частота колебаний разрываемой связи
вдоль пути реакции (для бимолекулярных
реакций – частота межмолекулярных
столкновений).
В соответствии с уравнением Аррениуса:
-
чем меньше
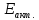 ,
тем больше k
и скорость химической реакции.
,
тем больше k
и скорость химической реакции. -
Чем выше
 ,
тем сильнее k
и W
зависят от температуры.
,
тем сильнее k
и W
зависят от температуры.
Значения
 Находят на основании зависимости k
реакции от температуры. Строят
график в координатах:
Находят на основании зависимости k
реакции от температуры. Строят
график в координатах:
 ̶
̶
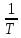 (координаты Аррениуса)
(координаты Аррениуса)
График!!!
 Тангенс
угла наклона
Тангенс
угла наклона
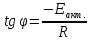

Предэкспоненциальный множитель рассчитывают по соотношению:
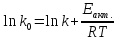
или

Если
допустить независимость
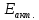 от
Т,
то можно рассчитать
от
Т,
то можно рассчитать
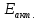 по
известным константам скорости при двух
разных температурах:
по
известным константам скорости при двух
разных температурах:
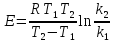

В ряде случаев, особенно для сложных реакций энергия активации (эффективная, отражающая суммарный эффект отдельных стадий) зависит от температуры, поэтому ее определяют, исходя из дифференциальной формы уравнения Аррениуса

или
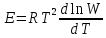
Строят
график в координатах
 ̶
̶
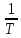 и
и
 находят
при данной температуре по тангенсу
угла наклона касательной к кривой
находят
при данной температуре по тангенсу
угла наклона касательной к кривой
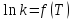 в точке, соответствующей выбранной
температуре.
в точке, соответствующей выбранной
температуре.
Обоснование
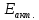 дает
теория активных столкновений.
дает
теория активных столкновений.
Теория активных столкновений
Основной задачей теории химической кинетики является создание такой системы теоретических представлений и уравнений, которая исходя из молекулярных параметров реагирующих веществ и внешних условий протекания процесса (концентрация, температура) позволяет вычислить его скорость (т.е. константу скорости).
 молекулярные
параметры, внешние условия
молекулярные
параметры, внешние условия

Одной из таких теорий является теория активных столкновений – для бимолекулярных реакций. Эта теория объясняет влияние температуры на скорость химических реакций, что такое энергия активации.
В чем смысл этой теории?
Основные постулаты теории активных столкновений (предложенные С. Аррениусом):
-
Химическая реакция протекает в результате столкновения молекул друг с другом;
-
Столкновения могут привести к химическому превращению в том случае, если энергия столкновения молекул превышает некоторую предельную величину
 ,
столкновения, удовлетворяющие этому
условию, называют активными; если
,
столкновения, удовлетворяющие этому
условию, называют активными; если
 ,
то имеет место упругий удар, упругое
столкновение без химического превращения;
,
то имеет место упругий удар, упругое
столкновение без химического превращения; -
Реакция происходит, если соударения, отвечающие этим же условиям
 сопровождаются
благоприятным расположением молекул.
сопровождаются
благоприятным расположением молекул.
Что это значит? В молекулах имеются активные участки, только при столкновении этими участками, реакция происходит. Поясним это на рисунке, где показаны некоторые возможные положения 2-х молекул в момент столкновения.
Рисунок
Благоприятное столкновение, реакция идет
Рисунок
Неблагоприятное столкновение, реакция не идет
Отношение числа положений, благоприятствующих
химической реакции, к общему числу
возможных положений молекул в момент
столкновения, называется стерическим
фактором В, согласно расчетам величины
стерического фактора
 (м.б.
(м.б. )
)
-
Для расчетов используется статистика Больцмана.
Что из этих положений (постулатов) следует? Как их можно использовать? Мы можем с помощью молекулярно-кинетической теории рассчитать число столкновений с определенной энергией.
Рассмотрим бимолекулярные реакции,
протекающие в газовой фазе
 .
Для простоты возьмем, что давление
газа=1 (в каких единицах не обозначаем).
Обозначим число активных столкновений
.
Для простоты возьмем, что давление
газа=1 (в каких единицах не обозначаем).
Обозначим число активных столкновений
 .
Общее число столкновений
.
Общее число столкновений

Доля эффективных столкновений (с
благоприятным расположением молекул)
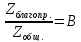
В- стерический фактор.
Для бимолекулярных реакций в газовой фазе
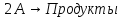



Если
 ,
то
,
то
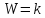
Давайте искать k.
Если в
единицу времени число активных
столкновений
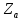 , то
, то

Найдем
число активных столкновений
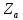 .
.
Просуммируем все столкновения, у которых энергия
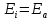 , а верхний предел может быть очень
большой. Применим термин «условное
ограничение», например
, а верхний предел может быть очень
большой. Применим термин «условное
ограничение», например
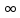 , прием используется в математике, это
не значит, что
, прием используется в математике, это
не значит, что
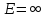 ,
,
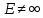 ,
а просто обозначения.
,
а просто обозначения.
Общее число столкновений в единице объема в газовой среде определяется
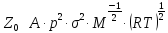
А – числовой
коэффициент,
 – давление,
– давление,
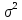 -
размеры частиц,
-
размеры частиц,
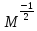 – молярные массы сталкивающих частиц,
– молярные массы сталкивающих частиц,
 -
температура.
-
температура.
Т.о. общее число столкновений в единице объема в газовой среде

учитывает все характеристики сталкивающих частиц константа, характеризующая сталкивающиеся молекулы (по размерам, молярным массам).
Число
столкновений с энергией
 подчиняется распределению Больцмана,
к – константа Больцмана
подчиняется распределению Больцмана,
к – константа Больцмана

Сумма по состояни….?
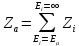
-
число активных столкновений в единичном объеме – это сумма всех столкновений, энергия которых не меньше
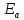 или
или

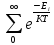 – сумма по состояниям, т.е. весь спектр
энергии для суммы по состояниям
– сумма по состояниям, т.е. весь спектр
энергии для суммы по состояниям
Поскольку
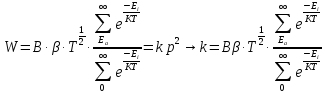
k – константа скорости.
т.о. нашли
зависимость константы скорости от всех
этих величин, затем
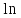 ???
???
Прологарифмируем
это уравнение и продифференцируем по
температуре (т.к. у нас есть уравнение
Аррениуса в дифференциальной форме
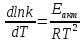
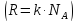 , где k - константа Больцмана
, где k - константа Больцмана
получим:
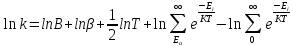
продифференцируем: (и получим с учетом некоторых ??? сокращений)
(как дифференцировать сложные функции?)
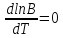
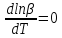
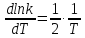
Пусть
имеется функция
 – как функция от f,
которая в свою очередь является
функцией от
– как функция от f,
которая в свою очередь является
функцией от
 ,
которая в свою очередь функция от
,
которая в свою очередь функция от
 , а та от – x и нужно
продифференцировать от x?
, а та от – x и нужно
продифференцировать от x?

 – внешняя функция
– внешняя функция
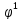 – внутренняя функция
– внутренняя функция
У нас
функцией F является
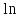 ,
что соответствует
,
что соответствует
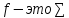 ,
,
 – это экспонента,
– это экспонента,


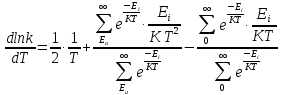
Условно
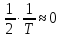
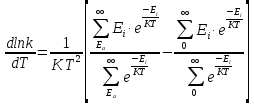
e – средняя энергия активного соударения
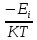 – средняя энергия всех
столкновений:
– средняя энергия всех
столкновений:

???
Второе отношение сумм представляет среднюю энергию всех столкновений в системе:

Уравнение можно переписать следующим образом:
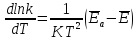
Умножение
числителя и знаменателя правой части
на постоянную Авогадро NA:
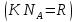 ,
где
,
где
 и
и
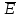 – соответственно средняя энергия 1
моль активных соударений и средняя
энергия всех соударений.
– соответственно средняя энергия 1
моль активных соударений и средняя
энергия всех соударений.

!!!!
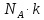 =R
=R
т.о. мы нашли, что энергия активации по теории активных столкновений есть разность между средней энергией активных столкновений и средней энергией столкновений вообще в расчете на 1 моль вещества.
Энергия активации равна резкости средней энергии 1 моль активных соударений и средней энергии 1 моль всех соударений.
Напомним, что уравнение имеет приближенный характер, т.к. при его выводе
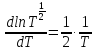
была принята
равной нулю
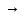

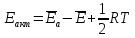
Это смысл энергии активации по теории активных столкновений (для реакций 2-го порядка)
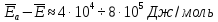
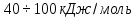
 можно при расчетах пренебречь
можно при расчетах пренебречь
Механизм мономолекулярных реакций по теории активных столкновений (схема Линдемана)
Механизм реакции, объясняющий появление 1-го порядка при столкновении 2-х молекул был предложен в 1922 г. Линдеманом и называется схемой Линдемана.
Согласно
этой схеме для мономолекулярной реакции
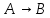 столкновения 2-х молекул не приводят к
мгновенному химическому превращению,
а его результатом является перераспределения
энергии молекул в момент удара и
образование частицы с избыточной
энергией
столкновения 2-х молекул не приводят к
мгновенному химическому превращению,
а его результатом является перераспределения
энергии молекул в момент удара и
образование частицы с избыточной
энергией
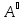
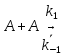
 ?????? молекула обладает избытком
энергии, возбужденная молекула
?????? молекула обладает избытком
энергии, возбужденная молекула
При
столкновении возбужденной и невозбужденной
молекулы возбуждения снимается с
константой
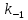 (протекает обратная реакция) или идет
превращение в продукты В с
(протекает обратная реакция) или идет
превращение в продукты В с
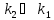
Зависимость
концентрации активных частиц от времени
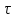 показана на рисунке.
показана на рисунке.
Концентрация
промежуточных продуктов, т.е. активных
молекул
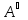 быстро достигает max
значения, а затем медленно снижается,
т.е. производная концентрация по времени
до точки максимума по абсолютной величине
может во много раз превышать производную
концентрации по времени после точки
максимума.
быстро достигает max
значения, а затем медленно снижается,
т.е. производная концентрация по времени
до точки максимума по абсолютной величине
может во много раз превышать производную
концентрации по времени после точки
максимума.

В связи с этим, можно для участка II, после max принять
 (так условие принимаем!)
(так условие принимаем!)
Это условие называется принципом квазистационарности.
В целом
скорость накопления активных частиц
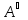 в соответствие с этой схемой описывается
уравнениями:
в соответствие с этой схемой описывается
уравнениями:

C учетом условия квазистационарности имеем (на участке II)
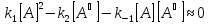
Решения
этого уравнения относительно концентрации
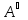 :
:
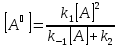
Скорость образования вещества В:
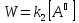 или
или
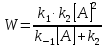
Если
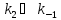 ,
то уравнение превращается в уравнение
скорости 2-го порядка:
,
то уравнение превращается в уравнение
скорости 2-го порядка:
суммарная
скорость

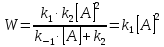
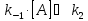

В случае
очень малой константы
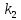 ,
т.е. когда
,
т.е. когда
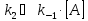 , то имеем уравнение скорости 1-го
порядка
, то имеем уравнение скорости 1-го
порядка

???
Как это
объяснить?
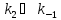 - 2-ой порядок
- 2-ой порядок
Если скорость
превращения активной частицы
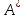 очень велика, то она существует очень
непродолжительное время и не успевает
сталкиваться с другими частицами. В
этом случае скорость реакции определяется
только стадией I и реакция
является бимолекулярной.
очень велика, то она существует очень
непродолжительное время и не успевает
сталкиваться с другими частицами. В
этом случае скорость реакции определяется
только стадией I и реакция
является бимолекулярной.
 – 1-й порядок
– 1-й порядок
Если частица
 существует в течение некоторого времени,
то вероятность ее столкновения с другими
частицами велика и скорость реакции в
целом растет со скоростью накопления
существует в течение некоторого времени,
то вероятность ее столкновения с другими
частицами велика и скорость реакции в
целом растет со скоростью накопления
 и их превращения в В (т.е. с ростом
и их превращения в В (т.е. с ростом
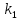 и
и
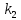 )
и убывает с ростом скорости превращения
активных частиц в исходные неактивные
(т.е. с ростом
)
и убывает с ростом скорости превращения
активных частиц в исходные неактивные
(т.е. с ростом
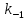 )
)
Схема Линдемана подтверждается данными, полученными при изучении реакций в газовых фазах.
При низких
давлениях р - 2-ой порядок

Столкновения
активных частиц
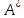 с
другими очень редки, они успевают
превратиться в продукты реакции, т.е.
с
другими очень редки, они успевают
превратиться в продукты реакции, т.е.
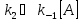 следует ожидать 2-ой порядок реш???
следует ожидать 2-ой порядок реш???


При высоких давлениях р – 1-ый порядок
Частота
столкновений возрастает, т.е.
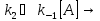 реакция описывается уравнением 1-го
порядка
реакция описывается уравнением 1-го
порядка

