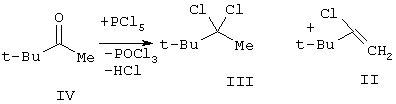- •Глава I Фосфор. Получение и применение фосфора . . . . . . . . . . . . . . . 3
- •История
- •Происхождение названия
- •Получение
- •Применение
- •Физические свойства
- •Химические свойства
- •Биологическая роль соединений фосфора
- •Получение
- •Применение
- •Токсичность
- •Номенклатура
- •Примеры
- •Источники
- •Химические свойства
История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что 9она, обладая золотистым цветом, может содержать золото или нечто нужное для добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.

Картина Джозефа Райта «Алхимик, открывающий фосфор» предположительно описывающая открытие фосфора Хеннигом Брандом, 1771 год
Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Происхождение названия
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φῶς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος) носил страж Утренней звезды.
Получение
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре 1600 °С:
![]()
Образующиеся пары фосфора конденсируются в приёмнике под водой в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
![]()
Применение
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
|
Хлорид фосфора(V) | |
|
| |
|
| |
|
Общие | |
|
Систематическое наименование |
Хлорид фосфора(V) |
|
Химическая формула |
PCl5 |
|
Физические свойства | |
|
Состояние(ст. усл.) |
белый порошок |
|
Отн. молек. масса |
208.22 а. е. м. |
|
Молярная масса |
208.22 г/моль |
|
Плотность |
1.6 г/см³ |
|
Термические свойства | |
|
Температура плавления |
160 °C |
|
Температура кипения |
возгоняется при 159 °C |
|
Химические свойства | |
|
Растворимостьв воде |
Реагирует |
|
Классификация | |
|
Рег. номер CAS |
10026-13-8 |
Хлорид фосфора(V)
Пентахлор́ид фо́сфора (хлорид фосфора(V), хлорангидрид фо́сфорной кислоты, пятихлористый фосфор) — соединение фосфора и хлора с формулой PCl5.
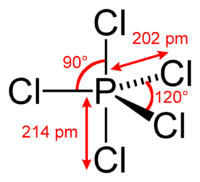
Молекула PCl5 в газообразном или жидком состояниях имеет конфигурацию тригональной бипирамиды с атомом фосфорав основании. Твёрдый пентахлорид фосфора состоит из тетраэдрических ионов [PCl4]+ и октаэдрических ионов [РCl6]− (d P—Cl в тетраэдре 0,197 нм, в октаэдре 0,204 нм (экваториальные) и 0,208
|
|
Свойства
При нагревании выше 300 °C, полностью разлагается на PCl3 и Cl2.
Пентахлорид фосфора типичное кислотное соединение. Он энергично реагирует с водой, образуя по первой стадии оксохлорид фосфора (V):
PCl5 + H2O → POCl3 + 2 HCl
В горячей воде гидролиз протекает полностью, до образования ортофосфорной кислоты:
PCl5 + 4 H2O → H3PO4 + 5 HCl
Для РCl5 характерны реакции окислительного хлорирования:
PCl5 + 2 NO2 → PCl3 + 2NO2Cl
C концентрированой серной кислотойобразуетхлорсульфоновую кислоту:
PCl5 + H2SO4 → ClSO2OH + POCl3 + HCl
При нагревании РCl5 и NH4Cl происходит реакция образования полимера фосфонитрилхлорида:
nPCl5 + nNH4Cl → (PNCl2)n + 4nHCl
(PNCl2)n — прозрачное эластичное вещество, «неорганический каучук». Выдерживает нагревание выше 200 °C. К сожалению, фосфонитрилхлорид сравнительно легко гидролизуется, что затрудняет его практическое использование. Заменой атомов Clна органические радикалы можно получить водоустойчивые полимеры.
Получение
Получают действием избытка хлоранахлорид фосфора(III):
PCl3 +
Cl2![]() PCl5 ΔH
= −124 кДж/моль
PCl5 ΔH
= −124 кДж/моль
Применение
PCl5 — сильный хлорирующий агент, его используют при получении хлорангидридов фосфорныхифосфоновых кислотизолефинов, в производстве лекарственных средств и красителей.
Токсичность
Токсичен, ПДК0,2 мг/м3.